南昆山毛叶茶对tBHP诱导损伤NIH3T3细胞的保护效果
2021-06-16刘诗妤陈忠正林晓蓉张媛媛周浪花
刘诗妤,陈忠正,林晓蓉,张媛媛,周浪花,高 雄,李 斌,*
(1.华南农业大学食品学院,广东广州 510642; 2.广东省科学院广东省微生物研究所,广东广州 510070)
南昆山毛叶茶(CamelliaptilophyllaChang)是二十世纪八十年代初中山大学植物分类学家张宏达教授在广东省龙门县南昆山首次发现的一种天然低或无咖啡碱的茶树资源[1]。与传统茶叶[Camelliasinensis(L).O.Kuntze]同属不同种,其主要代谢产物——儿茶素、生物碱具有明显差异,传统茶叶以顺式儿茶素和咖啡碱含量高,而南昆山毛叶茶以反式儿茶素和可可碱含量高[2-3]。功能特性研究表明,该茶叶具有抗氧化[4]、抗癌[5]、抗肥胖[6]、抗血管生成[7]等功能。2011年Peng等[4]以南昆山毛叶白茶、绿茶、红茶为材料,采用化学抗氧化法,与龙井、碧螺春、英红九号、祁门红茶等比较发现,南昆山毛叶绿茶的抗氧化性显著强于其他茶类。2012年Li等[8]用化学抗氧化法比较南昆山毛叶茶、苦茶、龙井茶抗氧化性的结果表明,南昆山毛叶茶抗氧化活性最强。2017年高雄等[9]采用细胞抗氧化活性法(cellular antioxidant activity,CAA)和化学抗氧化法研究表明,南昆山毛叶茶水提物抗氧化性强于云南大叶种茶水提物;2019年旷小珊等[2]采用化学抗氧化法及氧化应激细胞模型法研究南昆山毛叶茶中多酚物质的抗氧化活性表明,没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)具有较强的化学抗氧化活力,但其抗氧化机理并未深入研究。
正常人体内存在氧化系统和抗氧化系统平衡,氧化应激则是由于体内自由基产生过多或清除能力降低,引起体内平衡发生紊乱,自由基大量积累,导致细胞衰老和组织损伤[10-11]。自由基主要由活性氧自由基和活性氮自由基组成,抗氧化系统则分为酶系统[过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)]和非酶系统[谷胱甘肽(glutathione,GSH)、维生素E、辅酶Q10][12-13]。目前抗氧化研究可分为体内和体外二类。体内抗氧化法成本高、耗时长。体外抗氧化法又可分为化学抗氧化法和细胞模型法,其中细胞模型法具有用时短、成本低,比化学抗氧化法更具生物相关性,结果更具说服力等优点[14]。常用的细胞模型造模剂有叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)、过氧化氢等。tBHP是一种脂质的短链氢过氧化物类似物,与H2O2相比,化学性质更稳定,不易降解,因此应用广泛[15-16]。tBHP在损伤过程中产生叔丁基自由基,导致脂质过氧化,蛋白质巯醇基修饰和胞质钙离子浓度失调,膜渗透能力变化[17]。研究发现,tBHP可导致大量细胞凋亡,但也能导致坏死,甚至是铁死亡[16-18]。
为探讨南昆山毛叶茶抗氧化的作用机理,本研究采用tBHP作为诱导损伤剂,构建NIH3T3细胞氧化应激模型,在全面分析茶叶水提物的茶多酚等理化成分含量基础上,通过测定细胞存活率、活性氧(reactive oxygen species,ROS)生成量、抗氧化酶活性以及线粒体膜电位,研究其抗氧化活性,并通过测定凋亡蛋白的表达,系统地探究其触发细胞死亡途径及保护损伤机理,为南昆山毛叶茶的抗氧化等功能特性研究和开发利用提供理论研究基础。
1 材料与方法
1.1 材料与仪器
南昆山毛叶茶 2019年4月采自广东省惠州市龙门县南昆山采用微波杀青、微波干燥加工成干茶;NIH3T3细胞 源于广东省微生物研究所;杜氏改良高糖培养基(Dulbecco’s Modified Eagle Medium,DMEM)、胰蛋白酶、杜氏磷酸盐缓冲液(Dulbecco’s Phosphate Buffered Saline,DPBS)、胎牛血清(Fetal bovine serum,FBS) 美国Gibco公司;1%青霉素(100U/mL)和链霉素(100μg/mL) 瑞典Hyclone公司;SOD、CAT、GSH-Px活性检测试剂盒、MMP检测试剂盒、ROS检测试剂盒 碧云天生物技术有限公司;LDH、T-GSH、MDA检测试剂盒 南京建成生物工程研究所;caspase-3、caspase-9检测试剂盒 江苏凯基生物技术股份有限公司;细胞色素c、β-actin抗体 美国CST公司;MTT、儿茶素[(-)-catechin,C,≥98%]、表儿茶素(epicatechin,EC,≥98%)、儿茶素没食子酸酯(catechin gallate,CG,≥98%)、表没食子儿茶素(epigallocatechin,EGC,≥98%)、没食子儿茶素(gallocatechin,GC,≥98%)、表儿茶素没食子酸酯(epicatechin gallate,ECG,≥98%)、没食子儿茶素没食子酸酯(GCG,≥98%)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG,≥95%)、没食子酸(gallic acid,GA,≥97.5%~102.5%)、可可碱(≥99%)、茶碱(≥99%)、茶氨酸(≥98%) 美国Sigma公司;咖啡碱(99.9%) 上海生工生物有限公司;三氟乙酸色谱级、福林酚 麦克林生化科技有限公司;乙腈色谱级 德国Merck公司;硫酸分析纯 广州化学试剂厂;Poroshell 120 Bonus-RP色谱柱(4.6 mm×50 mm,2.7 μm) 美国Agilent公司。
Milli-Q Integral 3纯水机 德国Merk-Millipore公司;Alpha 1-2 LD plus冷冻干燥机 德国Martin Christ公司;VersaMax酶标仪 美国Molecular Devices公司;Agilent 1200高效液相色谱仪 美国Agilent公司;Axio Observer A1倒置荧光显微镜 德国Carl Zeiss公司;CytoFLEx流式细胞仪 美国Beckman Coulter;OmegaLum G化学发光仪 美国Aplegen公司。
1.2 实验方法
1.2.1 南昆山毛叶茶水提物制备 取干茶用研钵磨碎并筛分(20~30目),按茶水比1∶25 (w/v)加入100 ℃的一级水,100 ℃水浴浸提45 min,隔10 min振摇一次,趁热抽滤,滤液冷冻干燥,-20 ℃储存备用。
1.2.2 南昆山毛叶茶水提物主要化学成分含量测定
1.2.2.1 茶多酚的测定 采用福林酚比色法[19],适当修改。称取一定量的茶叶水提物,配制成0.2 mg/mL的试液,取1与5 mL福林酚试剂(10%)混合,反应5 min内,加入7.5%的Na2CO3溶液4 mL,混匀,加水定容,避光放置60 min。测定样品在765 nm波长下的吸光值,以GA为标准品制作标准曲线y=0.0109x+0.0035,R2=0.9995,计算样液中茶多酚浓度(mg/mL),并换算成占茶叶水提物的百分比(%),换算公式如下:
式中:C1:经标准曲线计算出样液中的茶多酚浓度(mg/mL);C2:加入的水提物浓度(mg/mL)。
1.2.2.2 儿茶素和生物碱的测定 参照Gao等[5]测定儿茶素生物碱含量的方法,进行适当修改。使用Agilent 1200高效液色谱仪及Poroshell 120 Bonus-RP(4.6 mm×50 mm,2.7 μm)色谱柱进行分离,柱温30 ℃,检测波长为280 nm,进样量为5 μL,流动相A为乙腈,B为0.05%三氟乙酸,进行线性梯度洗脱(0~26 min,A:0~28%,B:100%~72%),流速为0.8 mL/min,后运行4 min。由Agilent Chemstation B.04.02软件积分,拟合儿茶素和生物碱单体的标准曲线(如表1),采用归一化法计算其浓度(mg/mL),并换算成占茶叶水提物的百分比(%),换算公式如下:
式中:C1:经标准曲线计算出样液中的儿茶素/生物碱单体的浓度(mg/mL);C2:加入的水提物浓度(mg/mL)。

表1 儿茶素和生物碱单体的标准曲线表Table1 Stadard curves of catechin and alkaloid monomer
1.2.3 细胞培养 小鼠成纤维细胞NIH3T3经解冻复苏后,培养于37 ℃、5% CO2培养箱中,每隔2 d继代一次。培养液组成为89%的DMEM培养基、10% FBS、1%青霉素(100 U/mL)和链霉素(100 μg/mL)。
1.2.4 tBHP诱导损伤NIH3T3细胞模型的建立
1.2.4.1 诱导剂tBHP诱导损伤NIH3T3细胞浓度的确定 将NIH3T3细胞以5×104cell/mL,每孔200 μL,接种于96孔板中,于37 ℃、5%CO2培养箱中培养24 h,弃去旧培养液,同时加入100 μL tBHP溶液和100 μL新鲜培养液,使tBHP终浓度分别为0、25、50、100、200、300、400 μmol/L,24 h后弃去,加入MTT溶液,37 ℃培养2 h后弃去,加入二甲基亚砜(dimethyl sulfoxide,DMSO),37 ℃,100 r/min振摇15 min,用酶标仪测定其在550 nm处的吸光值。细胞存活率计算公式如下:
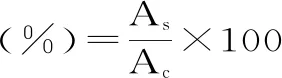
式中:As:不同浓度茶叶水提物处理后的吸光值;Ac:正常培养对照组的吸光值,将正常培养对照组细胞存活率当做100%。
其中正常培养的NIH3T3细胞为对照组,以使细胞存活率为50%~60%的tBHP浓度为诱导剂合适作用浓度。
1.2.4.2 南昆山毛叶茶水提物对NIH3T3细胞存活率影响的测定 细胞铺板培养同1.2.4.1,24 h后弃去旧培养液,同时加入100 μL茶叶水提物和100 μL新鲜培养液,使茶叶水提物终浓度分别为25、50、100、200、300、400 μg/mL,培养24 h后弃去,同1.2.4.1方法测定细胞存活率。
1.2.4.3 南昆山毛叶茶水提物对tBHP诱导损伤NIH3T3细胞存活率影响的测定 细胞铺板培养同1.2.4.1,24 h后弃去旧培养液,同时加入100 μL茶叶水提物(终浓度分别为25、50、100 μg/mL)和100 μL tBHP溶液(终浓度为200 μmol/L),24 h后弃去,同1.2.4.1方法测定细胞存活率。正常培养的NIH3T3细胞为对照组,tBHP单独处理为tBHP损伤组,tBHP和南昆山毛叶茶水提物共处理为样品组。
1.2.5 南昆山毛叶茶水提物处理NIH3T3细胞相关抗氧化指标测定
1.2.5.1 LDH酶活力的测定 细胞铺板培养及加样同1.2.4.3一致,tBHP和茶叶水提物共同作用24 h后,取细胞培养上清液,按试剂盒说明书,测定LDH活性。
1.2.5.2 抗氧化酶活力及MDA、GSH含量的测定 将NIH3T3细胞接种于培养皿中,细胞培养、加样及细胞分组同1.2.4.3一致,各处理组细胞经tBHP和水提物培养24 h后,收集细胞,用相应的细胞液裂解液充分裂解后,离心,取上清,以BCA蛋白定量试剂盒测定的细胞蛋白浓度为基础,按各试剂盒说明,分别测定SOD、CAT、GSH-Px的酶活力和MDA、GSH含量。
1.2.5.3 ROS含量的测定 将NIH3T3细胞接种于6孔板中,细胞培养、加样方式及细胞分组同1.2.4.3一致,tBHP和水提物共培养6h,弃去,加入2′,7′-二氯荧光素双乙酸盐(2′,7′-dichlorofluorescin diacetate,DCFH-DA)荧光探针溶液,37 ℃中避光孵育30 min,置于倒置荧光显微镜下观察,进行定性分析,用流式细胞仪进行定量分析。
1.2.5.4 MMP的测定 同1.2.5.3方法接种细胞于6孔板中,加样及细胞分组同1.2.4.3方法一致,共培养24 h,按试剂盒说明书的方法,孵育荧光染料,用流式细胞仪进行分析。
1.2.6 细胞凋亡检测 同1.2.5.2方法处理细胞并同1.2.4.3方法对其细胞进行分组,得到各处理组的细胞蛋白上清液,分别按5×上样缓冲液与蛋白样品1∶4 (v/v)比例混合煮沸后,插入冰上分装使用。以每孔20 μg蛋白上样量对蛋白进行电泳分离,湿转至膜上,5%脱脂奶粉封闭1 h,分别用细胞色素c及β-actin一抗,4 ℃孵育过夜;随后加入辣根过氧化物酶标记的二抗孵育1h,化学发光试剂盒显影,OmegaLum G化学发光成像系统曝光并拍照记录结果。
同1.2.5.2方法处理细胞,得到各处理组的细胞蛋白上清液,按照caspase-9、caspase-3试剂盒的方法对凋亡蛋白caspase-9、caspase-3的表达进行定量分析。
1.3 数据分析
图表数据以平均值±标准偏差,每个实验重复两次以上。利用软件Origin Pro 9.0进行统计分析和绘图。采用FluorChem分析蛋白条带光密度,以β-actin为内参蛋白做相对定量。采用CytExpert 2.0分析流式细胞仪结果。
2 结果与分析
2.1 南昆山毛叶茶水提物主要理化组成分析
为明确南昆山毛叶茶水提物的主要理化成分含量,本研究采用全量法提取、冻干,得到水提物,其得率为40.37%。采用相关国家标准等方法,测定茶多酚等主要理化成分含量并分析计算,结果如表2所示。
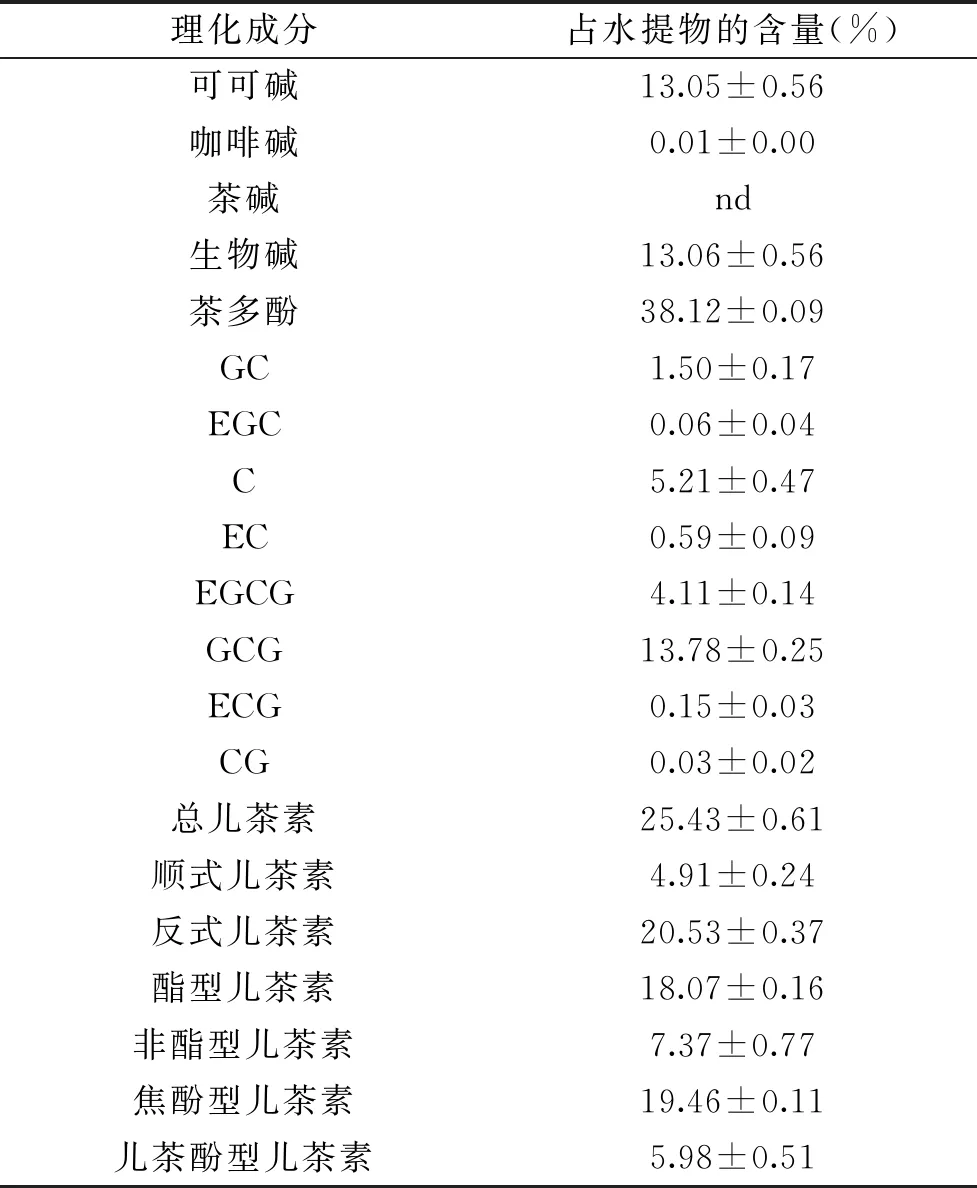
表2 南昆山毛叶茶水提物主要理化成分含量Table 2 Contents of major chemical components in water extracts of Camellia ptilophylla Chang
由表2结果可知,南昆山毛叶茶水提物含有约13.06%的生物碱,其以可可碱为主,占比高达99.92%,咖啡碱含量极低,未检测到茶碱;水提物含有较高比例的茶多酚,其中主要儿茶素单体占比为66.71%,且以GCG含量最高,占总儿茶素的54.19%;儿茶素组成以反式构象、酯型和焦酚型结构为主,占总儿茶素比例依次为80.73%、71.06%、76.52%。茶叶的抗氧化活性不仅受茶多酚含量影响,还与多酚组成有关[8]。Guo 和沈生荣等[20-21]研究表明,在较低浓度下(0.02 mmol/L),反式儿茶素GCG、GC、C清除自由基能力强于其差向异构体,其空间构象比顺式儿茶素更稳定,清除自由基效果更好。旷小珊等[2]发现GCG在30~60 μg/mL浓度范围内,清除DPPH自由基能力强于EGCG。3个相邻羟基是儿茶素清除自由基的关键结构,酯型、焦酚型儿茶素清除自由基能力强于非酯型、儿茶酚型结构[22]。在前人研究基础上,本研究对南昆山毛叶茶水提物这一茶多酚含量丰富,儿茶素含量高,且反式、酯型和焦酚型儿茶素占比高,而具有强抗氧化功效的可能机理开展相关研究。
2.2 NIH3T3细胞氧化损伤模型构建
为探究南昆山毛叶茶抗氧化活性,本研究以tBHP为诱导剂,采用NIH3T3细胞建立氧化损伤模型。结果如图1所示,不同浓度tBHP对NIH3T3细胞损伤程度不同;随着tBHP浓度的提高,细胞存活率逐渐降低。在浓度为200 μmol/L时,细胞存活率为54.00%,达到建模要求,故以该浓度建立氧化损伤模型。
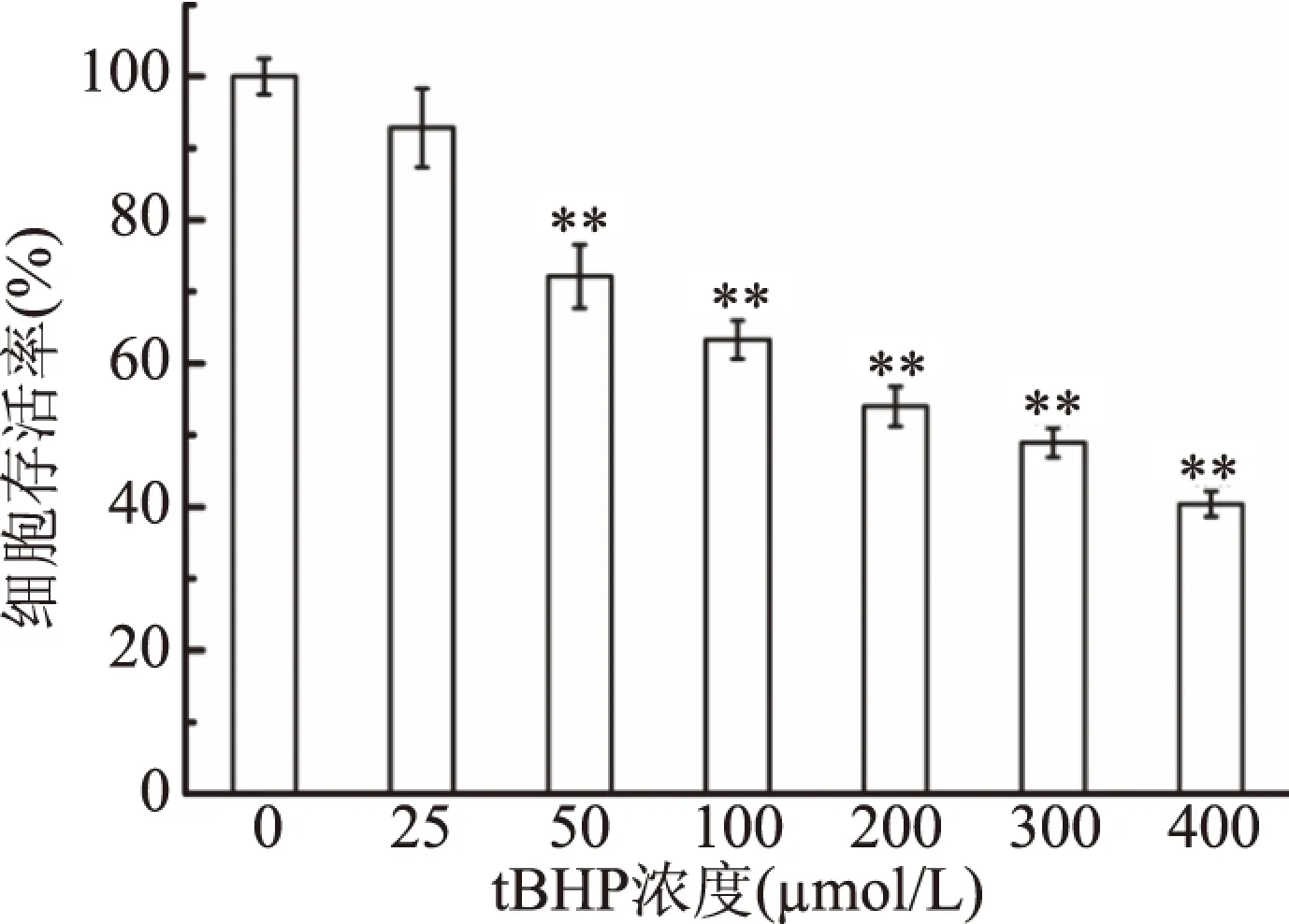
图1 不同浓度tBHP对NIH3T3细胞存活率的影响Fig.1 Effects of different concentrations of tBHP on the viability of NIH3T3 cells注:*代表样品组与对照组相比,*有显著差异, 即P<0.05,**有极显著差异,即P<0.01。
2.3 南昆山毛叶茶水提物对NIH3T3细胞存活率的影响
在探究茶叶样品对NIH3T3细胞氧化应激保护作用之前,本研究采用MTT法进行细胞毒性实验,确定茶叶水提物无毒副作用的浓度范围,以防止其对实验结果的干扰,结果如图2所示。
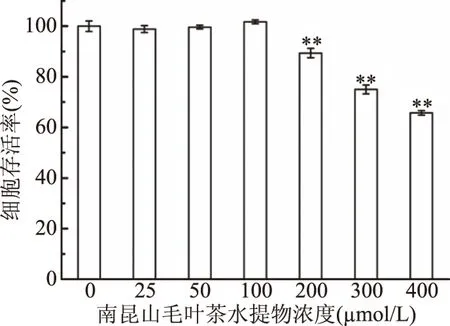
图2 南昆山毛叶茶中水提物对NIH3T3细胞存活率的影响Fig.2 Effect of Camellia ptilophylla Chang water extract on the viability of NIH3T3 cells 注:*代表样品组与对照组相比,*有显著差异, 即P<0.05,**有极显著差异,即P<0.01。
由图2结果可知,与对照组相比,南昆山毛叶茶水提物在25~100 μg/mL浓度范围内,细胞存活率无显著差异,在200~400 μg/mL浓度范围内,随着其浓度增加,NIH3T3细胞存活率极显著下降,低于89.38%,显示在该浓度范围内的南昆山毛叶茶水提物对该细胞的正常生长有毒副作用。故选择南昆山毛叶茶水提物25~100 μg/mL的浓度范围进行后续实验。
2.4 南昆山毛叶茶水提物对tBHP损伤NIH3T3细胞的保护作用
LDH作为细胞内标志性酶,其释放与细胞膜完整性相关[23]。LDH含量越高,表示细胞膜损伤程度越大,当损伤达到一定程度时,细胞死亡,整体存活率降低。因此本研究用MTT法测定南昆山毛叶茶水提物对tBHP诱导的NIH3T3细胞存活率的影响,用试剂盒法检测LDH活性,分析细胞损伤程度,结果如图3所示。

图3 南昆山毛叶茶水提物对tBHP诱导的 NIH3T3细胞存活率及细胞上清LDH活性的影响Fig.3 Effects of Camellia ptilophylla Chang water extract on the viability of tBHP-induced NIH3T3 cells andthe activity of LDH in cell supernatant注:A:细胞存活率;B:LDH活性;#代表tBHP组与对照组 相比,*代表样品组与tBHP组相比,#(*)有显著差异, 即P<0.05,##(**)有极显著差异,即P<0.01。
图3表明,200 μmol/L的tBHP使NIH3T3细胞存活率降低至49.68%,LDH酶的活力显著提高,提高至对照组的1.43倍。当加入的南昆山毛叶茶水提物浓度在25~100 μg/mL范围内时,能极显著提高NIH3T3细胞存活率和降低LDH酶活性,并呈剂量依赖关系。说明200 μmol/L的tBHP会损伤NIH3T3细胞,但加入特定浓度的南昆山毛叶茶水提物后,能减轻细胞膜损伤程度,提高细胞存活率,保护细胞免受氧化损伤。
2.5 氧化应激模型中SOD、CAT、GSH-Px酶活力和MDA、GSH含量的变化
SOD、CAT、GSH-Px均为内源性抗氧化酶,其活力增高代表细胞内的抗氧化活性增强[24]。MDA是脂质过氧化的第二产物,其含量越高代表脂质氧化程度越高,因此被广泛作为评价氧化应激状态的主要指标[25]。GSH是主要的氧化还原缓冲物,可清除ROS,含量越高,清除的ROS越多[26]。因此本研究采用试剂盒法检测南昆山毛叶茶对tBHP诱导NIH3T3细胞中SOD、CAT、GSH-Px抗氧化酶活力以及MDA、GSH的含量的影响,结果如图4所示。

图4 南昆山毛叶茶水提物对tBHP损伤NIH3T3细胞的SOD、CAT、GSH-Px酶活力和MDA、GSH含量的影响Fig.4 Effects of Camellia ptilophylla Chang water extract on the activity of SOD,CAT,GSH-Px and contents of MDA,GSH by tBHP damage in NIH3T3 cells注:A:CAT酶活力;B:SOD酶活力;C:GSH-Px酶活力;D:MDA含量;E:GSH含量;#代表tBHP组与对照组相比, *代表样品组与tBHP组相比,#(*)有显著差异,即P<0.05,##(**)有极显著差异,即P<0.01。
据图4结果可知,tBHP处理的NIH3T3细胞,与对照组相比,SOD、CAT、GSH-Px三种抗氧化酶活力和GSH含量极显著降低;而MDA含量极显著升高。而加入南昆山毛叶茶水提物的样品组,在25~100 μg/mL浓度范围内,三种抗氧化酶的活力均升高,且与tBHP组之间存在极显著差异,其中SOD和GSH-Px酶活力在茶叶水提物浓度为25 μg/mL时达到最高值,而CAT酶活力在50 μg/mL时方达到最高值;MDA含量极显著降低,并呈浓度依赖关系;GSH含量显著提高。综上所述,tBHP通过降低细胞内SOD、CAT、GSH-Px酶活力,导致细胞脂质氧化,MDA大量形成,GSH耗竭,从而打破体内氧化-抗氧化平衡,进而使细胞损伤。而南昆山毛叶茶水提物在本实验的25~100 μg/mL浓度范围内,能显著提高三种抗氧化酶的活力,抑制MDA的形成,提高GSH含量,从而对tBHP诱导的NIH3T3细胞氧化损伤起到保护作用,其中浓度为25 μg/mL时效果最佳。
2.6 氧化应激模型中ROS含量和MMP变化
ROS是导致细胞氧化损伤的主要因素,ROS含量越高,表明细胞损伤越大[24]。MMP指生物膜两侧离子浓度不同而产生的跨膜电位差,反应了线粒体膜的功能性,其下降是细胞凋亡早期的一个检测指标[27]。本研究利用倒置荧光显微镜和流失细胞仪分析了南昆山毛叶茶水提物对tBHP诱导的NIH3T3细胞ROS产生及MMP变化的影响,结果如图5、图6所示。

图6 南昆山毛叶茶水提物对tBHP损伤NIH3T3细胞MMP的影响Fig.6 Effects of Camellia ptilophylla chang water extract on MMP by tBHP damage in NIH3T3 cells注:A:流式细胞仪中荧光强度分布;B:流式细胞仪中平均荧光强度;#代表tBHP组与对照组相比, *代表样品组与tBHP组相比,#(*)有显著差异,即P<0.05,##(**)有极显著差异,即P<0.01。
由图5的荧光显微镜定性观察和流式细胞仪定量分析结果可知,与对照组相比,tBHP处理导致ROS大量产生,二者存在极显著差异。与tBHP组相比,南昆山毛叶茶水提物处理组极显著的降低ROS含量,且随茶叶水提物浓度的增加,ROS的产生量降低,呈剂量依赖关系。MMP结果从图6中可知,据图6A所示,对照组97.41%的细胞呈红色荧光,表明MMP和细胞状态较正常。而tBHP处理组中78.26%细胞呈绿色荧光,即MMP下降,细胞处于凋亡早期。南昆山毛叶茶水提物处理的样品组中,呈绿色荧光细胞的比例随水提物浓度的提高而逐渐降低,呈剂量依赖关系。当样品浓度达到100 μg/mL时,呈绿色荧光细胞的比例降低至10.63%,表明MMP随着水提物浓度的提高而增加,细胞中线粒体膜的损伤减少。由此说明,tBHP会导致MMP降低,细胞受损;而南昆山毛叶茶水提物随着添加浓度的升高,MMP升高,显示了其对NIH3T3细胞的氧化损伤具有保护作用。有研究发现tBHP能诱导的氧化应激损伤线粒体的软骨膜,而导致MMP降低[28]。同时MMP也是线粒体通透转换孔(mitochondrial permeablity transition pore,MPTP)开放的表征,而ROS则可以诱导MPTP开放,同时也促进自身线粒体产生ROS[27]。结合MMP和ROS结果可知,tBHP会导致NIH3T3细胞MMP降低,ROS含量增加,从而细胞受损;而南昆山毛叶茶水提物则会提高细胞MMP,降低ROS含量,减轻细胞受损程度,对细胞进行保护。
2.7 NIH3T3细胞凋亡相关蛋白的表达
caspase-3、caspase-9、细胞色素c均为凋亡蛋白,它们的活化程度越高及相对蛋白表达量升高,代表细胞发生凋亡[29-30]。为探究南昆山毛叶茶水提物对tBHP诱导NIH3T3细胞氧化损伤机制,本实验采用分光光度法检测caspase-3,caspase-9 蛋白活化程度,WB法检测细胞色素c蛋白表达,结果如图7所示。
Caspases在细胞凋亡过程中起关键作用,caspase-9可被线粒体向细胞质释放的细胞色素c激活,激活的caspase-9可引起caspase-3的活化,活化后的caspase-3能裂解相应的底物,最终导致细胞凋亡[29]。细胞色素c是一种高度保守的电子转运蛋白,也是定位于线粒体膜间隙的呼吸链的一部分,它的释放与MMP的下降有关[30-31]。由图7A、7B可看出,tBHP处理组的caspase-9、caspase-3凋亡蛋白的活性显著提高,而南昆山毛叶茶水提物处理的样品组中的caspase-9、caspase-3蛋白活性相较于tBHP组显著降低,并呈剂量依赖关系。图7C、7D结果显示,本实验tBHP处理组的细胞色素c蛋白表达显著增强,而南昆山毛叶茶水提物处理样品组的表达显著降低,并呈剂量依赖关系。综上结果表明,tBHP通过活化caspase-3、caspase-9蛋白,增强细胞色素c表达,导致NIH3T3细胞凋亡;而南昆山毛叶茶水提物则随着添加浓度的升高,caspase-3、caspase-9的活化程度降低,细胞色素c表达降低,部分抑制NIH3T3细胞凋亡。说明南昆山毛叶茶水提物能部分抑制tBHP导致的NIH3T3细胞凋亡。
3 结论
本研究通过构建tBHP诱导NIH3T3细胞氧化损伤模型,评估南昆山毛叶茶水提物的抗氧化活性,并对其抗氧化机理进行初步探究。
南昆山毛叶茶水提物具有高可可碱、低咖啡碱,高GCG、低EGCG含量的特点;tBHP能诱导NIH3T3细胞氧化损伤,并导致细胞凋亡;南昆山毛叶茶水提物在25~100 μg/mL浓度范围内,通过提高NIH3T3细胞中CAT、SOD、GSH-Px抗氧化酶酶活力,提高GSH含量,降低MDA含量,阻止脂质过氧化,减少ROS的积累,维持正常的MMP,同时减少细胞色素c的释放,抑制caspase-9、caspase-3凋亡蛋白的表达,抑制线粒体细胞凋亡途径,从而有效减缓tBHP诱导的NIH3T3细胞的氧化损伤。
