替普瑞酮对亚慢性苯并[a]芘染毒大鼠神经行为改变的保护作用
2021-06-15李玲常珊珊吕懿蒋勇王慧郑金平
李玲,常珊珊,吕懿,蒋勇,王慧,郑金平,2
1.山西医科大学公共卫生学院卫生毒理学教研室,山西 太原 030001
2.长治医学院公共卫生与预防医学系,山西 长治 046000
苯并[a]芘(benzo[a]pyrene,BaP)是最常见的环境和职业污染物之一,其在体内的活化代谢产物不仅具有致癌性,对生殖系统、免疫系统也具有一定毒性。由于BaP 的亲脂性,其易在神经组织集聚,可引起神经毒作用[1]。BaP 的暴露可引起人神经系统异常如认知功能障碍、学习困难、副交感神经失调和短期记忆丧失,以及大鼠学习记忆能力损伤和行为改变[2-3]。本课题组前期流行病学调查结果也显示,BaP 职业暴露人群焦炉工人的神经行为发生改变,主要表现在短期和空间学习记忆能力降低,与BaP 接触水平之间存在剂量-效应关系[4]。
替普瑞酮是一种萜烯类化合物,作为胃黏膜保护药,临床上主要用于治疗胃溃疡、急慢性胃炎。有研究显示替普瑞酮可限制脊髓损伤后继发性损伤、神经元死亡以及进行性坏死和空化,具有神经保护作用,是热休克蛋白和其他神经保护蛋白的诱导剂[5],但其是否可以防治BaP 诱发的神经毒作用尚不清楚。本研究旨在观察替普瑞酮对亚慢性BaP 染毒大鼠神经行为的影响,探讨其防治BaP神经毒作用的可行性。
1 对象与方法
1.1 试剂及仪器
橄榄油(中国成都科龙化工试剂厂),替普瑞酮(中国信阳莱耀生物科技有限公司),BaP(美国Sigma-Aldrich),Morris 水迷宫(中国医学科学院药物研究所),Annexin V-FITC/PI 试剂盒(中国南京凯基生物科技发展有限公司),BCA 试剂盒(中国武汉博士德生物工程有限公司),PVDF 膜、鼠抗热休克蛋白70(heat shock protein,Hsp70)单克隆抗体、GAPDH 抗体及羊抗鼠二抗(美国Epitomics)。
1.2 实验动物与分组
选择健康清洁级SD 雄性大鼠40 只,体重为180~200 g,活动能力相近,由山西医科大学实验动物中心提供,动物合格证号:SCXK(JIN)2015-0001。本实验遵循动物实验等有关规定,通过山西医科大学实验动物伦理委员会的审批(编号:DW2020051)。将大鼠饲养在自然节律采光(采光约11 h,黑暗约13 h),温度为18~23℃,相对湿度为40%~60%,清洁安静的环境中。适应性饲养1周后,将大鼠随机分为橄榄油溶剂对照组、替普瑞酮组、BaP染毒组和替普瑞酮+BaP染毒组,每组10只。每周称1次大鼠体重,按800 mg·kg-1体重剂量灌胃替普瑞酮,腹腔注射6.25 mg·kg-1BaP,实验中替普瑞酮及BaP 均由橄榄油溶解,隔日染毒,连续染毒90 d。
1.3 实验方法
1.3.1 学习记忆能力检测采用Morris 水迷宫法检测小鼠学习记忆能力,水迷宫实验分为定位航行实验(实验前4 d)和空间探索实验(实验第5 d),实验具体操作参照文献[6]。
1.3.2 海马组织病理学检查大鼠经水迷宫行为训练结束后,断头处死,迅速分离双侧海马,用10%中性福尔马林溶液固定24 h后,常规脱水,透明,浸蜡,包埋制作石蜡切片(切片厚5 μm),贴附于多聚赖氨酸预处理过的载玻片上,常规HE 染色,封片,光学显微镜下观察海马组织的病理学变化。
1.3.3 TUNEL 法检测大鼠海马细胞凋亡大鼠经水迷宫行为训练结束后,断头处死,迅速分离双侧海马,石蜡切片按常规方法脱蜡至水,PBS 漂洗3 遍(每次5 min);加入蛋白酶K工作液37℃反应30 min左右,PBS漂洗3遍(每次5 min);4%多聚甲醛室温固定30 min,PBS漂洗3遍(每次5 min);浸入封闭液中封闭10 min,PBS漂洗3遍(每次5 min),进行标记反应。
1.3.4 Annexin V-FITC/PI法检测大鼠海马细胞凋亡率取大鼠海马组织剪碎、过滤后,用预冷PBS 洗两遍,加入不含EDTA 的胰酶消化,消化后加入预冷PBS重悬,1 000 r·min-1离心5 min(离心半径13.5 cm),弃上清,收集细胞,预冷PBS 重悬细胞并计数。取1×105~5×105个重悬细胞,1 000 r·min-1离心5 min(离心半径13.5 cm),弃上清,加入500 μL结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀后,加入5 μL碘化丙啶,轻轻混匀。室温避光孵育10 min 后采用流式细胞仪进行检测。
1.3.5 Western blotting 法检测Hsp70 蛋白表达水平海马组织提取蛋白后,用BCA 试剂盒测定蛋白浓度,预冷PBS 将各组蛋白调至同一浓度,加入5×上样缓冲液,95℃加热20 min,1 000 r·min-1离心5 min(离心半径13.5 cm),取上清,即得海马组织提取蛋白。制胶(7.5%分离胶)、上样、电泳、转膜(PVDF 膜)后,5%脱脂奶粉封闭2 h,加入鼠抗Hsp70 单克隆抗体(1∶1 000)和GAPDH(1∶1 000),4℃摇床过夜。回收一抗,洗膜液洗膜3 次,加入羊抗鼠二抗孵育1 h,洗膜3 次后显影。结果用图像处理扫描仪扫描胶片,采用捷达801 系列凝胶电泳图像分析软件对蛋白电泳带的密度进行半定量分析,以Hsp70/GAPDH值表示蛋白的表达量。
1.4 统计学分析
用SPSS 20.0软件进行统计分析,数据用±s表示,多组比较用单因素方差分析,组间两两比较用LSD-t法。Morris 水迷宫测试结果,经对数转换后进行分析。检验水准α=0.05。
2 结果
2.1 动物基本情况
大鼠给药后,替普瑞酮组与对照组大鼠均无明显行为异常改变;BaP染毒组出现烦躁易惊、活动减少、进食减少、昏睡、眼屎增多;替普瑞酮+BaP 染毒组仅表现为活动减少,无其他明显异常行为改变。
2.2 动物染毒过程中体重变化情况
各处理组大鼠实验前对照组、替普瑞酮组、BaP 染毒组和替普瑞酮+BaP 染毒组体重分别为(188.00±4.63)、(186.14±3.42)、(183.20±9.60)、(184.16±6.26)g,各处理组体重差别无统计学意义。染毒结束后对照组、替普瑞酮组、BaP 染毒组和替普瑞酮+BaP 染毒组体重分别为(335.71±25.90)、(333.19±27.36)、(283.42±33.95)、(311.10± 22.38)g,替普瑞酮+BaP 染毒组体重增长大于BaP 染毒组(P<0.05)。
2.3 大鼠Morris水迷宫结果
如表1、2 显示,BaP 染毒组第1~4 天寻找平台的逃避潜伏期时间及寻找平台总路程高于对照组、替普瑞酮组(P<0.05);BaP 染毒组寻找平台的平均逃避潜伏期、平台象限停滞时间和平均总路程高于对照组、替普瑞酮组(P<0.05)。替普瑞酮+BaP 染毒组第1、4 天寻找平台的逃避潜伏期时间[(47.27±1.92)、(29.32±1.91)s]短于BaP染毒组[(63.10±1.70)、(45.71±2.04)s](P<0.05),替普瑞酮+BaP染毒组第2~4天寻找平台总路程[(189.17±1.28)、(143.88±1.25)、(120.72±1.81)cm]高于替普瑞酮组[(124.12±1.94)、(109.11±1.34)、(89.61±1.46)cm](P<0.05)。替普瑞酮+BaP染毒组寻找平台的平均逃避潜伏期[(29.17± 1.90)s]和平均总路程[(132.51±1.96)cm]低于BaP 染毒组[(46.77± 2.14)s、(181.97±2.09)cm](P<0.05)。
表1 大鼠寻找平台潜伏期和平台象限滞留时间结果(±s,n=10)Table 1 Escape latency and quadrant retention time of rats (±s,n=10)单位(Unit):s
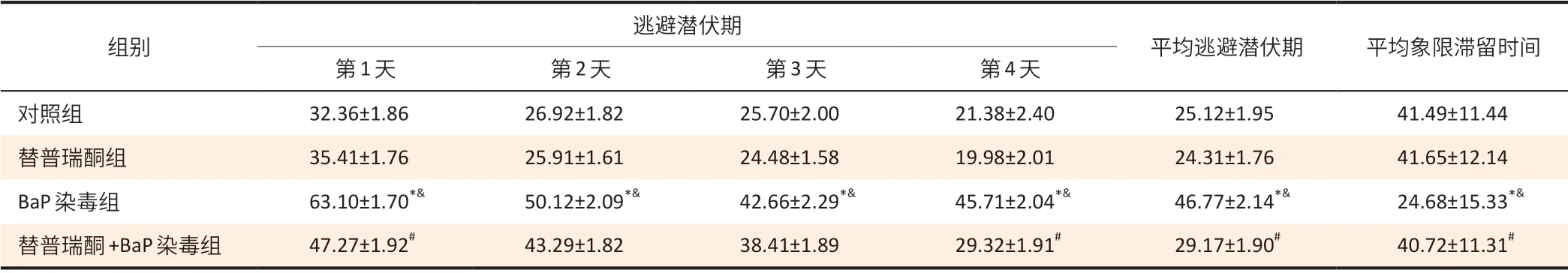
表1 大鼠寻找平台潜伏期和平台象限滞留时间结果(±s,n=10)Table 1 Escape latency and quadrant retention time of rats (±s,n=10)单位(Unit):s
[注]*:与对照组相比,P<0.05;&:与替普瑞酮组相比,P<0.05;#:与BaP组相比,P<0.05。
逃避潜伏期组别平均逃避潜伏期 平均象限滞留时间第1天 第2 天 第3 天 第4 天对照组 32.36±1.86 26.92±1.82 25.70±2.00 21.38±2.40 25.12±1.95 41.49±11.44替普瑞酮组 35.41±1.76 25.91±1.61 24.48±1.58 19.98±2.01 24.31±1.76 41.65±12.14 BaP 染毒组 63.10±1.70*& 50.12±2.09*& 42.66±2.29*& 45.71±2.04*& 46.77±2.14*& 24.68±15.33*&替普瑞酮+BaP 染毒组 47.27±1.92# 43.29±1.82 38.41±1.89 29.32±1.91# 29.17±1.90# 40.72±11.31#
表2 大鼠寻找平台总路程结果(±s,n=10)Table 2 Total distance of rats spent on maze searching (±s,n=10)单位(Unit):cm
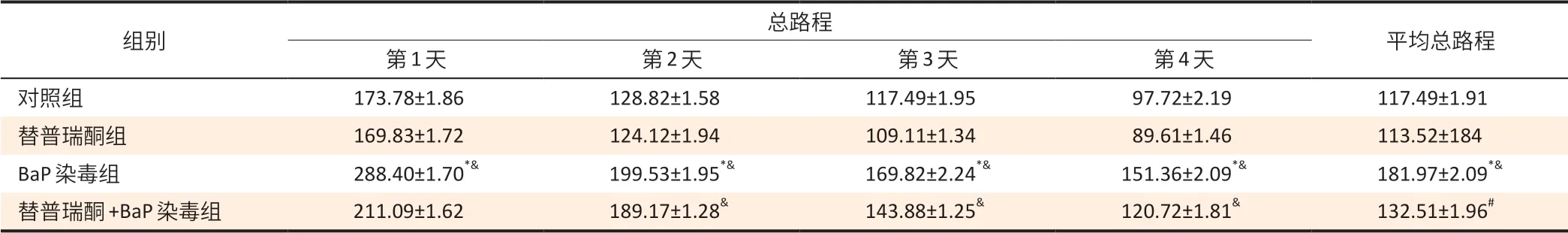
表2 大鼠寻找平台总路程结果(±s,n=10)Table 2 Total distance of rats spent on maze searching (±s,n=10)单位(Unit):cm
[注]*:与对照组相比,P<0.05;&:与替普瑞酮组相比,P<0.05;#:与BaP组相比,P<0.05。
组别 总路程 平均总路程第1 天 第2天 第3天 第4 天对照组 173.78±1.86 128.82±1.58 117.49±1.95 97.72±2.19 117.49±1.91替普瑞酮组 169.83±1.72 124.12±1.94 109.11±1.34 89.61±1.46 113.52±184 BaP染毒组 288.40±1.70*& 199.53±1.95*& 169.82±2.24*& 151.36±2.09*& 181.97±2.09*&替普瑞酮+BaP 染毒组 211.09±1.62 189.17±1.28& 143.88±1.25& 120.72±1.81& 132.51±1.96#
2.4 海马组织病理学结果
图1显示,对照组、替普瑞酮组大鼠海马区未见明显病理改变。BaP 染毒组大鼠海马出现严重细胞损伤,细胞结构破坏,轮廓模糊,海马区神经细胞数量减少、排列凌乱,出现明显凋亡特征性改变,如细胞连接松解、细胞核固缩、细胞周围出现环状带等,部分细胞出现坏死表现,胞核聚集、浓缩、溶解等;而替普瑞酮+BaP 染毒组仅见个别细胞松解,海马区神经细胞数量多于BaP染毒组,替普瑞酮+BaP染毒组比BaP染毒组损伤明显减轻。

图 1 大鼠海马组织形态学变化 (HE染色)Figure 1 Morphological changes of rat hippocampus (HE staining)
2.5 大鼠海马神经细胞凋亡结果
TUNEL 法检测结果显示,BaP 染毒组可诱发大鼠海马神经细胞凋亡率升高。见图2。与对照组[(3.64±2.86)%]相比,替普瑞酮组[(5.41±0.58)%]、替普瑞酮+BaP 染毒组[(11.63±2.58)%]大鼠海马神经细胞凋亡率无明显差异(P>0.05),替普瑞酮组及替普瑞酮+BaP 染毒组海马细胞凋亡率低于BaP 染毒组[(31.11±5.54)%](P<0.001)。
流式细胞仪检测结果显示,与对照组[(0.27±0.12)%]相比,替普瑞酮组[(0.40±0.28)%]大鼠海马神经细胞凋亡率无明显差异,BaP染毒组[(53.10±7.34)%]海马神经细胞的凋亡率升高,替普瑞酮+BaP 染毒组海马细胞凋亡率[(7.73±5.16)%]低于BaP 染毒组。BaP 染毒组海马神经细胞凋亡率高于对照组、替普瑞酮组(P<0.05)。
2.6 大鼠海马组织Hsp70蛋白表达
图3显示,替普瑞酮+BaP 染毒组Hsp70 蛋白表达水平(0.89±0.09)高于BaP 染毒组(0.49±0.10),差异有统计学意义(P<0.05)。BaP 染毒组大鼠海马组织Hsp70 蛋白表达水平最低,且与对照组(1.07±0.30)、替普瑞酮组(1.12±0.28)相比有明显差异(P<0.05)。
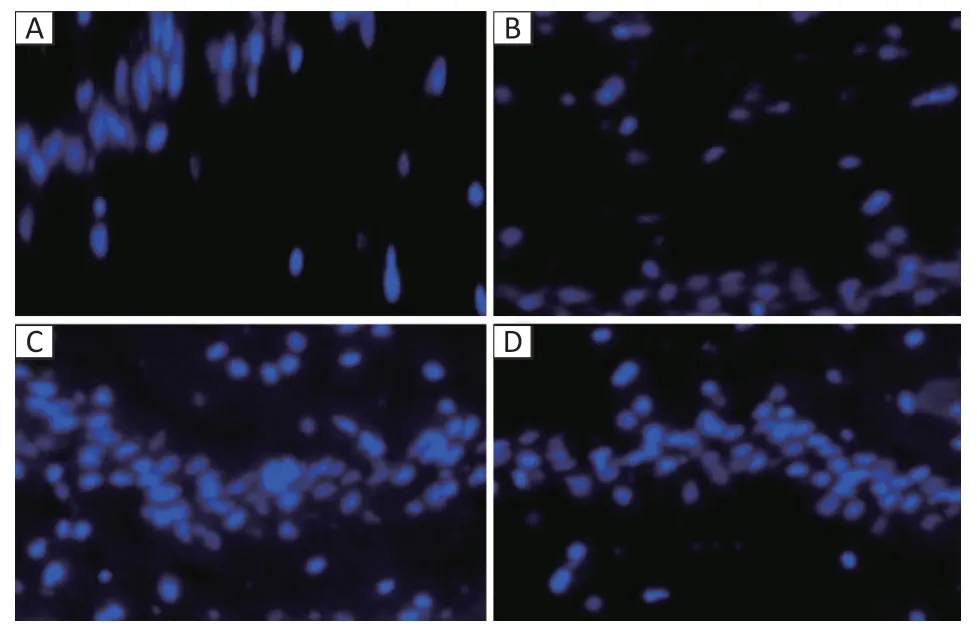
图 2 大鼠海马神经细胞凋亡Figure 2 Apoptosis of rat hippocampal neurons

图 3 大鼠海马组织Hsp70 蛋白表达Figure 3 Hsp70 protein expression in rat hippocampus
3 讨论
BaP 作为一种常见环境污染物,具有明显的神经毒性,可导致神经行为和认知功能障碍,长期暴露于BaP 的大鼠和人表现出明显的学习困难和记忆障碍。亚慢性BaP 暴露同样可以导致大鼠行为学改变。大鼠早期暴露于BaP 会导致持续性的神经损伤,并持续到青春期和成年期[7]。经母乳摄入BaP 可引起子代大鼠发育早期运动能力及记忆认知功能的下降[8]。本次研究结果显示,大鼠经BaP 染毒后出现烦躁、易激惹、活动减少、昏睡、眼屎增多、进食减少、体重明显降低等现象。Morris 水迷宫结果显示,BaP 染毒组有明显的神经行为改变。组织病理学结果显示,BaP 染毒大鼠海马出现严重细胞损伤。此外,BaP 染毒组海马细胞的凋亡率明显升高。表明BaP 染毒可导致大鼠神经行为改变和神经组织损伤。
替普瑞酮是一种萜烯类化合物,因其具有组织修复和较强的抗溃疡作用而一直用于治疗消化道溃疡。目前研究认为替普瑞酮是一种有效的、低毒副作用的热休克蛋白和其他神经保护蛋白的诱导剂,可在多种器官、组织中发挥保护作用[5]。单次口服替普瑞酮后,大鼠脑星形胶质细胞激活并可减轻大鼠海马区由海藻酸引起对的癫痫发作和神经元细胞死亡[9-10],发挥神经保护作用。本研究结果显示,替普瑞酮组和对照组大鼠相比,行为无明显变化,替普瑞酮+BaP 染毒组只见轻微的行为异常改变。替普瑞酮+BaP 染毒组大鼠寻找平台的平均逃避潜伏期、平均总路程明显低于BaP 染毒组,且该组大鼠神经行为损伤并不明显。组织病理学结果显示,替普瑞酮+BaP染毒组较BaP 染毒组细胞损伤减轻,仅有部分出现细胞核固缩,细胞周围出现环状带。而且BaP 染毒大鼠经替普瑞酮处理后海马细胞凋亡率明显低于BaP 染毒组。以上结果表明,替普瑞酮可以拮抗BaP引起的神经毒性。
Hsp70可经多种刺激诱导大量生成,其可以通过发挥分子伴侣作用、抗细胞凋亡及抗氧化作用提高细胞的应激能力,对各类损伤具有抵抗能力。而且Hsp70在应激和非应激情况下均能在脑组织中表达,当脑组织应激损伤时,能发挥其保护作用。同时,以往的研究中发现替普瑞酮可以诱导大鼠胃黏膜、肝脏、心脏以及中枢神经系统中Hsp70的表达,而目前的研究认为替普瑞酮是Hsp70 有效的诱导剂。在此基础上,进一步测定了Hsp70 蛋白的表达水平,发现BaP可导致Hsp70的表达水平显著下调,而替普瑞酮+BaP染毒组可明显提升Hsp70 表达水平。Hsp70 具有抗氧化和抗凋亡的作用,Hsp70基因遗传多态性与神经毒性及其他多种疾病相关。研究发现焦炉工人的Hsp70-1 CC和Hsp70-2 AA基因型可能增加注意力、学习和记忆等的神经行为损伤的风险[11]。而Hsp70的激活又可通过促进聚谷氨酰胺蛋白降解来降低神经毒性[12]。同时BaP染毒引起的神经毒性中Hsp70表达减少可能与线粒体凋亡途径的激活有关,可以引起细胞凋亡。研究表明,口服替普瑞酮的大鼠可抵抗热应激,其作用与诱导产生的热休克蛋白成正比,此外,Hsp70 还与替普瑞酮的抗胃黏膜凋亡作用有关[13-14]。BaP染毒大鼠经替普瑞酮处理后Hsp70蛋白表达上调,也减少了细胞凋亡,减轻了神经元的损害,增加神经元的存活,改善因BaP染毒引起的神经行为改变。因此推测,替普瑞酮可能通过提升Hsp70表达,减少细胞凋亡,从而改善BaP神经毒性。
综上,替普瑞酮可以改善经BaP 暴露引起的神经行为改变,上调Hsp70 蛋白表达,减少细胞凋亡,减轻神经元的损害,从而发挥神经保护作用。
