低温胁迫对军曹鱼幼鱼脂代谢相关生理生化的影响
2021-06-12蔡润佳黄建盛张健东潘传豪王忠良谢瑞涛汤保贵
蔡润佳,张 静,黄建盛,陈 刚,张健东,潘传豪,王忠良,谢瑞涛,汤保贵,3
(1.广东海洋大学水产学院,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088;4.广东恒兴饲料实业股份有限公司,广东 湛江 524000;5.农业农村部华南水产与畜禽饲料重点实验室,广东 湛江 524088)
水温是影响鱼类生存最重要环境因子之一,与鱼类多种生命活动密切相关[1]。1971 年,Lyons 等[2]指出,低温可导致膜脂从液相向凝胶相转变,并导致生物膜内物质大量向膜外泄露,打破生物膜内外离子平衡。自此,低温与生物脂代谢的关系广受关注。在鱼类方面,邵彦翔等[3]发现,随水温不断降低,云纹石斑鱼 (Epinephelus moara,♀) × 鞍带石斑鱼 (E.lanceolatus,) 杂交后代血清甘油三酯(TG)呈先升后降再升趋势。He 等[4]研究表明,低温胁迫对吉富罗非鱼(GIFTOreochromis niloticus)肌肉脂肪酸不饱和度有明显提高作用,对增强细胞膜流动性有较大作用。Alba 等[5]应用转录组测序技术对低温胁迫下的金头鲷(Sparus aurata)进行肝脏转录组分析,结果发现肝脏在低温下产生的大量差异基因富集在脂代谢的相关通路上。可见,调节脂代谢是鱼类应对低温胁迫的重要措施之一。
军曹鱼(Rachycentron canadum)属于鲈形目(Perciformes)军曹鱼科(Rachycentridae)军曹鱼属(Rachycentron),适宜温度范围为21~ 31 ℃,属于暖水性鱼类,分布于地中海、印度-太平洋(东太平洋除外)等海域,在我国南方部分海域也有少量分布[6]。军曹鱼对低温的不耐受性导致其在我国只能在南方养殖。目前,关于军曹鱼在低氧胁迫[7]、盐度适应[8]、营养[9]等已有研究报道,而军曹鱼温度相关研究主要涉及温度对生长和抗氧化酶活性的影响[10-11],对低温条件下的军曹鱼生理调节机制了解极为有限。笔者研究低温条件下军曹鱼的脂代谢,旨在补充军曹鱼在低温条件下生理调节机制资料,为进一步培育军曹鱼耐低温品种提供参考。
1 材料和方法
1.1 实验动物
广东海洋大学鱼类种子工程与养殖实验室人工繁育的军曹鱼幼鱼,体质量(211.17±9.51)g,体长(32.68±0.78)cm,于湛江恒兴南方海洋科技有限公司6 个300 L 养殖桶中暂养5 d。设置低温组和常温对照组,每组设3 个平行组。随机取鱼90 尾,每组15 尾。常温对照组采用流水养殖且不间断充气,保持溶氧5 mg/L 以上,水温(30.5±1.0)℃,每天08:00 和16:00 饱食投喂。低温组采用冰块(以密封瓶装冰)降温法以2 h/℃匀速降温至(20.0 ± 0.5)℃,幼鱼由于低温不摄食故不投喂饲料,实验期间静水养殖,每天更换50%等温新鲜海水,不间断充气,使溶氧保持在5 mg/L 以上。每天用水质检测试剂盒监测水质,保持6 个桶氨氮质量浓度小于0.02 mg/L,亚硝酸盐质量浓度小于0.01 mg/L,pH 7.4~ 7.8。
1.2 样品采集
根据预实验结果,军曹鱼幼鱼在20 ℃下半致死时间为7 d,故正式实验周期设为7 d。在1、4、7 d时每桶分别随机采样3 尾。采样前停饲24 h,采样时用丁香酚麻醉后于尾静脉处采血;取部分肝脏样品,用体积分数4%多聚甲醛溶液固定,制作切片;肌肉、部分肝脏和腹腔脂肪样品分装入标记有采样时间、实验处理方式和组织来源的封口袋;血液置4 ℃冰箱12 h,以3 500 r/min、15 min、4 ℃条件离心,血清于-80 ℃冰箱保存;切片样品常温保存;其余样品-80 ℃冰箱中保存,用以检测脂肪酸组成。
1.3 生化指标分析
采用全自动生化分析仪(深圳雷杜生命科技,Chemray800)测定血清甘油三酯(TG)、总胆固醇(T-CHO)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)含量;血清丙二醛(MDA)含量、总抗氧化能力(T-AOC)均用酶标检测仪(BioTeK,Epoch)根据南京建成生物工程研究所的商业试剂盒说明书测定。
1.4 肝脏组织学观察
参考萧培珍[12]方法制作肝脏切片。样品经磷酸盐缓冲液(PBS)冲洗、梯度蔗糖溶液脱水、包埋、冷冻切片机切片、恢复室温、油红O 染色、封片等步骤,用体视镜(Leica M205FCA)观察并采集图像,用Image J 软件统计切片脂滴面积。
1.5 肝脏、肌肉、腹腔脂肪组织脂肪酸组成分析
肝脏、肌肉和腹腔脂肪组织(IPF)用烘箱60 ℃烘干至恒重,用粉碎机粉碎样品,每个样品称取50 mg,分别加入2 mL 体积分数0.5%的硫酸-甲醇溶液,于60 ℃水浴锅中温浴1 h,再分别加入2 mL 正己烷混合萃取,静置,取上层清液加入适量无水硫酸钠,采用气相色谱法进行脂肪酸组成分析(委托恒兴质量检测中心进行)。
1.6 统计分析
实验数据用平均值±标准差表示。采用SPSS 19.0 软件的T检验对数据进行差异分析。当P<0.05时表示差异显著,P<0.01 时表示差异极显著。
2 结果与分析
2.1 低温胁迫对幼鱼血清脂代谢相关指标的影响
低温条件下饲养1 d 时,军曹鱼幼鱼血清TG含量显著高于对照组(P<0.05),而4 d、7 d 时,低温组血清TG 含量均升高,与同期对照组差异极显著(P<0.01)(图1_a)。军曹鱼血清T-CHO 含量在低温条件下呈先降后升再降的趋势,1 d 时显著低于对照组(P<0.05),4 d 时显著高于对照组(P<0.05),7 d 时则下降至与对照组水平(P>0.05)(图1_b)。低温胁迫下军曹鱼血清HDL 在1 d 和4 d 时含量无明显变化(P>0.05),7 d 时则显著下降(P<0.05)(图1_c)。血清LDL 含量在低温胁迫1 d 时与对照组无显著差异(P>0.05);4 d 时升高并显著高于对照组(P<0.05);7 d 时含量进一步升高,与对照组差异极显著(P<0.01)(图1_d)。
2.2 低温胁迫对幼鱼血清氧化指标的影响
低温饲养1 d 时,军曹鱼幼鱼血清MDA 含量极显著升高(P<0.01),4 d 时最高,7 d 时下降,但仍显著高于同期对照组(P<0.05)(图2_a)。血清T-AOC 整体呈下降趋势,1 d 时与对照组无显著差异(P>0.05),4 d 时显著降低(P<0.05),7 d 时进一步降低,极显著低于对照组(P<0.01)(图2_b)。
2.3 低温胁迫对幼鱼肝脏脂滴分布的影响
常温条件下,军曹鱼幼鱼脂滴均匀分布,无明显空白区域,且脂滴边缘清晰,融合现象不明显(图3)。低温条件下,1 d 时,脂滴融合,形成形状不规则的较大脂滴,但无明显空白区;4 d 时,脂滴融合现象有所减少,大部分脂滴边缘清晰;7 d 时,出现较多空白区域,脂滴界限模糊,普遍融合成片。统计肝脏油红O 染色切片脂滴面积,低温组脂滴面积在1、4、7 d 时均极显著高于对照组(图3_g)。
2.4 低温胁迫对幼鱼肝脏、腹腔脂肪和肌肉脂肪酸组成的影响
军曹鱼幼鱼应对20 ℃的低水温环境时,肝脏、腹腔脂肪及肌肉组织脂肪酸代谢不同。表1 可见,肝脏脂肪酸中,饱和脂肪酸(Saturated fatty acid,SFA)7 d 内与对照无显著差异(P>0.05),单不饱和脂肪酸(Monounsaturated fatty acid,MUFA)含量平均值不断下降,但与对照组差异不显著(P>0.05),多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)含量总体上不断上升,7 d 时极显著高于对照组(P<0.01),n-6 系列PUFA 7 d 时显著提高(P<0.05)。表2 可见,腹腔脂肪脂肪酸中,SFA、MUFA含量在低温胁迫时保持相对稳定(P>0.05),而PUFA 含量在1 d 时即显著高于对照组(P<0.05),在4 d 和7 d 时含量进一步提高并极显著高于同期对照组(P<0.01),其中n-3 系列PUFA 从1 d 时起即极显著高于对照组(P<0.01),n-6 系列在1 d、4 d 时显著高于对照组(P<0.05),并在7 d 时与对照组差异极显著(P<0.01)。肌肉脂肪酸组成变化见表3,低温胁迫下,低温组三种脂肪酸占总脂肪酸比例与对照组无显著差异(P>0.05)。
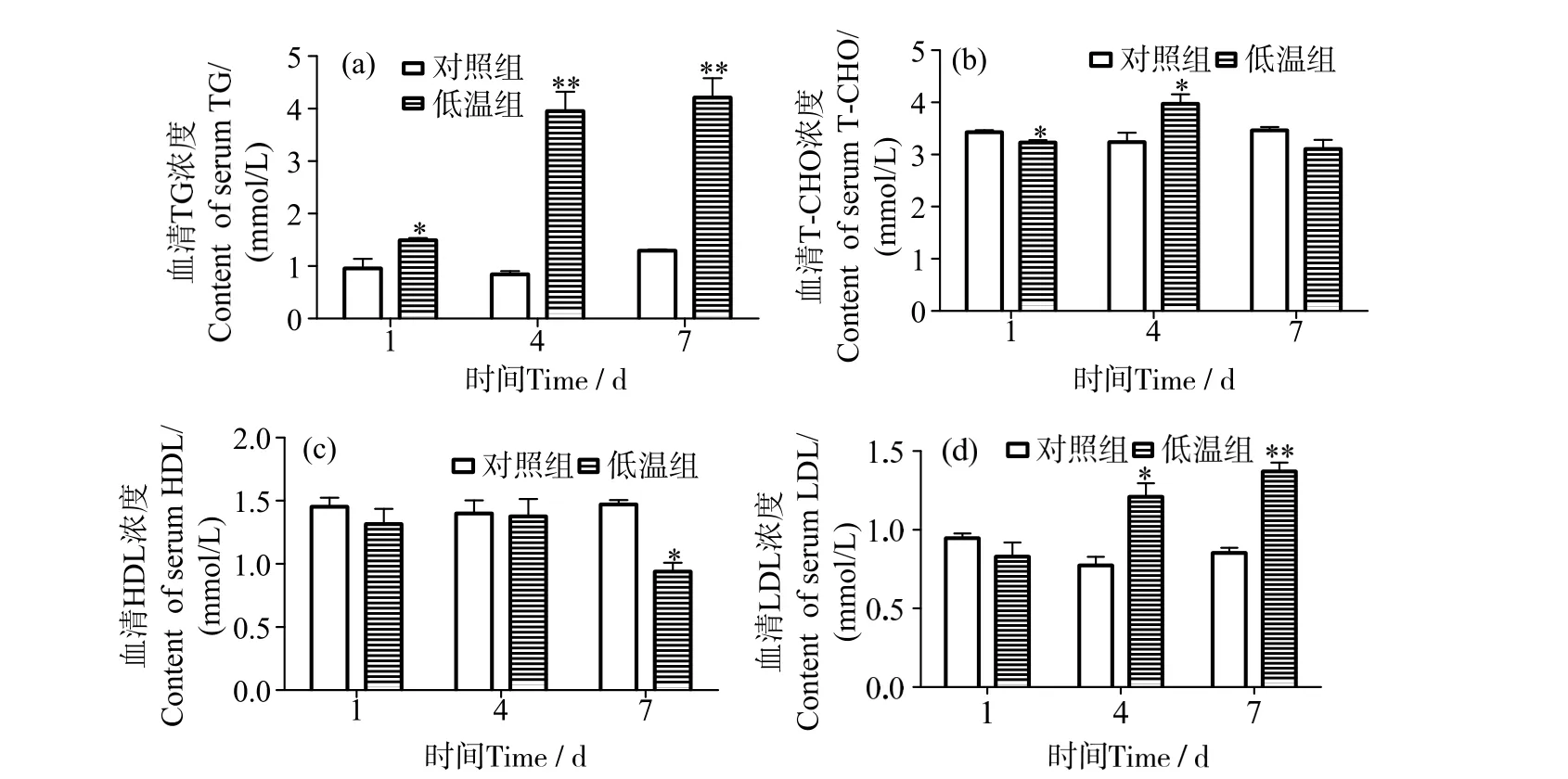
图1 低温胁迫对军曹鱼血清TG、T-CHO、HDL 和LDL 含量的影响Fig.1 Effects of low temperature stress on the content of TG,T-CHO,HDL and LDL in serum of cobia

图2 低温胁迫对军曹鱼血清MDA 和T-AOC 含量的影响Fig.2 Effects of low temperature stress on the content of MDA and T-AOC in serum of cobia

图3 军曹鱼肝脏组织学观察及脂滴面积统计Fig.3 Histological observation of cobia liver and lipid droplet area statistics

表1 低温胁迫对军曹鱼肝脏脂肪酸组成的影响Table 1 Effects of low temperature stress on fatty acid composition of liver in cobia
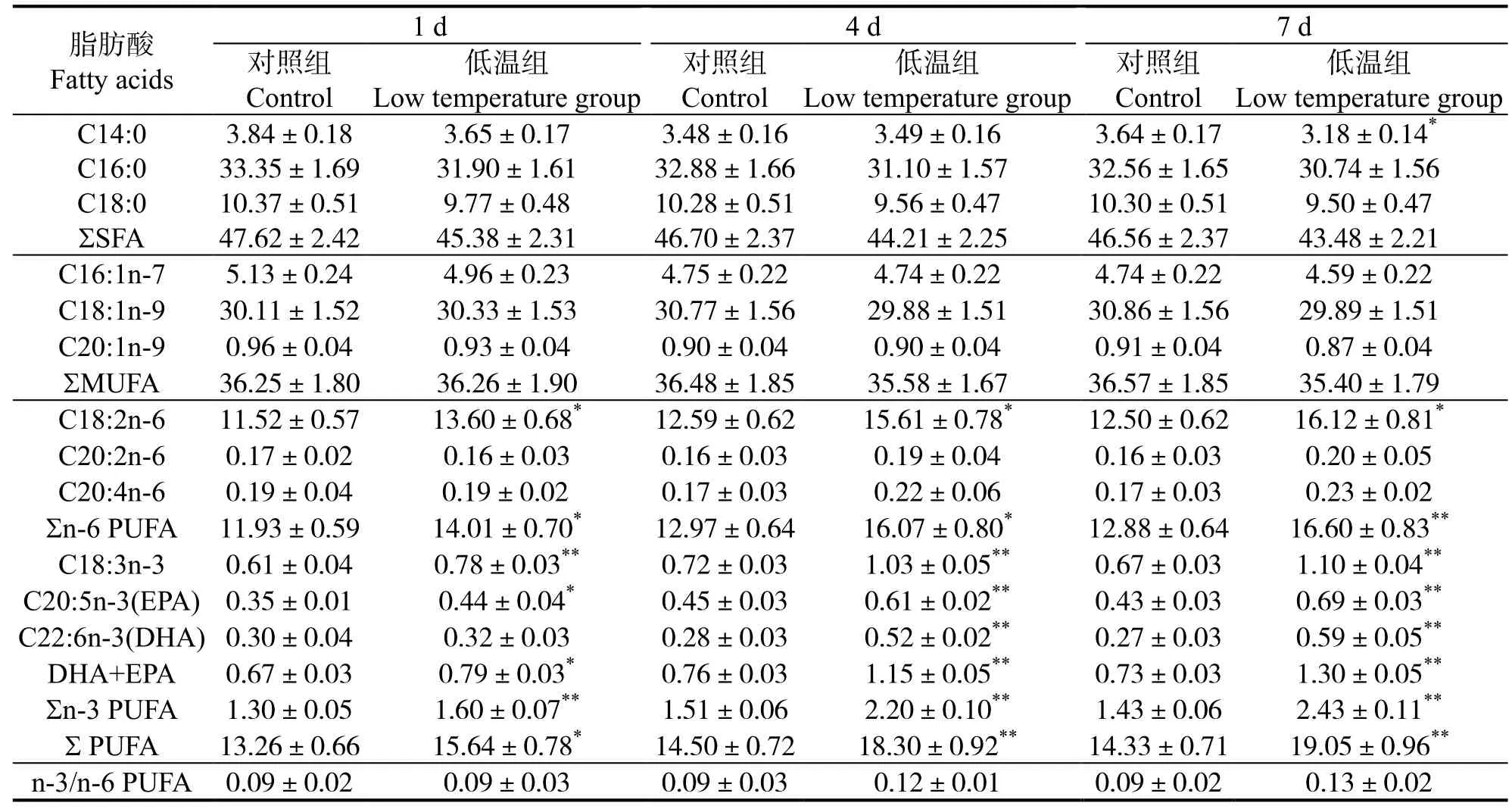
表2 低温胁迫对军曹鱼腹腔脂肪脂肪酸组成的影响Table 2 Effects of low temperature stress on fatty acid composition of IPF in cobia
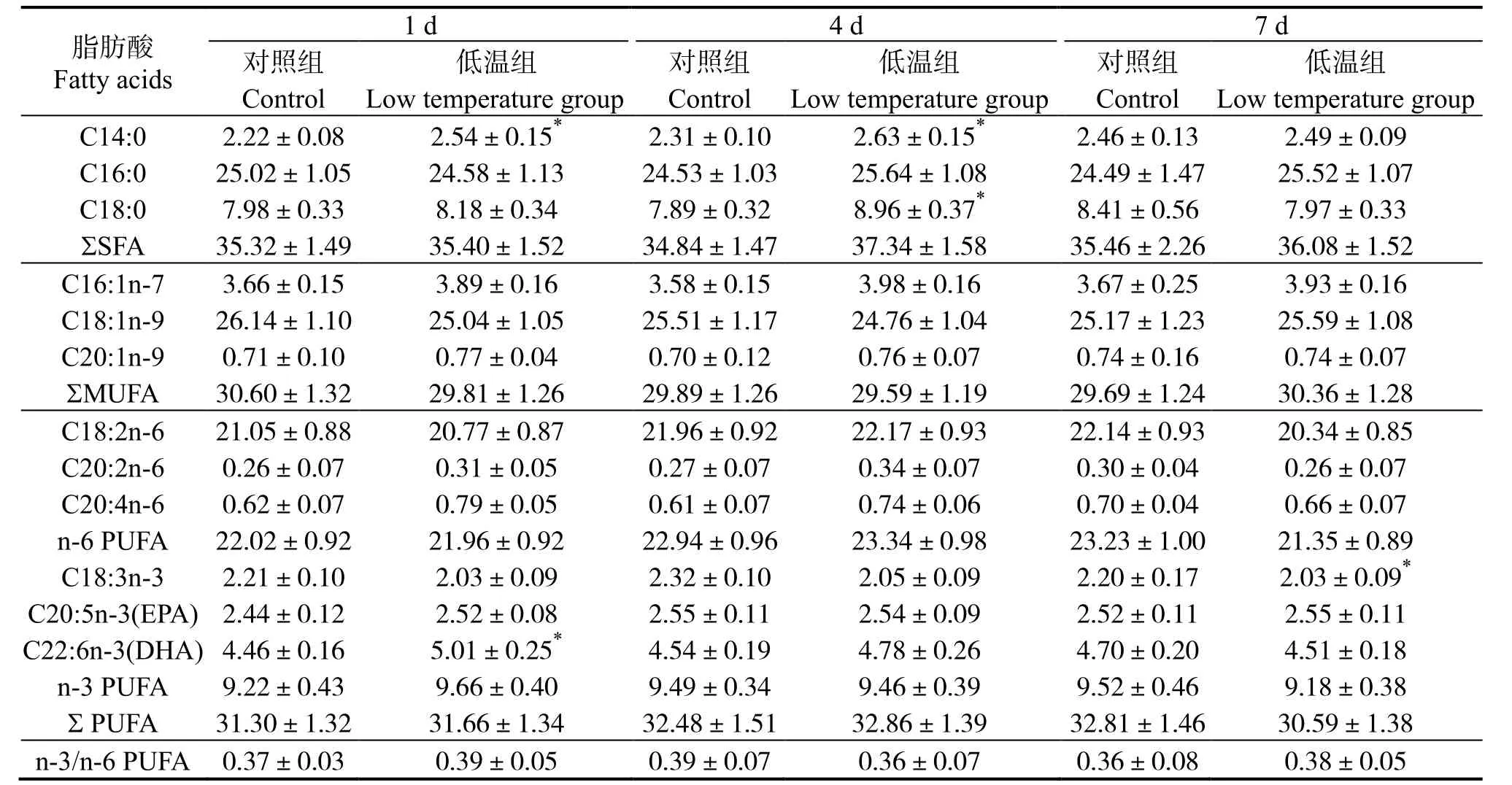
表3 低温胁迫对军曹鱼肌肉脂肪酸组成的影响Table 3 Effects of low temperature stress on fatty acid composition of muscle in cobia
3 讨论
3.1 低温胁迫对军曹鱼幼鱼血脂水平的影响
血液是动物物质代谢的重要载体,血液生化指标改变可指示机体多种生理变化[13]。血脂(TG 和T-CHO)水平可反映机体脂代谢情况。TG 是储存在鱼体的高效能量源,对鱼体能量代谢有重要调节作用。本研究中,军曹鱼血清TG 在20 ℃胁迫1 d 时即显著提高,4、7 d 时持续升高至与对照组差异极显著。在吉富罗非鱼[14]、暗纹东方鲀(Takifugu fasciatus)[15]、鲤鱼(Cyprinus carpio)[16]等研究中也发现相似结果。鱼类在低温环境下无氧代谢增强,有氧代谢与脂代谢受抑制,使血清TG 消耗量减少,血清TG 增多[14]。但不同鱼类血清TG 对低温胁迫的响应不同。低温胁迫褐蓝子鱼(Siganus fuscescens)导致鱼体血清TG 呈先升后降趋势[17],而斜带石斑鱼(Epinephelus coioides)则呈与褐蓝子鱼完全相反结果,有先降后升趋势[18]。多鳞白甲鱼(Onychostoma macrolepis)血清TG 在低温胁迫前3 h 逐步上升,6 h 时显著下降而后又逐渐上升[19]。这种物种间的血脂变化差异机制有待进一步研究。
血清胆固醇主要是细胞浆膜、类固醇激素等的合成原料,适宜血清胆固醇水平是保持细胞膜流动性的条件之一[20]。当血清T-CHO 含量减少时,可能会干扰细胞膜稳态从而影响多种生化过程[14],本研究中,军曹鱼血清T-CHO 在低温胁迫1 d 时显著降低,但在4 d 时升至极显著升高,7 d 时又降至对照组水平,说明军曹鱼对血清T-CHO 的调节能力较强。在尼罗罗非鱼(Oreochromis niloticus)[21]和斜带石斑鱼[20]中均发现低温会减少血清T-CHO含量。可见,不同物种的血清T-CHO 对低温胁迫的响应不尽相同。低温会导致军曹鱼血清LDL 在4 d 和7 d 时升高,HDL 7 d 时降低。LDL 主要从肝脏向外周组织转运内源胆固醇,而成熟的HDL 是机体从外周组织回收内源性胆固醇的载体,有清除血浆中胆固醇的作用。血清LDL、HDL 对低温胁迫的响应表明军曹鱼脂代谢出现异常。
3.2 低温胁迫对军曹鱼幼鱼组织脂肪酸组成的影响
脂肪酸对生物体代谢有重要作用。吉富罗非鱼在水温28、22 ℃条件下饲养40 d 后,22 ℃组肌肉SFA、MUFA、PUFA 含量均与28 ℃组无显著差异,仅n-6 系列PUFA 显著高于28 ℃组[22];而吉富罗非鱼在13 ℃低温胁迫时,随着胁迫时间的延长,肌肉中SFA 含量持续下降,MUFA 和PUFA 均呈先升后降趋势[4];谢妙等[20]发现,斜带石斑鱼在20 ℃条件下胁迫15 d 后,肌肉SFA 含量显著下降,MUFA和PUFA 含量则显著上升。可见,组织脂肪酸组成对低温胁迫的响应与物种、环境条件、胁迫时间等均有较大关系。本研究中,不同组织对低温胁迫的响应也存在较大差异。在脂肪酸组成方面对低温胁迫响应最小的组织是肌肉,各脂肪酸均与对照组无显著差异。其次是肝脏,MUFA 含量有下降趋势,而PUFA 含量则在7 d 时显著高于对照组。对低温胁迫响应程度最大的组织是IPF,其中n-3、n-6 系列PUFA,总PUFA 均不断增加,在1 d 时即显著或极显著高于对照组。研究表明,PUFA 在维持细胞膜结构[23]、参与信号传递[24]等方面均有重要作用,所以提高PUFA 的占比可能是军曹鱼对低温胁迫的适应性调节方式之一。对鲤鱼[25]、尖吻鲈[26]等的研究均发现,低温环境会提高不饱和脂肪酸比例,这是鱼体为提高细胞膜流动性,而削弱低温导致细胞膜流动性差的负面影响的结果。
3.3 低温胁迫对军曹鱼幼鱼氧化应激的影响
鱼体在抗氧化系统调节下,体内活性氧(ROS)较低并保持动态平衡[27]。当鱼体处于低温环境时ROS 逐渐积累,过量的ROS 会促进脂肪酸尤其是不饱和脂肪酸发生过氧化反应,ROS 主要攻击脂肪酸侧链位置,可从脂质双键中提取氢原子改变脂质结构[28],最终生成丙二醛和壬烯等脂质过氧化终产物,还会进一步生成过氧自由基,进一步加剧机体过氧化[29]。军曹鱼血清T-AOC 随低温胁迫时间的延长而显著降低,抗氧化能力的降低会导致机体ROS 含量升高,从而阻碍正常脂代谢[30]。且鱼体在低温环境下占比增多的多不饱和脂肪酸比饱和脂肪酸更易积累ROS[31],这可能是军曹鱼在低温胁迫1 d 时就迅速积累大量丙二醛的原因。肝脏是鱼体脂代谢最重要调节器官,低温可诱导暗纹东方鲀肝脏凋亡相关基因的表达[32],在虹鳟(Oncorhynchus mykiss)[33]、斜带石斑鱼[20]等物种中,低温会导致谷丙转氨酶和谷草转氨酶显著升高,指示肝细胞受损伤。本研究中,军曹鱼肝脏低温胁迫后出现脂滴分布不均、融合、边缘模糊、脂滴面积极显著增加等现象,也说明了肝脏脂代谢活动出现异常。
3.4 低温胁迫时不摄食与常温条件下饥饿的血脂响应机制
低温条件下,军曹鱼不摄食,与常温饥饿胁迫同属内源性营养代谢阶段,但鱼体响应两种胁迫的血脂相关指标表现不同。胡文君[34]发现,黄鳝(Monopterus albus)于5 ℃环境时,与25 ℃正常投喂组相比THO 含量显著降低,HDL 含量显著升高,而TG 和LDL 含量则与对照组无显著差异。而当黄鳝于25 ℃环境中进行饥饿胁迫时,THO、TG和HDL 含量均与25 ℃正常投喂组无显著差异,而LDL 含量则显著降低,表明血脂指标在低温胁迫和常温饥饿胁迫中,除血清TG 外,血清THO、HDL和LDL 等指标均有不同的变化趋势,故推测低温胁迫的脂代谢调节机制与饥饿胁迫不同,本研究低温胁迫结果与停食的关系不大。
4 结论
军曹鱼幼鱼在低温胁迫过程中,机体抗氧化能力降低并积累大量MDA,从提高血清TG 含量、增加血清胆固醇含量(增加LDL、减少HDL)、调整肝脏和IPF 中的脂肪酸组成等方面响应低温胁迫。
