低频电针“胃脘下俞”对2型糖尿病大鼠胰腺形态和分泌功能的调控作用研究*
2021-06-11曹昺焱高誉珊张淑静
曹昺焱,李 瑞,陈 卓,肖 京,高誉珊,张淑静
(1.中国中医科学院西苑医院,北京 100091;2.北京中医药大学,北京 100029)
糖尿病是位列心血管疾病、肿瘤之后的第三大损害人类生命和健康的非传染性疾病[1]。流行病学显示我国2013年糖尿病患病率为10.4%,其中绝大多数为2型糖尿病[2]。2型糖尿病的致病因素有:①胰岛B细胞形态、功能受损;②肝、脂肪和骨骼肌等胰岛素的主要靶细胞胰岛素抵抗[3]。针灸是WHO认可的糖尿病可行治疗手段之一[4],其相关记载见于《备急千金要方》曰:“消渴咽喉干,灸胃管下俞三穴各百壮”。有研究表明,电针“胃脘下俞”能显著降低模型动物空腹血糖[5-6]、血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇[7]等指标,并显著改善胰岛素抵抗指数和胰岛素敏感指数[8],其机理涉及上调骨骼肌胰岛素信号通路,改善胰腺形态和功能[9-10]。胃脘下俞穴位于背俞功能带上,其所在的T8脊神经节位于支配胰腺传入神经节的中心,其具有调节胰腺形态和功能的物质基础。对胃脘下俞穴进行刺激理应能通过神经传导改善胰腺形态和分泌功能,达到降低血糖的作用。本研究以胰高血糖素样肽1(Glucagon-like peptide-1,GLP-1)为切入点,探讨低频电针对2型糖尿病大鼠胰腺形态和功能的干预作用,为电针胃脘下俞穴降糖作用提出解释。
1 材料与方法
1.1 实验动物
实验动物为体质量(155±5)g的雄性清洁级SD大鼠[斯贝福(北京)实验动物科技有限公司,动物许可证号:SCXK(京)2011-004]。动物于23°C恒温、60%恒湿、昼夜循环光照和自由饮食水的环境中适应性饲养1周后,依体质量随机选取13只大鼠为空白组,不造模。其余大鼠以高脂饮食饲养结合腹腔注射链脲佐菌素(Streptozotocin,STZ)制备2型糖尿病大鼠模型。成模动物根据空腹血糖随机分为模型组、电针组,每组12只。实验设计经北京中医药大学实验动物伦理委员会审核批准(批准号:BUCM-3-2013090401-3001)。
1.2 主要试剂与仪器
普通饲料及高脂饲料(北京华阜康生物科技股份有限公司);链脲佐菌素、柠檬酸和二水柠檬酸钠(美国Sigma公司);罗氏血糖仪(GC12723032)、罗氏血糖试纸(LOT24626232)(德国Roche公司);Masson染色试剂(福州迈新生物技术开发公司);KWD-808电针(常州英迪电子医疗器械有限公司);无菌针灸针(LOT031426,北京中研太和医药有限公司);Legend micr017r离心机(美国Thermo公司);BX53显微镜(奥林巴斯公司);GLP-1受体多克隆抗体(LOT:GR193702-1,美国Abcam公司)。
1.3 模型制备
造模动物经7周配方为70%普通饲料、10%蔗糖、10%猪油和10%蛋黄粉的高脂饲料喂养后,禁食过夜。次日以2%的STZ溶液(溶液配置:0.1 mol/L柠檬酸缓冲液和0.1 mol/L柠檬酸钠缓冲液按1.3∶1比例混匀,按20 mg/mL的质量体积比溶解STZ粉末;STZ溶液制备于冰上完成,30 min内完成注射)按照35 mg/kg的比例腹腔注射。于STZ注射后72 h检测大鼠随机血糖(Random blood glucose,RBG);于STZ注射14 d后进行口服葡萄糖耐量实验(Oral glucose tolerance test,OGTT)。RBG>16.7 mmol/L且OGTT 2 h血糖>11.1 mmol/L者判定为成模,并随机分为模型组、电针组。
自评估成模之日起,模型组、电针组改以普通饲料喂养。
1.4 干预方法
1.4.1 空白组及模型组 不进行电针干预。
1.4.2 电针组 以0.16 mm×7 mm针灸针向内斜刺双侧“胃脘下俞”穴(穴位定位于大鼠第8胸椎棘突下旁开5 mm[11]),针刺深度4 mm。双侧穴位均接通电针。电针正极连接针刺“胃脘下俞”穴的针灸针针柄,负极连接于粘贴在大鼠同侧后足上的以0.9%氯化钠溶液浸湿的棉球,形成回路。电针参数:2 Hz连续波,电流强度2 mA。留针20 min,6次/周,共4周。
1.5 取材和指标检测
1.5.1 空腹血糖检测 全部动物于末次治疗结束后禁食过夜,次日早8:00尾尖取血测空腹血糖(Fasting blood glucose,FBG)。
1.5.2 空腹胰岛素检测 测空腹血糖后,动物以2%戊巴比妥纳溶液按照45 mg/kg比例腹腔注射麻醉,腹主动脉取血。血样本于室温静置凝固后,于4 ℃环境下3 000 r/min离心15 min,分离血清。由北京华英生物技术研究所以酶免法检测空腹胰岛素含量。
1.5.3 胰岛B细胞分泌功能检测 B细胞功能指数(HOMA-B)=20×空腹胰岛素/(空腹血糖-3.5)。
1.5.4 胰腺形态学检测 以HE染色和Masson染色观察:动物腹主动脉取血致死后,取相同部位胰腺组织于20倍体积的波恩氏液固定72 h;此后经石蜡包埋,制备5 μm连续切片。HE染色步骤:切片以二甲苯脱蜡2次,每次15 min,以100%、100%、95%、90%、80%和70%浓度的下行梯度乙醇水溶液脱二甲苯,每浓度5 min。去离子水中浸泡5 min后,以苏木素染色5 min,流水稍冲,以盐酸乙醇分化10 s,自来水浸泡15 min,以70%、80%、90%、95%、100%和100%浓度的上行梯度乙醇水溶液脱水,每浓度5 min,以二甲苯脱酒精2次,每次10 min,中性树脂封片。40倍光镜观察胰岛结构。Masson染色步骤:切片以HE染色相同方法脱蜡、下行梯度乙醇脱二甲苯至去离子水后,于去离子水中浸泡5 min,滴试剂A(复合染色液)一滴摇匀,使试剂均匀覆盖切片组织,染色5 min,以去离子水冲掉试剂后,于去离子水中浸泡15 min;滴试剂C(磷钼酸)一滴摇匀,使试剂均匀覆盖切片组织,甩去试剂C,以去离子水稍冲;滴试剂D(苯胺蓝)一滴摇匀,使试剂均匀覆盖组织切片,染色6 min,甩去试剂D,去离子水稍冲;滴试剂B(分化液)一滴,分化30 s。染色后的切片以去离子水浸泡3次,每次3 min后,以HE染色相同方法上行梯度乙醇脱水至二甲苯,以中性树脂封片。以40倍光镜观察胰岛纤维化(蓝绿染色)。
1.5.5 胰腺GLP-1受体蛋白表达检测 以western blot法检测:100 mg胰腺组织于1 mL含蛋白酶抑制剂的裂解液中冰上研磨匀浆。取匀浆液10 000 r/min离心15 min。取上清液配平,煮沸变性后,上样,以120 V电泳60 min;以80 V电转70 min,将蛋白湿转至0.45 μm孔径的PVDF膜上,5%牛奶-TBST溶液室温孵育1 h,加入1∶2 000稀释的一抗,室温孵育1 h后于4 ℃环境下孵育过夜。此后经洗膜,二抗孵育后,于暗室曝光。
1.5.6 数据处理 以Image-Pro Plus6.0 软件计算条带IOD(Integrated option density,总灰度值)作为表达量。以β-actin为内参,计算胰腺GLP-1受体相对表达。本检测重复3次,以平均值进行统计分析。
2 结果
2.1 低频电针对2型糖尿病大鼠血糖的调控作用
表1所示,治疗前,模型组、电针组大鼠空腹血糖均显著高于空白组(P<0.01);模型组、电针组大鼠FBG差异无统计学意义。4周干预结束后,模型组、电针组大鼠FBG仍显著高于空白组(P<0.01);其中电针组大鼠FBG较模型组显著降低(P<0.05)。上述结果提示以2 Hz、2 mA的低频连续波电针刺激“胃脘下俞”可显著降低2型糖尿病大鼠血糖。
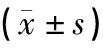
表1 电针干预前后空腹血糖
2.2 低频电针对2型糖尿病大鼠胰岛形态的调控作用
低频电针干预后2型糖尿病大鼠胰岛,HE染色如图1示:空白组大鼠胰岛呈规则的椭圆形,胰岛形态饱满,胰岛B细胞及细胞核形态、颜色正常,胰岛与外周的外分泌腺泡细胞之间边界清晰;模型组大鼠胰岛面积明显缩小,胰岛外周的外分泌腺泡细胞变大,部分侵入胰岛,胰岛形态不规则,其中,胰岛B细胞核数量减少,颜色变深;电针组大鼠胰岛面积介于空白组和模型组之间,胰岛外周的外分泌腺泡细胞变大,细胞间隙变小,胰岛形态稍不规则,胰岛中仍可见部分代偿增大的B细胞核,胰岛B细胞核数量较模型组稍增多。
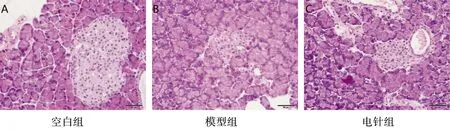
图1 低频电针干预后2型糖尿病大鼠胰岛形态学观察(HE染色,40×,标尺示50 μm)
低频电针干预后2型糖尿病大鼠胰岛Masson染色,如图2示:空白组大鼠胰岛形态呈椭圆形,胰岛外周均匀包绕一层蓝色的薄层纤维,胰岛内部偶尔可见少量分布的纤维;模型组大鼠胰岛面积缩小,形态不规则,胰岛B细胞及细胞核颜色变深,胰岛内可见大量深蓝色的纤维侵入,贯穿整个胰岛;电针组大鼠胰岛面积缩小,形态不规则较模型组稍改善,胰岛B细胞及细胞核颜色变深,较模型组略好转,胰岛中仍可见蓝色的纤维侵入,纤维颜色较模型组稍变浅。
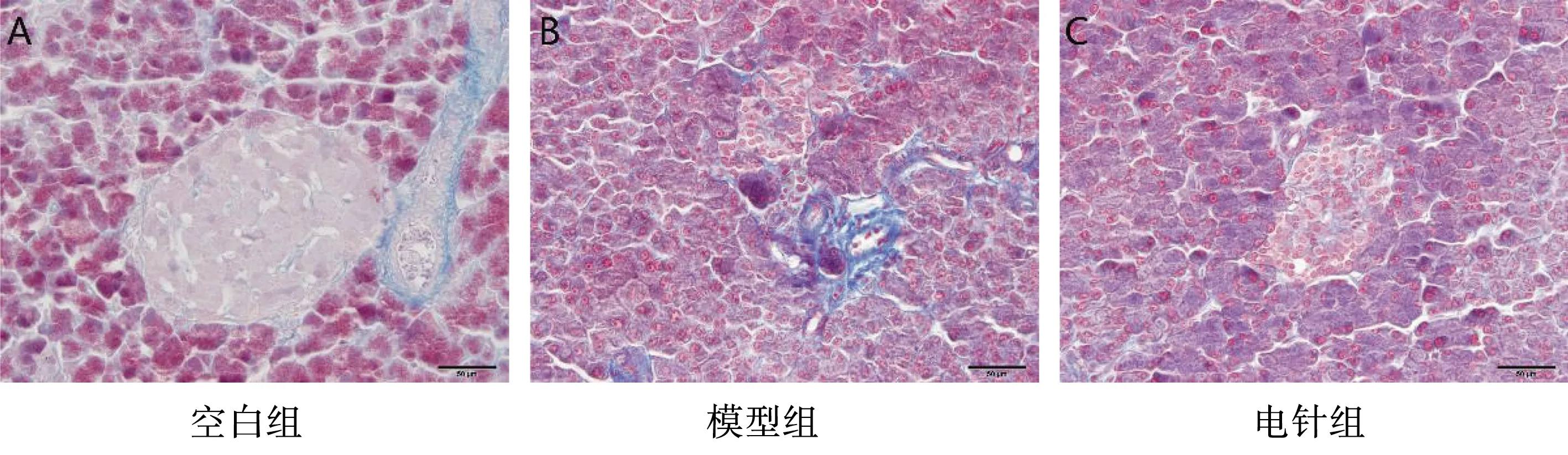
图2 低频电针干预后2型糖尿病大鼠胰岛形态学观察(Masson染色,40×,标尺示50 μm)
上述结果示,低频连续波电针“胃脘下俞”可保护2型糖尿病大鼠胰腺形态,在一定程度上改善胰岛纤维化和外分泌腺泡细胞对胰岛的侵蚀。
2.3 低频电针对2型糖尿病大鼠胰岛素分泌功能的调控作用
表2所示,4周干预后,空白组、模型组和电针组空腹胰岛素含量差异无统计学意义。模型组、电针组胰岛素分泌指数显著低于空白组(P<0.01);其中电针组胰岛素分泌指数显著优于模型组(P<0.05)。上述结果示低频连续波电针“胃脘下俞”对保护胰岛素分泌功能有显著作用。
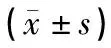
表2 各组大鼠胰岛素分泌比较
2.4 低频电针对2型糖尿病大鼠胰腺GLP-1受体蛋白表达的调控作用
图3、表3所示,空白组胰腺GLP-1受体蛋白表达显著高于模型组(P<0.01)。经过4周电针干预后,电针组胰腺GLP-1受体含量显著高于模型组(P<0.05),但仍显著低于空白组(P<0.05)。

图3 各组大鼠胰腺GLP-1R蛋白表达
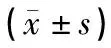
表3 各组大鼠胰腺GLP-1R蛋白相对表达量
3 讨论
3.1 穴位选取依据
2型糖尿病属西医病名,该病隶属中医学“消渴”范畴。胃脘下俞穴是首个明确见于中医古籍记载的可用于消渴病治疗的穴位。《备急千金要方》言:“消渴咽喉干,灸胃管下俞三穴各百壮”。实验研究表明,该穴可显著降低2型糖尿病大鼠空腹血糖[5-6]、血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇[7]等指标。其机理既涉及改善胰腺形态和功能[9-10];也涉及调控胰岛素抵抗[8]。即胃脘下俞穴可同时对2型糖尿病的两大致病机理,胰岛形态、分泌功能受损和肝、脂肪、骨骼肌等外周靶细胞的胰岛素抵抗起干预作用。
胃脘下俞穴的上述作用可部分通过现代神经解剖学得到解释:该穴位于第8胸椎棘突下旁开1.5寸。其所在平面位于支配胰腺传入神经节(T5~11神经节)的中心。胃脘下俞穴下的第8胸神经后支可将电针的痛刺激、电刺激信号经脊神经前根、脊神经和白交通支传入交感干,终止于交感干神经节。由交感干神经节将电针刺激信号和由其他节段上行或下行来的神经信号整合,发出到达胰腺的神经丛,调节交感神经的抑制胰腺分泌的功能[12]。另外一部分电针的痛刺激、电刺激信号经脊髓上行至大脑中枢,经中枢整合后由迷走神经背核发下行纤维经胸、腹腔脏器旁节或器官内节交换神经元,将电针信号输送至胰腺,调节副交感神经的促进胰腺分泌的功能[12]。按照上述理论,电针“胃脘下俞”对胰腺的形态和分泌功能理应具有一定的调节作用。
3.2 指标选取依据
GLP-1由主要分布在小肠末端及大肠的L细胞合成。L细胞在受到包括碳水化合物、蛋白质和脂肪在内的多种营养物质的刺激下分泌GLP-1。GLP-1的受体广泛分布于下丘脑食欲中枢、胃肠道消化器官、分泌胰岛素的胰岛B细胞和接受胰岛素的肝、脂肪、骨骼肌细胞的细胞膜上。GLP-1能对2型糖尿病产生多方面的正向调控作用:其可作用于下丘脑食欲中枢,使机体产生饱腹感,减轻饥饿感;作用于胃,能够抑制胃酸分泌,减少胃蠕动,延缓胃排空,达到减少主动进食的作用;可作用于胰岛A细胞,使胰高血糖素分泌减少,并作用于胰岛B细胞,促进胰岛B细胞增殖,减少胰岛B细胞凋亡,保护胰岛B细胞的形态和功能;还可促进胰岛素基因转录,上调胰岛素分泌[13]。且在机体血糖含量过低时,GLP-1不会发挥进一步的降糖作用。上述作用与针灸疗法多系统、多靶点和双向良性调节的作用方式类似。
本研究因此认为,针灸对2型糖尿病的干预作用一部分是通过调节GLP-1信号通路实现,并提出假说,低频电针“胃脘下俞”穴可上调胰腺GLP-1受体含量;借助上调GLP-1信号通路,达到保护胰腺形态和分泌功能的作用,进而改善2型糖尿病大鼠胰腺结构和分泌功能,实现降血糖的作用。为了验证假说,进行如下研究:①取大鼠胰腺检测GLP-1受体蛋白表达,观察电针对糖尿病模型动物胰腺中GLP-1通路的激活情况;②以HE染色观察电针对胰岛及胰岛B细胞形态的修复情况;③以Masson染色观察电针对胰岛纤维化的改善情况;④以胰岛素分泌指数评估电针对胰岛素分泌能力的调控。结果初步证实:电针可以促进糖尿病模型动物下调的胰腺GLP-1通路活跃度,在一定程度上改善胰岛和胰岛B细胞的形态受损,逆转胰岛纤维化,并通过对胰岛形态学的修复,恢复模型动物分泌胰岛素的能力,改善2型糖尿病症状。
