罗汉参淀粉理化性质及降血糖活性研究
2021-06-11张绵松贾爱荣史亚萍刘雪赵福江刘昌衡
张绵松,贾爱荣,史亚萍,刘雪,赵福江,刘昌衡 *
(1.齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东 济南 250103;2.山东省海珍品精深加工技术重点实验室,山东 济南 250103;3.中澳特色生物资源产业技术创新联合实验室,山东 济南 250103)
罗汉参(俗称香芋),主要种植于鲁西南平原地区,为多年蔓生草本植物,其块根呈圆球形或不规则长圆形,长3 cm~5 cm,表皮呈土黄色,上有断续的环状纹理,肉质洁白细嫩。鲁西南地区居民通常将罗汉参作为药膳食用,也有少量报道认为罗汉参有预防某些慢性疾病的作用,但相关的现代科学研究报告较少。刘彬[1]研究结果表明,生、熟罗汉参中抗性淀粉的含量均高于土豆、芋头、地瓜和山药等4种常见的薯类,另外韩文婷[2]研究表明罗汉参具有降低糖尿病小鼠血糖和改善糖耐量的作用,因此罗汉参可能成为天然抗性淀粉的良好食物来源。
抗性淀粉(resistant starch,RS)可以用来提高食物的纤维含量[3],根据美国谷物化学家协会和美国国家科学院医学研究所食品营养委员会的定义,RS可以被归类为一种膳食纤维,RS似乎对人类结肠健康有相当大的好处,但对脂质和葡萄糖代谢的影响较小。此外,在Eerlingen等[4]的研究中,X-射线衍射被用来对RS的结构进行分析,发现RS是由支链淀粉首先形成双螺旋结构,再由该结构堆积进一步形成B型结晶,此外还包含少量的支链淀粉、脂质以及蛋白质,所以RS的化学结构并不同于纤维,仍是淀粉类物质。作为一种新型的食品添加剂,RS具有降低血糖和胰岛素的反应,适合肥胖病人和糖尿病人食用,对调节人体健康起到重要的作用。本研究为拓宽罗汉参淀粉的应用范围,对其基本的理化性质进行研究,并采用高血糖模型小鼠对罗汉参淀粉的降糖活性进行初步的研究,为罗汉参淀粉在普通食品或辅助降血糖功能食品中的应用奠定理论基础。
1 材料与方法
1.1 主要材料与试剂
罗汉参淀粉:山东省科学院生物研究所食品生物技术实验室自制[5];SPF级KM小鼠,雄性,体重18 g~20 g(质量合格证号:37009200019058)、基础饲料、垫料:济南朋悦实验动物繁育有限公司;拜糖平:拜耳医药保健有限公司;蔗糖:山东东都食品有限公司;胆酸钠、胆固醇:河南万邦实业有限公司;猪油:临沂新程金锣肉制品集团有限公司;肝糖原测定试剂盒:北京索莱宝科技有限公司;血糖测定试纸:上海罗氏制药有限公司;链脲佐菌素:西格玛奥德里奇(上海)贸易有限公司;胃蛋白酶(1∶10 000 U/g):上海源叶生物科技有限公司;α-淀粉酶(26 000 RAU/g):丹尼斯克(中国)有限公司;葡萄糖淀粉酶(10万U/mL):上海阿拉丁生化科技股份有限公司;3,5-二硝基水杨酸:上海源叶生物科技有限公司;以上试剂均为分析纯。
1.2 主要仪器与设备
EX124ZHIAD电子天平:美国奥豪斯仪器有限公司;SUPRATM55热场发射扫描电子显微镜:德国蔡司公司;HHS21-4-S水浴锅:上海新苗医疗器械制造有限公司;ACCU-CHEK Active血糖测定仪:上海罗氏制药有限公司;INFINITE 200 PRO酶标仪:瑞士Tecan公司;TU-1810S紫外可见分光光度计:北京普析通用仪器有限责任公司;DW-86W100超低温冰箱:青岛海尔股份有限公司;TDL-5-A台式大容量离心机:上海安亭科学仪器厂;RVA-TecMaster快速黏度分析仪:瑞典波通仪器公司。
1.3 测定方法
1.3.1 淀粉含量的测定
按照GB 5009.9—2016《食品安全国家标准食品中淀粉的测定》的测定方法进行[6]。具体方法为酸水解法,试样经除去脂肪及可溶性糖类后,其中淀粉用酸水解成具有还原性的单糖,然后按还原糖测定,并折算成淀粉。
1.3.2 抗性淀粉含量测定
改良Goni法[7-8],具体试验步骤如下。
1)准确称取2.000 g样品,置于250 mL三角瓶中。添加HCl-KCl缓冲溶液(pH值2.0~4.0)20 mL,加入胃蛋白酶20 mg,60℃水浴振荡1 h,以除去样品中的蛋白质。
2)取出,冷却至25℃,用0.1 mol/L HCl和0.1 mol/L NaOH调整pH值至5.4,加入耐高温α-淀粉酶20 μL,90℃水浴振荡16 h,酶解糊化状态的淀粉为小分子的糊精。
3)加入4倍体积的无水乙醇沉淀,4 000 r/min离心20 min;弃去上清液,沉淀用80%乙醇洗涤3遍,彻底洗去葡萄糖。
4)用4 mol/L KOH溶解沉淀,调整pH值至4.1~4.3,加入葡萄糖淀粉酶 20 μL,40 ℃水解 45 min;沸水浴加热 5 min;4 000 r/min离心20 min,收集上清液,10 mL蒸馏水洗涤沉淀2次;上清液合并,定容至100 mL。
5)使用 3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定上清液中还原糖含量,在DNS反应中,3,5-二硝基水杨酸与还原糖经过共热后被还原成棕红色,在一定范围内,溶液的颜色与还原糖的含量成正比。测定样品在540 nm下的吸光值,经过相应的换算,得到还原糖的含量。
6)抗性淀粉含量的计算:还原糖数据乘以0.9即为抗性淀粉质量。
抗性淀粉含量/%=抗性淀粉的质量/总淀粉的质量×100
1.3.3 持水性的测定
称取1.00 g样品分散于15 mL蒸馏水中,分别置于45、55、65、75、85℃水浴加热 30 min,冷却至 25 ℃后,3 000 r/min离心15 min,弃去上清液,称沉淀质量[9]。
持水性/%=沉淀质量/样品质量×100
1.3.4 透明度的测定
取1 g淀粉样品加水配成1%的淀粉乳液,100℃保温15min,冷却至25℃后以蒸馏水为空白测定620nm下的透光率[9]。
1.3.5 膨润度的测定
取0.50 g的干燥淀粉与25 mL蒸馏水在预先称重的50 mL离心管中混匀,置于95℃水浴锅内振荡30 min。然后在3 000 r/min离心15 min,弃去上清液,称量离心后沉淀物质量[9]。按照以下公式计算样品的膨润度。
膨润度/%=离心后沉淀物质量/样品质量×100
1.3.6 冻融稳定性的测定
取一定量的淀粉样品,配成6%的淀粉乳,100℃加热20 min,冷却至25℃,然后-20℃冷冻24 h,取出自然解冻,在5 000 r/min离心15 min,去除上清液,称重[9],按照以下公式计算样品的析水率。
析水率/%=离心后上清液质量/离心前淀粉乳的质量×100
1.3.7 黏度特性的测定
取淀粉样品3.0000g,置于测定铝筒内,加25.00mL蒸馏水,用搅拌器桨叶在试样中上下剧烈搅动10次,然后将样品置于快速黏度分析仪(rapid viscosity analyzer,RVA)中,搅拌器转动速度为 160 r/min。RVA初始温度为50℃保持1 min,然后以12℃/min升高至95℃,在95℃保持2.5 min,再以12℃/min降到50℃保持2.5 min,每测定一个样品需用时13 min[10-11]。
1.3.8 淀粉的颗粒形态表征
将经过干燥和良好碾磨后纯化的抗性淀粉均匀分布在粘有导电双面胶的样品台面上,真空条件下喷上一层铂金薄膜,然后固定在载物台上,置于扫描电子显微镜下观察,并拍摄不同淀粉样品颗粒的照片[12]。
1.4 实验方法
1.4.1 高血糖小鼠模型的建立
1.4.1.1 高脂高糖饲料配方(100 kg)及制作方法
小鼠基础饲料66.5 kg、蔗糖20 kg、胆酸钠1 kg、猪油10 kg、胆固醇2.5 kg[13]。具体制作方法为:基础饲料粉碎过筛,混入干料,然后拌入猪油,加适量水压入块状模具,成型后倒出,50℃干燥后直接饲养试验小鼠。
1.4.1.2 链脲佐菌素注射造模
在适应性饲喂1~2周之后,选择所要造模的KM小鼠,禁食不禁水16h后,尾静脉注射链脲佐菌素(1%,医用生理盐水注射液配制,现配现用,避光)45 mg/kg BW空白对照组注射等剂量医用生理盐水注射液。
1.4.1.3 造模成功的判断
继续喂养1周~2周后,禁食3h采集鼠尾血用血糖测定仪测定小鼠的空腹血糖值,根据保健食品辅助降血糖功能评价方法中的规定,空腹血糖值10 mmol/L~25 mmol/L为高血糖模型成功动物,将造模成功小鼠和未成功小鼠分开标记饲养,以备下一步实验分组。
1.4.2 实验分组
将实验用高血糖模型小鼠和正常KM小鼠进行随机分配,一共分为4组:空白对照组(正常小鼠25只,喂养普通饲料);模型对照组(高血糖模型小鼠25只,喂养普通饲料);抗性淀粉组(高血糖模型小鼠25只,喂养含罗汉参淀粉饲料);阳性对照组(高血糖模型小鼠25只,除了喂养普通饲料之外,每天灌胃一次拜糖平溶液,剂量为24.9 mg/kg BW)。
1.4.3 含罗汉参淀粉的饲料配方及制作方法
罗汉参淀粉10%,基础饲料88%,另外为了防止淀粉的增加,减少饲料中蛋白质的含量,补充2%酪蛋白到饲料中以平衡饲料中蛋白质供给量。制作方法同1.4.1.1。
1.4.4 动物实验方法
在标记分组之后,动物实验正式开始,30 d后尾部取血,采用试纸法测定各组小鼠的空腹血糖值,然后脱颈处死,立即进行解剖,取出肝脏,称重后匀浆-80℃冻存,按照肝糖原试剂盒上的方法进行操作测定肝糖原含量。
1.5 统计分析
计量资料以均数±标准差表示,均使用SPSS软件统计分析。若计量资料的方差齐,采用单因素方差分析最小显著性差异法检验进行组间比较;若计量资料的方差不齐,采用单因素方差分析检验,p<0.05认为有统计学意义。
2 结果与分析
2.1 抗性淀粉含量、透明度、膨润度、冻融稳定性
罗汉参淀粉和玉米淀粉的抗性淀粉含量、透明度、膨润度和冻融稳定性测定结果见表1。

表1 罗汉参淀粉与玉米淀粉的部分理化指标比较Table 1 Comparison of some physicochemical properties between Luohanshen starch and corn starch
从表1可以看出,罗汉参淀粉在透明度和膨润度明显优于同浓度的玉米淀粉;而两者在衡量冻融稳定性的析水率方面没有显著性差异。
2.2 黏度特性
RVA仪测定结果见图1和图2。

图1 罗汉参淀粉的RVA谱图Fig.1 RVA spectrum of Luohanshen starch

图2 玉米淀粉的RVA谱图Fig.2 RVA spectrum of corn starch
数据表明,罗汉参淀粉的糊化温度79.15℃、峰值黏度4 097 cP、保温黏度2 266 cP、最终黏度3 315 cP、衰减值18 31 cP、回生值1 049 cP。玉米淀粉的糊化温度78.25℃、峰值黏度3 062 cP、保温黏度2 254 cP、最终黏度3 544 cP、衰减值808 cP、回生值1 290 cP。罗汉参淀粉的糊化温度、保温黏度均大于玉米淀粉,说明罗汉参淀粉比玉米淀粉难糊化,且黏度稳定性较好。糊化温度与淀粉的直链淀粉含量、分支的长短以及结晶的致密程度等因素都显著相关,一般直链淀粉含量低、淀粉颗粒较大、结构比较疏松的淀粉较容易糊化[14]。淀粉糊在达到低谷黏度后,随着温度的继续下降,淀粉糊发生老化、回生现象。淀粉分子之间经氢键连接,重新缔合行程聚集体,导致淀粉糊黏度再次升高,达到最终黏度。罗汉参淀粉的最终黏度和回生值均比玉米淀粉的低,说明罗汉参淀粉在降温阶段的稳定性比玉米淀粉好,不易老化。
2.3 持水性
罗汉参淀粉与玉米淀粉持水性比较见图3。

图3 罗汉参淀粉与玉米淀粉持水性比较Fig.3 Comparison of water holding capacity between Luohanshen starch and corn starch
淀粉分子在水中形成亲水性胶体,随着温度的升高,淀粉分子逐渐糊化断裂,生成更多氢键[10]。罗汉参淀粉在45℃~75℃的温度区间里,持水性趋势大致相同,但是在接近它们的糊化温度时,也就是在75℃~85℃的温度区间里,罗汉参淀粉的持水性超过玉米淀粉,这是因为淀粉糊化过程大量吸水的缘故。最终在85℃的条件下,玉米淀粉的持水性在900%左右,而罗汉参淀粉的持水性超过1 400%。
2.4 微观结构
罗汉参淀粉颗粒形态见图4。
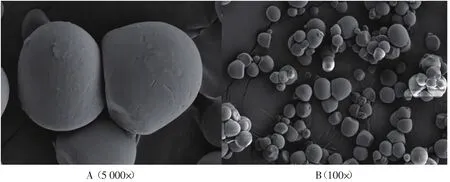
图4 罗汉参淀粉颗粒形态Fig.4 Morphology of Luohanshen starch granule
淀粉植物来源不同,颗粒大小和形貌也会相异,淀粉颗粒结构有单粒、复粒,淀粉颗粒与淀粉来源在形貌上具有相似性[15]。电镜图片显示罗汉参淀粉的颗粒形状为椭圆形,与罗汉参的外形相似,淀粉颗粒大小约为3 μm~8 μm。1 000倍的电镜图显示罗汉参淀粉颗粒呈不规律的团聚状态。
2.5 罗汉参淀粉体内降血糖活性
喂养4周后实验各组小鼠的血糖值变化如图5。
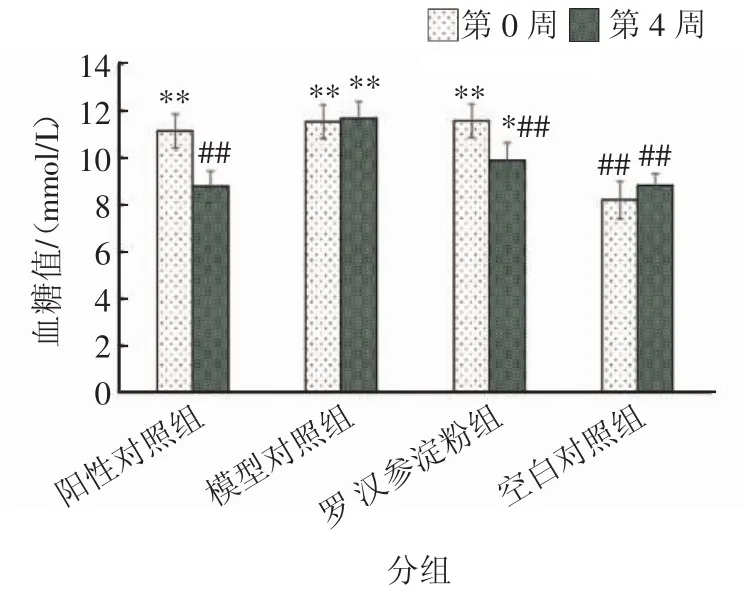
图5 各组小鼠的血糖值的变化Fig.5 The column diagram of blood glucose value changes in each group
从图5可以看出,在第0周,阳性对照组、模型对照组、罗汉参淀粉组的小鼠血糖均值在11 mmol/L左右,空白对照组试验小鼠的平均血糖值为8 mmol/L,阳性对照组、模型对照组、罗汉参淀粉组的小鼠血糖值与空白对照小鼠的血糖值差异极显著(p<0.01)。4周之后,测定的血糖值显示,阳性对照组和罗汉参淀粉组的小鼠血糖值较第0周的血糖值出现明显下降,而模型对照组和空白对照组的小鼠血糖值均略有上升。另外,第4周阳性对照组和罗汉参淀粉组的血糖值与模型对照组的血糖值差异极显著(p<0.01),且均低于模型对照组小鼠血糖值,说明罗汉参淀粉有助于控制小鼠血糖值。
在喂养4周之后,实验各组小鼠的肝糖原的组间比较如图6。

图6 4周后各组小鼠肝糖原含量比较Fig.6 The column diagram of liver glycogen content in each group after four weeks
II型糖尿病患者的一个特点是肝葡萄糖输出量持续增加,以及胰岛素抵制作用,所以肝糖原含量与糖尿病有着密切的联系,肝脏组织中的肝糖原含量的变化可有效反映出机体对于胰岛素含量的敏感程度[16]。从图6中可以看到,模型对照组的模型小鼠的肝糖原含量与空白对照组的正常小鼠的肝糖原含量具有显著差异(p<0.05)。模型小鼠的胰岛素的分泌受到了药物的干扰,肝糖原含量的波动正是胰岛素含量变化的表征。然而饲养含罗汉参淀粉的饲料,使得罗汉参淀粉组的小鼠的肝糖原含量在4周后与空白对照组的小鼠肝糖原含量基本一致(p>0.05)。
3 结论
经与玉米淀粉进行对比研究,罗汉参淀粉在抗性淀粉含量、透明度、膨润度、糊化温度、降温阶段稳定性、持水性等指标均高于玉米淀粉,具有较好的加工特性;以高血糖模型小鼠为评价模型,血糖值和肝糖原含量为指标,讨论罗汉参抗性淀粉对高血糖模型小鼠的降血糖作用。实验结果表明:在喂养罗汉参淀粉4周后,高血糖模型小鼠的血糖值得到明显降低,且肝糖原含量与正常小鼠的肝糖原保持一致。由此可以推断,在日常饮食中加入罗汉参淀粉,可以有效改善高血糖病人的血糖值和肝糖原含量等指标,所以罗汉参淀粉是高血糖人群良好的碳水化合物来源。
