室内饲养松墨天牛幼虫不同肠段细菌的群落结构及功能分析
2021-06-04陈宏健郝德君夏小洪赵欣怡谈家金
陈宏健,郝德君*,田 敏,周 杨,夏小洪,赵欣怡,乔 恒,谈家金
(1.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2.上海市松江区林业站,上海 201600)
昆虫是目前已知动物中种类最多、分布最广、生物量最大的类群[1],在长期进化过程中,与多种微生物包括病毒、细菌、真菌、原生动物、线虫等相互选择、相互适应,形成了密切的共生关系[2-3]。昆虫肠道微生物影响共生微生物与宿主关系的各个方面,例如病原、偏利共生、共栖和互惠共生等[4-5]。昆虫的肠道作为食物消化、营养吸收和代谢的重要场所,栖居着大量的微生物,由于前、中、后肠不同肠段的内部结构、微生态环境或功能存在差异,因而会影响肠道微生物的生长、群落结构,进而不同程度地影响宿主昆虫的生长发育、生理代谢、生殖和免疫等生命活动[6-9]。因此,研究昆虫肠道微生物在昆虫与共生微生物相互适应、协同进化,以及共生微生物与宿主免疫和代谢机制等方面具有理论价值,对阐明农林重要害虫的致病机理,发掘和利用肠道微生物潜在的功能具有重要意义。
天牛和小蠹等蛀干害虫大部分时间生活于树体内,从寄主植物中获取生长发育所需的营养物质。然而,树木中的葡萄糖以纤维素、半纤维素、葡聚糖和果胶等复杂的多糖聚合物存在,氮素含量相对不足,植物细胞壁蛋白质与木质素和纤维素形成结合蛋白难以利用[10]。蛀干昆虫往往通过利用肠道共生细菌产生纤维素或半纤维素酶[11],或者提高宿主昆虫体内相关消化酶活性进而分解木质纤维素获得所需的葡萄糖[12]。同时,萜类化合物是松属植物重要的组成性和诱导性化学防御物质[13],蛀干害虫可以利用肠道细菌降解针叶树萜类物质[14-15],以提高昆虫对寄主适应性。
松墨天牛(Monochamusalternatus)在我国是危害针叶树的重要蛀干害虫,也是松材线虫病扩散的主要媒介[16-18]。松墨天牛幼虫主要钻蛀取食生长衰弱木的韧皮部和木质部,成虫取食1~2年生枝条[19]。虽然已有关于食料、幼虫不同发育阶段和虫态影响松墨天牛肠道细菌群落结构的研究[20-21],但是关于松墨天牛不同肠段细菌群落结构及其在不同理化条件下的功能研究鲜见报道。笔者在松墨天牛幼虫不同肠段细菌群落及野外种群相关研究[22]的基础上,以室内饲养的松墨天牛4龄幼虫为对象,对前、中和后肠各肠段的细菌群落结构及其潜在功能进行分析,为深入揭示肠道细菌在松墨天牛获取营养、克服寄主植物化学防御的机理提供参考依据。
1 材料与方法
1.1 供试虫源
松墨天牛成虫采自江苏省镇江市丹徒区感染松材线虫病的马尾松林,带回南京林业大学昆虫生物学实验室后,喂食健康的1~2年生马尾松枝条供其补充营养。待雌雄成虫交配后,以马尾松木段供其产卵,定期收集卵粒并转移至半人工饲料(配方:马尾松木屑100 g、琼脂40 g、蔗糖20 g、酵母粉12.5 g、安息香酸钠2 g、山梨酸钾1 g、0.5 mol/L的硫酸10 mL、麦胚粉25 g、胆固醇1.5 g、抗坏血酸4 g、酪蛋白20 g、氯化胆碱1 g、无菌水800 mL),参考陈瑞旭等[23]方法进行人工饲养。选取人工饲养获得的4龄幼虫作为供试昆虫。
1.2 松墨天牛幼虫肠道分离
取健康的松墨天牛4龄幼虫15头,先用体积分数75%乙醇表面消毒1 min,再用无菌水冲洗2次,消除残留乙醇。在无菌条件下,用解剖剪刀和尖镊剪开幼虫体表,取出完整肠道,分离前肠、中肠、后肠。3个肠段分别置于装有0.5 mL PBS缓冲液的1.5 mL灭菌离心管中,每管5头幼虫为1个重复,每个肠段3管(3个重复)。
1.3 DNA提取和PCR扩增
使用CTAB法提取肠道细菌总DNA[24-25],利用Nanodrop 2000C (Thermo Scientific, Waltham, MA, USA)评估DNA浓度,用质量分数1%琼脂糖凝胶电泳检测DNA纯度。以提取的细菌总DNA为模板,采用16S rDNA的V3-V4区引物进行PCR扩增,引物为341F (5′-CCTAYGGGRBGCASCAG-3)和806R (5′-GGACTACNNGGGTATCTAAT-3)。PCR反应体系(30 μL):2×Phusion Master Mix 15 μL,2 μmol/L上下游引物各1.5 μL,DNA模板10 ng,ddH2O 2 μL。PCR扩增程序:98 ℃ 预变性1 min,98 ℃ 变性10 s,50 ℃ 退火30 s,72 ℃ 复性30 s,30个循环,最后72 ℃延伸5 min,PCR仪采用Bio-rad T100 (Bio-Rad, Hercules, CA, USA)。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。
1.4 文库构建和高通量测序
采用NEB Next© UltraTM DNA Library Prep Kit for Illumina (NEB, Ipswich, MA, USA)试剂盒完成文库的构建,具体步骤:①连接“Y”字形接头;②使用磁珠筛选去除接头自连片段;③利用PCR扩增进行文库模板的富集;④氢氧化钠变性,产生单链DNA片段。经过 Qubit 定量和文库检测合格后,利用 Illumina HiSeq 2500平台进行双端测序。
1.5 序列数据分析
使用Trimmomatic软件质控,FLASH软件拼接[26]:①设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端所有序列,之后再去除质控后长度低于50 bp的序列;②根据PE reads之间的overlap关系,将两端序列进行拼接,拼接时overlap之间的最大错配率为0.2,长度需大于10 bp。去除无法拼接的序列。③根据序列首尾两端的barcode和引物将序列区分样本,调整序列方向,barcode需精确匹配,引物允许2个碱基的错配,去除存在模糊碱基的序列。
使用USEARCH 7.1软件(http://drive5.com/uparse/)对序列进行操作分类单元(operational taxonomic units, OTUs)聚类[27]:①对优化序列提取非重复序列,便于降低分析中间过程冗余计算量;②去除没有重复的单序列;③按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列;④将所有优化序列映射至OTU代表序列,选出与代表序列相似性在97%以上的序列,生成OTU表格。利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释[28],比对Silva数据库(SSU123),设置比对阈值70%,最后利用R 3.5.1软件分别在门和属分类水平上统计各样本的群落组成及物种丰度情况,同时绘制Venn图统计样本的OTU组成相似性及重叠情况。
采用Alpha多样性分析反映微生物群落的丰富度和多样性,用Mothur 1.30.1(http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)指数分析[29]计算各样本的菌群丰富度(Ace和Chao指数)以及菌群多样性(Shannon和Simpson指数),并根据Shannon指数绘制稀释性曲线。采用Beta多样性分析研究不同样本菌群结构的相似性或差异关系,用Qiime计算Beta多样性距离矩阵,根据距离矩阵进行层级聚类分析,使用UPGMA算法和R 3.5.1 软件构建样本层级聚类树。
1.6 肠道菌群功能分析
采用PICRUSt软件预测松墨天牛幼虫肠道菌群功能[30]。首先,对OTU丰度表进行标准化,去除16S marker gene在物种基因组中拷贝数目的影响;通过每个OTU 对应的greengene ID,对OTU进行KEGG功能注释,获得OTU在KEGG各功能水平的注释信息及各功能在不同样本中的丰度。
1.7 统计分析
Alpha多样性指数和KEGG功能通路丰度采用SPSS 22.0软件进行单因素方差分析,使用Tukey HSD或Tamhane’s T2进行多重比较。
2 结果与分析
2.1 松墨天牛幼虫各肠段细菌16S rDNA序列拼接和组装分析
从松墨天牛幼虫3个肠段的9个样本中共获得797 952条细菌16S rDNA原始序列读数,经过质量过滤和去除嵌合体后,得到643 404条高质量序列,每条序列平均长度为416.2 bp。按照最小样本序列数进行抽平,在97%相似度下将其聚类为用于物种分类的1 614个OTUs,总共注释到35门、63纲、137目、250科、554属和844种。
2.2 松墨天牛幼虫各肠段细菌群落结构分析
各肠段细菌群落结构分析见图1。
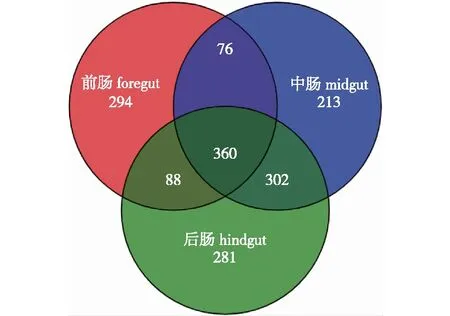
LF.前肠foregut;LM.中肠midgut;LH.后肠hindgut。下同。The same below.图1 松墨天牛幼虫前、中、后肠细菌OTUs的韦恩图Fig.1 A venn diagram of OTUs of bacteria in the foregut, midgut, hindgut of larvae of M. alternatus
由图1可知,松墨天牛幼虫肠道的OTU数量从前肠到后肠依次递增,前肠最少,仅有818个OTUs;中肠有951个OTUs;后肠最多,有1 031个OTUs。3个肠段共有的OTUs为360个,其中前肠和中肠共有的OTUs为76个,前肠和后肠共有的OTUs为88个,中肠和后肠共有的OTUs为302个,表明各肠段的细菌群落组成之间存在相似性,并且在组成上具有连续性。前、中、后肠各自特有的OTUs分别为294、213和281个,表明各肠段在细菌群落的组成上存在差异。
各肠段细菌优势门和属的相对丰度见图2。
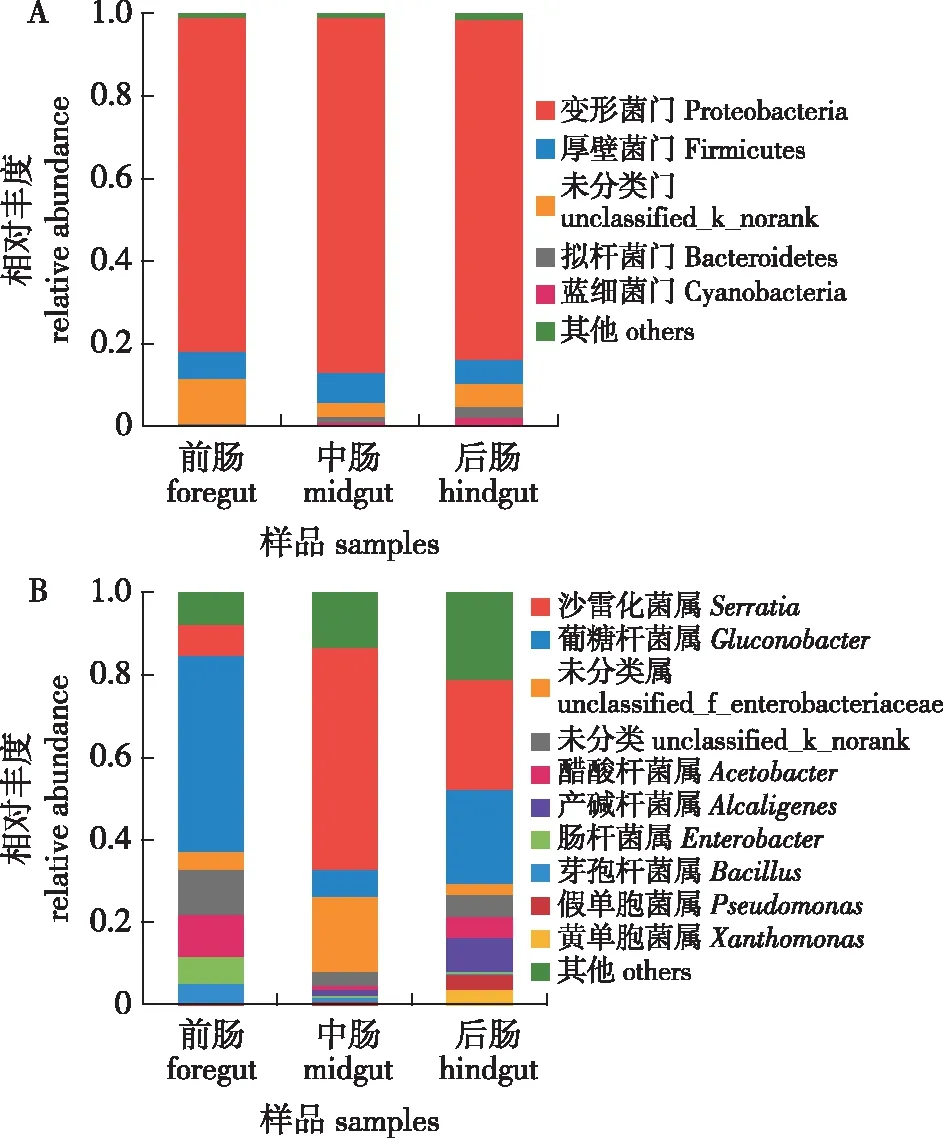
图2 松墨天牛幼虫前、中、后肠细菌优势门(A)和 属(B)的相对丰度Fig.2 Relative abundances of dominant phyla (A) and genera (B) of bacteria in the foregut, midgut, hindgut of larvae of M. alternatus
在门水平上(图2A),3个肠段中细菌丰度排序为变形菌门、厚壁菌门、未分类门、拟杆菌门和蓝细菌门,丰度占松墨天牛幼虫肠道细菌的98%。这些优势门在前、中、后肠中所占比例不同,变形菌门在3个肠段分别为81.01%、86.27%、82.63%,为绝对优势类群;其次为厚壁菌门,占比分别为6.60%、7.38%、5.81%,未分类门分别为11.02%、3.07%、5.41%,拟杆菌门占比分别为0.36%、1.56%、2.60%,蓝细菌门占比分别为0.06%、0.81%、2.04%,在所有肠段中占比较少,其他细菌分别为0.94%、0.90%、1.51%。
在属水平上(图2B),丰度排序前10名的各优势属在前、中、后肠中所占比例分别为沙雷氏菌属(7.73%、53.77%、26.72%),葡糖杆菌属(47.44%、6.55%、22.83%),未分类属(4.30%、18.40%、2.61%),未分类(11.02%、3.07%、5.41%),醋酸杆菌属(9.98%、1.03%、5.07%),产碱杆菌属(0.001%、1.57%、8.30%),肠杆菌属(6.66%、0.50%、0.45%),芽孢杆菌属(4.47%、0.75%、0.43%),假单胞菌属(0.61%、0.80%、3.39%)和黄单胞菌属(0.002%、0.003%、3.59%)。各肠段中主要优势属的种类虽然相同,但其丰度所占比例有较大差异。
2.3 松墨天牛幼虫各肠段细菌多样性分析
松墨天牛幼虫各肠段3个重复样本的细菌多样性分析见图3。由图3可知,基于Shannon指数的稀释性曲线趋于平缓,增加数据量产生的新 OTU很少,说明测序数据量合理,测序深度足够。
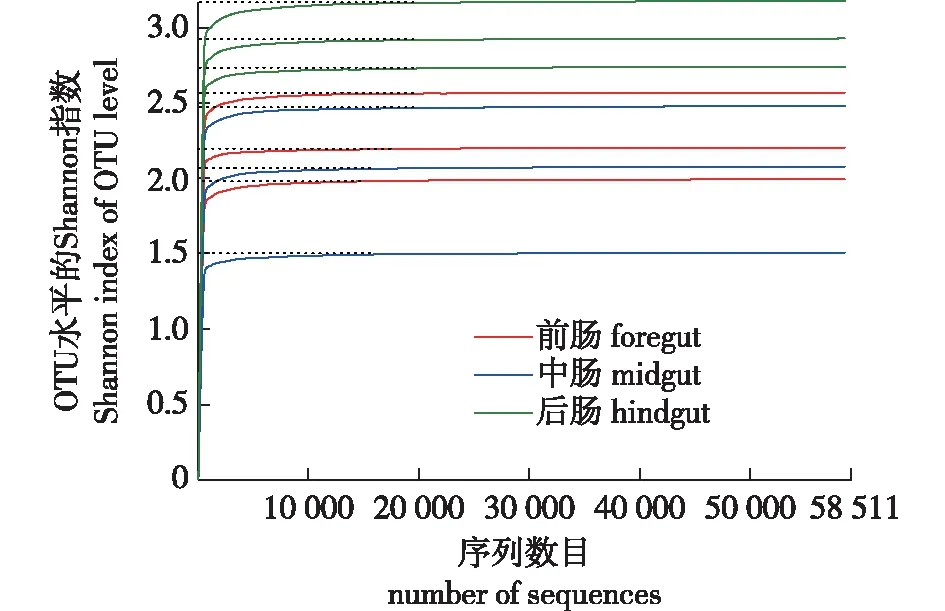
图3 松墨天牛幼虫前、中、后肠细菌Shannon指数稀释曲线Fig.3 The rarefaction curve of Shannon indexes of bacteria in the foregut, midgut, hindgut of larvae of M. alternatus
通过比较松墨天牛幼虫前、中、后肠中细菌Alpha多样性的Ace指数、Chao指数、Shannon指数和Simpson指数(表1),发现各肠段在菌群丰度上存在差异,在菌群多样性上无差异。前肠的Ace与Chao指数均低于中肠和后肠,说明中、后肠的菌群丰富度高于前肠,而中、后肠之间无显著差异。各肠段之间的Simpson指数没有差异,前肠与中肠、后肠之间Shannon指数均没有显著差异,仅后肠的Shannon指数显著高于中肠,表明3个肠段的菌群多样性相似。
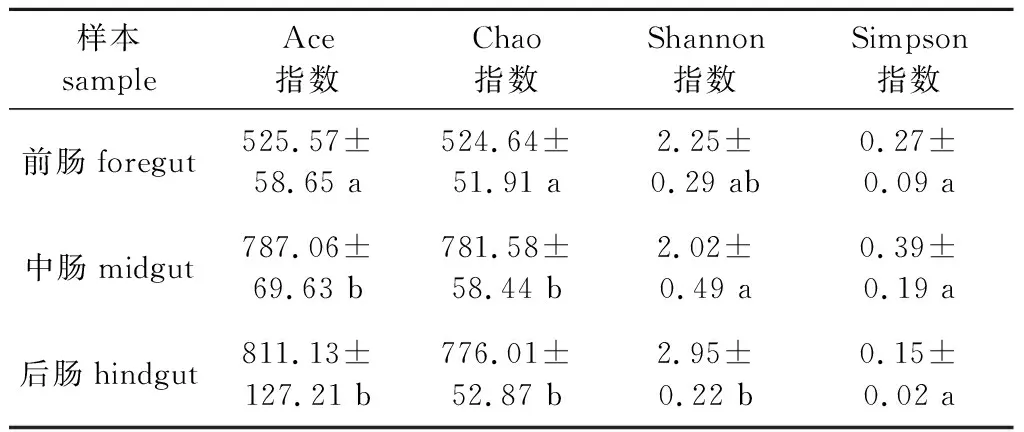
表1 松墨天牛幼虫前、中、后肠细菌Alpha多样性指数
通过构建Beta多样性的样本层级聚类树,探索不同分组样本间菌群组成的相似性或差异性。采用Bray-Curtis的加权距离算法,同时考虑物种有无和物种丰度对聚类产生的影响。研究结果如图4所示,可知前、中、后肠分别聚成3簇,相互之间无交叉,说明3个肠段的细菌群落组成存在差异。此外,前肠成为独立于中肠和后肠之外的一簇,表明前肠的菌群组成与中后肠差异较大,而中肠与后肠的菌群组成较相近。比较3个肠段的优势OTU发现,OTU223为前肠的核心种,占绝大多数;在中肠段,OTU1539占极优势地位;后肠段OTU223和OTU1539同为优势种,且两者丰度相近。
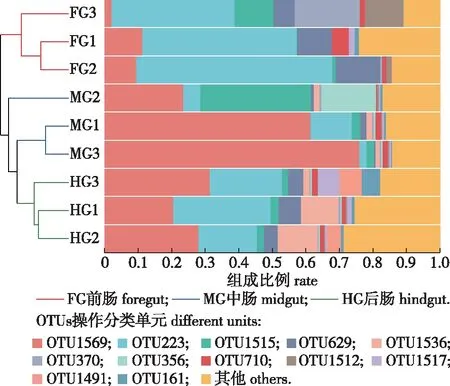
图4 松墨天牛幼虫前、中、后肠细菌层级聚类树Fig.4 The hierarchical clustering tree of bacteria in the foregut, midgut, hindgut of larvae of M. alternatus
2.4 松墨天牛幼虫各肠段菌群功能分析
为探究松墨天牛幼虫肠道细菌的潜在功能,通过PICRUSt预测各肠段菌群在KEGG第一、二级通路水平上的丰度,结果见表2。由表2可知,松墨天牛幼虫各个肠段的细菌群落均注释到6种KEGG一级功能通路,分别为代谢(46.58%)、遗传信息处理(16.69%)、环境信息处理(15.52%)、细胞过程(3.92%)、人类疾病(1.14%)和组织系统(0.59%)。其中代谢功能通路的丰度几乎占所有一级通路丰度的一半,说明松墨天牛幼虫肠道菌群主要行使代谢各种物质的功能。除此以外,代谢功能在松墨天牛幼虫的3个肠段中表现出显著性差异,后肠中的丰度显著高于前肠和中肠,中肠菌群的丰度也显著高于前肠。说明松墨天牛幼虫肠道菌群的代谢以中肠和后肠为主要场所,并且后肠菌群发挥更重要的作用。
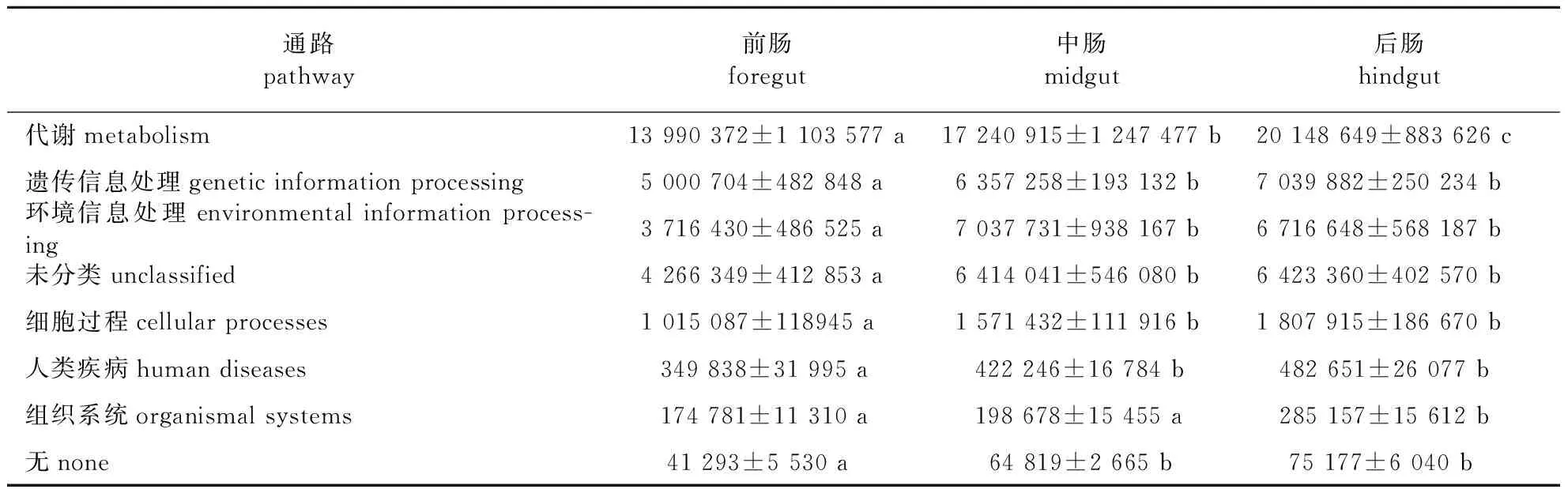
表2 松墨天牛幼虫前、中、后肠细菌KEGG一级通路丰度
对松墨天牛幼虫肠道菌群代谢通路里的二级通路进行映射注释,共发现12种二级代谢功能通路(表3)。这些二级通路对应的功能及其在松墨天牛幼虫整个肠道中的占比分别为糖类代谢(20.77%)、氨基酸代谢(19.98%)、能量代谢(10.88%)、辅助因子和维生素代谢(9.11%)、核苷酸代谢(7.38%)、脂质代谢(7.09%)、外源化学物质生物降解与代谢(6.01%)、聚糖生物合成与代谢(5.06%)、酶家族(4.33%)、其他氨基酸代谢(3.98%)、萜类和聚酮类化合物代谢(3.82%)及其他次生代谢产物生物合成(1.59%)。由此可知,松墨天牛幼虫肠道菌群主要参与糖类和氨基酸的代谢,同时也有部分菌群具有降解外源化学物质、萜类和聚酮类化合物的功能。这些功能集中在松墨天牛幼虫的中肠和后肠,且以后肠为主。

表3 松墨天牛幼虫前、中、后肠细菌KEGG二级通路(代谢通路)丰度
3 讨 论
本研究通过Illumina HiSeq测序技术对室内饲养的松墨天牛幼虫的前、中、后肠中细菌群落结构及丰度进行了比较分析。结果表明,变形菌门(Proteobacteria)为3个肠段中最优势门,葡糖杆菌属(Gluconobacter)和沙雷氏菌属(Serratia)为3个肠段中优势属。Hu等[20]对我国松墨天牛野外种群不同龄期幼虫的肠道菌组成进行了研究,发现变形菌门在大多数样本中占主导地位,与此次结果一致[22]。野外松墨天牛幼虫肠道细菌的优势属主要是肠杆菌属和欧文氏菌属(Erwinia)[20,22],而本研究显示室内饲养的松墨天牛幼虫肠道则以沙雷氏菌属和葡糖杆菌属为主,这种差别可能是由于食物的来源和组分不同所致。韩国学者鉴定了野外幼虫种群中、后肠和室内种群幼虫后肠的细菌群落[21],与本研究结果不同的是厚壁菌门在其所有样本中占优势,可能是地理环境的差异影响了松墨天牛幼虫肠道优势菌群的组成。本研究发现,前肠细菌的优势属为葡糖杆菌属,中肠细菌的优势属为沙雷氏菌属,这两个属同时为后肠中细菌的优势属。Lemke等[31]测定了Pachnodaephippiata(鞘翅目:金龟子科)幼虫肠道的pH,发现中肠碱性极高,后肠相对较低。Chapman等[32]也报道一些鳞翅目昆虫的中肠呈碱性(pH 8~12),其他肠段接近中性。葡糖杆菌属细菌生长适宜的pH为5.5~6.0,沙雷氏菌属细菌适宜的pH则为5~9[33],可能是由于松墨天牛幼虫不同肠段的酸碱性导致了细菌优势属的差异,有待于后续研究确认。此外,葡糖杆菌属细菌多在富糖环境和发酵过程中被发现[33-34],本研究提供的半人工饲料中含有较多的蔗糖和酵母粉,为葡糖杆菌属细菌的富集提供了适宜环境。沙雷氏菌属曾作为优势属在松墨天牛的近缘种樟子松墨天牛(Monochamusgalloprovincialis)的胸部和腹部被发现[35],同时也在其携带的松材线虫上被分离鉴定[36]。
比较松墨天牛室内幼虫前、中、后肠细菌的OTUs组成和多样性结果,可以看出各个肠段的群落结构存在显著差异,中、后肠的菌群丰度明显高于前肠,后肠含有数量最多的细菌。这种现象是由于昆虫每个肠段的理化条件存在差异以及消化的主要场所在中、后肠等原因所引起[7]。已有研究也表明一些昆虫的后肠是栖居最大微生物数量的肠段[37]。另一方面,松墨天牛幼虫前、中、后肠中也存在一些共享菌群。因为昆虫的整个肠道连通,它们在取食的时候,肠道细菌会随着食物从一个肠段进入另一个肠段[32],相比之下两个相邻肠段的共有细菌会更多,也证明了细菌群落在肠道内的连续性。
昆虫在适应广泛生态位的过程中,能够在营养匮乏或难以降解食物的条件下正常生长发育,肠道微生物的营养共生作用就显得异常重要[7]。植物在与植食性昆虫协同进化过程中,常常会利用次生代谢物质来防御昆虫的取食,许多昆虫则通过肠道共生菌降解这些防御物质[38]。本研究在参考有关松墨天牛幼虫生物防控的基础上[39],利用PICRUSt预测室内饲养的松墨天牛幼虫前、中、后肠细菌的功能也主要体现在代谢功能上。中、后肠的细菌相比前肠发挥更重要的代谢作用,这与昆虫的中肠和后肠进行食物的消化和吸收的作用相关,而前肠通常用于食物的临时储存和初步消化[7,37]。糖类和氨基酸为室内饲养的松墨天牛幼虫肠道细菌最主要的代谢物质,推测是因为半人工饲料的木屑中有较多的纤维素,同时提供了大量的蔗糖、酵母粉和酪蛋白。本研究还发现一些肠道细菌具有降解次生代谢物质、萜类和聚酮类化合物的功能,松树木屑中的木质素和萜类物质可能激发了这些肠道菌的代谢功能,参与了松墨天牛幼虫对这些次生物质的解毒过程。沙雷氏菌属和假单胞菌属细菌已被证实作为优势菌参与了纤维素、单萜或双萜的降解[14-15,40-42]。本研究在室内饲养的松墨天牛幼虫中肠和后肠中发现了产碱杆菌属细菌,并在后肠中丰度更高。产碱杆菌属在以往的松墨天牛及其近缘的墨天牛的肠道菌研究中均未有报道,但该属细菌可以利用有机酸盐和酰胺产碱[33],同时具有降解木质纤维素的作用[43]。产碱杆菌属可能辅助松墨天牛中肠和后肠营造碱性环境,从而使多种消化酶更有效地发挥作用。
本研究在分析室内饲养的松墨天牛幼虫前、中、后肠细菌群落结构的基础上,进一步利用 KEGG 数据库预测了各个肠段细菌潜在的功能,有助于阐明松墨天牛幼虫各肠段的菌群在组成结构上的变化、优势菌群的种类以及肠道菌群与幼虫营养共生中发挥的作用。后续研究将进行松墨天牛肠道功能菌的筛选与验证,深入探究松墨天牛肠道细菌的功能。
