红皮云杉体胚发生体系优化和超低温保存技术研究
2021-06-04陈士刚秦彩云才巨锋王聪慧董环宇
高 芳,陈士刚,秦彩云,才巨锋,王聪慧,董环宇,陶 晶*
(1.吉林省林业科学研究院林业生物技术研究所,吉林 长春 130033; 2.林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040; 3.吉林省林木种苗管理站,吉林 长春 130022)
植物体细胞胚胎发生途径具有繁殖速度快和再生率高等优点[1-2],不仅是优良种质材料大规模繁殖的有效方法,也是遗传转化研究中的最佳受体系统[3],具有巨大的应用价值[4-6]。Morel等[7]曾提出体胚发生是针叶树无性繁殖的首选方法。此外,利用胚性组织进行超低温保存可以避免胚性愈伤组织在增殖过程中胚性逐渐丧失及变异等问题,并可以降低继代成本,减小工作量[8]。通过体胚发生与超低温技术相结合可以实现优良种质资源保存和规模化扩繁。云杉属(Picea)树种全世界约有40种,具有适应性强、抗逆性强、生长迅速等特性,是园林绿化的重要树种。体细胞胚胎发生技术在云杉属树种中的应用,为其品种改良和规模化、产业化繁殖提供了可能。
红皮云杉(Piceakoraiensis)是一种常绿乔木,分布于东北小兴安岭、吉林、朝鲜及乌苏里地区[9-11]。红皮云杉是我国东北林区主要的造林用材树种,可作为建筑、航空、造纸和制造乐器的用材,造林前景广阔。目前红皮云杉主要采用播种和扦插繁殖,而通过体胚发生途径的繁殖方法可以迅速获得大量均一化、优质的苗木。红皮云杉体胚发生技术起步较晚,报道较少,远远落后于其他云杉属树种,如丽江云杉(P.likiangensis)[12]、北美云杉(P.pungens)[13]等。有学者以红皮云杉未成熟胚为外植体,获得胚性愈伤组织[9,14-15],并初步建立体胚发生技术体系[9-11,14],但是体胚发育与成熟能力整体偏低,畸形胚比例偏高。迄今为止,红皮云杉超低温保存技术鲜见报道,限制了红皮云杉优良种质资源的保存和规模化繁殖的进程。
植物体细胞胚胎发生调控是一个复杂的过程。大量研究表明,基本培养基、植物生长调节剂种类及浓度、凝固剂浓度等对体胚发生起到至关重要的作用[16]。本研究以红皮云杉合子胚为外植体,以改良RJW和1/2 LV为基本培养基,设置6种萘乙酸(NAA)和6-苄氨基腺嘌呤(6-BA)激素浓度组合进行胚性愈伤组织诱导试验,将获得的胚性愈伤组织进行超低温保存和体胚发育与成熟试验;体胚成熟采用不同的脱落酸(ABA)和Gelrite浓度,确定适宜的体胚成熟培养条件。最后以改良RJW、1/2 RJW、LM、1/2 LM为基本培养基,确定体胚萌发的适宜培养条件,建立红皮云杉体胚发生和超低温保存技术体系,为红皮云杉优良种质资源长期保存和规模化繁育奠定基础。
1 材料与方法
1.1 材料采集与灭菌
于2018年8月,前往吉林省敦化市大蒲柴河林场(半同胞家系)采集红皮云杉球果(合子胚为子叶胚期)。球果采回后,用体积分数75%的乙醇擦拭表面,剥出种子,用75%乙醇灭菌1 min,用无菌水冲洗3~5次;用质量分数为10%次氯酸钙溶液表面灭菌10 min,无菌水冲洗3~5次;剥出合子胚接种于胚性愈伤组织诱导培养基上。
1.2 胚性愈伤组织诱导方法
以改良RJW和1/2 LV为基本培养基进行胚性愈伤组织诱导,培养条件如下:附加萘乙酸(NAA)3.0 mg/L、6-BA 1.0 mg/L、酸水解酪蛋白500 mg/L、L-谷氨酰胺1 000 mg/L、蔗糖20 g/L、3.5 g/L Gelrite、肌醇5 g/L,接种后置于23℃条件下暗培养。每处理8皿,每皿10个外植体,8周后统计胚性愈伤组织诱导率。
以改良RJW为基本培养基,添加不同浓度的植物生长调节剂,即NAA分别是2、3、5 mg/L,6-BA 为0.5、1.0 mg/L,培养基内均添加酸水解酪蛋白500 mg/L,L-谷氨酰胺1000 mg/L,蔗糖20 g/L,3.5 g/L Gelrite,肌醇5 g/L,每处理4皿,每皿10个外植体,接种后置于23 ℃条件下暗培养。8周后统计胚性愈伤组织诱导率。
1.3 胚性愈伤组织增殖培养方法
以改良RJW为基本培养基进行红皮云杉胚性愈伤组织增殖培养,培养基内添加NAA 2 mg/L、6-BA 0.5 mg/L、酸水解酪蛋白500 mg/L、L-谷氨酰胺1 000 mg/L(L-谷氨酰胺过滤灭菌加入)蔗糖20 g/L、3.5 g/L Gelrite、肌醇5 g/L,接种后置于23 ℃条件下暗培养。每2周继代1次,3个月后进行体胚成熟和超低温保存试验。
在胚性愈伤组织增殖过程中进行细胞观察。将长势良好的胚性愈伤组织置于三角瓶内,用质量分数0.1%番红染液染色10 min,然后将染色好的胚性愈伤组织转移到载玻片上,盖上盖玻片,用铅笔轻轻敲打载玻片使胚性愈伤组织均匀散开,立即置于显微镜下观察。
1.4 胚性愈伤组织超低温保存方法
超低温保存:选择3个长势良好的胚性细胞系HY-1、HY-2、HY-3,在胚性细胞系增殖培养7~10 d时取3 g置于含12 mL 0.4 mol/L山梨醇的培养基中,23 ℃黑暗条件下震荡20 h。加入体积分数为99%的二甲基亚砜(DMSO)溶液1.125 mL+0.8 mol/L山梨醇培养基1.125 mL+0.4 mol/L山梨醇培养基0.75 mL,冰上静置1.5 h后转入1 mL离心管,置程序降温盒内迅速放入-80 ℃冰箱内,2 h后迅速置于液氮中保存。
恢复培养:每个细胞系随机选择3个冷冻管迅速从液氮中取出,37 ℃水浴解冻2~3 min后转入愈伤组织增殖培养基上,将水浴解冻好的冷冻管中愈伤组织用移液枪取出,吸干表面水分后置于增殖培养基上恢复培养。为降低冷冻保护剂对愈伤组织的伤害,1 d后转移至新的增殖培养基上,10 d后可以观察到不同细胞系均有明显的新生愈伤组织,15 d后大量增殖,表明超低温保存后细胞可以恢复活力。
1.5 红皮云杉体胚发育与成熟情况测定
1.5.1 ABA的影响
选择3个细胞系(HY-1、HY-2、HY-3)进行体胚发育与成熟试验,称取100 mg长势良好的胚性愈伤组织转入50 mL的离心管中,加入去除植物生长调节剂的液体胚性愈伤组织增殖培养基3 mL,剧烈摇晃离心管使其充分散开,用移液枪将混合物转移到滤纸上,再用布氏漏斗抽滤,将带有胚性愈伤组织的滤纸放在固体培养基上,体胚成熟培养基为改良RJW+Gelrite 6 g/L+酸水解酪蛋白 750 mg/L+蔗糖 30 g/L+L-谷氨酰胺 450 mg/L。ABA浓度分别为10、20、30 mg/L,每个处理4皿,23 ℃ 暗培养45 d,记录成熟胚的数量。
1.5.2 Gelrite浓度的影响
选择3个细胞系(HY-1、HY-2、HY-3),研究不同Gelrite浓度对体胚发育与成熟的影响,Gelrite分别为8、10、12 g/L,其他试验条件与方法同1.5.1。每个细胞系5皿,23 ℃ 暗培养45 d,记录成熟胚的数量。
1.6 红皮云杉体胚萌发与植株再生
体胚萌发前需要进行干化处理,干化处理用6孔细胞板(Corning-Costar 3516),其中3个孔放置两层干燥无菌滤纸,然后把体细胞胚置于滤纸上,剩余3个孔装入无菌水,最后用保鲜膜将细胞板密封,置于4 ℃条件下暗培养7~10 d,然后置于体胚萌发培养基上。体胚萌发培养基选用改良1/2 RJW、改良RJW、1/2 LM、LM 4种基本培养基,培养基内添加活性炭1.0 g/L +蔗糖20 g/L+Gelrite 3.5 g/L,暗培养7 d 后转移至光条件下培养35 μmol/(m2·s)培养16 h,暗培养8 h 培养室温度为23 ℃。2个月后转移到相同的新鲜培养基上,2个月后进行移栽(移栽基质中营养土、 蛭石、沙子体积比为3∶1∶1)。
1.7 培养条件与数据统计分析
除NH4NO3外所用试剂均购自Sigma公司,L-谷氨酰胺和ABA过滤灭菌加入冷却至55 ℃左右的培养基中。所有培养基在灭菌前pH调至 5.8,高温高压蒸汽灭菌(121 ℃,20 min)。
采用Excel 2003统计数据并计算平均值。采用SPSS 22统计分析软件进行单因素方差分析,计算数据间的差异显著性(P<0.05);用CX31RTSF和SZ2-LGB型光学显微镜进行观察并照相。
2 结果与分析
2.1 红皮云杉胚性愈伤组织诱导结果
2.1.1 基本培养基对红皮云杉胚性愈伤组织诱导的影响
将红皮云杉合子胚接种于胚性愈伤组织诱导培养基上(图1a),2周后陆续有透明丝状胚性愈伤组织从外植体上长出(图1b、1c);胚性愈伤诱导45 d后统计胚性愈伤组织诱导率,胚性愈伤诱导8周后检查增殖培养结果(图2)。统计结果可知,基本培养基对红皮云杉胚性愈伤组织诱导率影响较大(外植体总数80),1/2 LV培养基胚性愈伤组织诱导率较低[(22.50±5.90)%],改良RJW培养基上诱导率为(30.00±5.34)%。两种基本培养基相比较,改良RJW培养基更适合红皮云杉胚性愈伤组织诱导。

a. 接种于胚性愈伤组织诱导培养基上的合子胚zygotic embryos on embryogenic mass induction medium; b、c. 从外植体上长出的胚性愈伤组织embryogenic mass growed from explants。图1 红皮云杉胚性愈伤组织诱导Fig.1 Embryogenic mass induction of P. koraiensis

a.长势良好的胚性愈伤组织embryogenic mass with good growth;b.胚性愈伤组织内部的早期体胚early stage somatic embryo in embryogenic mass;c.超低温保存恢复培养的胚性愈伤组织embryogenic mass of cryopreservation and recovery culture. 黑色箭头指向恢复培养成活的胚性愈伤组织。 The black arrow points to the recovery of viable embryogenic mass.图2 红皮云杉胚性愈伤组织增殖和超低温保存Fig.2 proliferation and cryopreservation of embryogenic mass of P. koraiensis
2.1.2 植物生长调节剂浓度对胚性愈伤组织诱导的影响
植物生长调节剂浓度对胚性愈伤组织诱导的影响显著(表1)(P< 0.05),当NAA质量浓度为5.0 mg/L、6-BA质量浓度为1.0 mg/L时胚性愈伤组织诱导率最低为5.00%。当NAA质量浓度为3.0 mg/L、6-BA质量浓度为0.5 mg/L时胚性愈伤组织诱导率最高为50.00%,为红皮云杉胚性愈伤组织诱导的最适植物生长调节剂浓度。

表1 植物生长调节剂浓度对红皮云杉胚性愈伤组织诱导的影响
2.1.3 红皮云杉胚性愈伤组织增殖和超低温保存
胚性愈伤组织诱导8周后进行胚性愈伤组织增殖试验,胚性愈伤组织增殖过程中部分细胞系在继代过程中逐渐褐化死亡,部分细胞系增殖良好(图2a)并且内部含有较多的早期体胚(图2b)。胚性愈伤组织增殖培养3个月后进行超低温保存试验,经恢复培养10 d 左右可以清晰地看见成活的胚性愈伤组织(图2c),3个细胞系胚性愈伤组织均成活。
2.2 红皮云杉体胚发育与成熟
红皮云杉体胚发育与成熟培养10 d后晚期体细胞胚开始长出(图3a),20 d后进一步发育为球状胚(图3b),35 d左右发育为成熟胚(图3c),成熟胚中部分为发育正常的体胚(图3c黑色箭头指向),部分体胚发育畸形(图3c红色箭头指向)。

a.晚期阶段的体胚late stage somatic embryo; b.球状胚globular embryo;c.成熟胚mature embryo。红色箭头指向畸形体胚。The red arrow points to the abnormal somatic embryo.图3 红皮云杉体胚发育与成熟Fig.3 Somatic embryo development and maturation of P. koraiensis
2.2.1 ABA对体胚发育与成熟的影响
ABA浓度对红皮云杉体胚发育与成熟影响差异显著(P< 0.01),畸形胚比例差异也显著(P< 0.05)(表2)。不同细胞系体胚发育与成熟能力差异较大(表3),随着ABA浓度的升高,体胚数量呈先升高后降低趋势。当ABA质量浓度为30 mg/L时,3个细胞系体胚发育与成熟能力均最低;当ABA质量浓度为20 mg/L时,3个细胞系体胚发育与成熟能力最佳。但是,当添加Gelrite 6 g/L、ABA 20 mg/L时,3个细胞系畸形胚比例均偏高,特别是HY-1畸形胚比例高达77.14%。

表2 ABA浓度对红皮云杉不同细胞系体胚发育与成熟的影响方差分析
2.2.2 Gelrite质量浓度对体胚发育与成熟的影响
随着Gelrite浓度升高,3个细胞系的体胚数量均呈逐渐降低趋势(表3)。

表3 ABA和Gelrite浓度对红皮云杉体胚发育与成熟的影响
当Gelrite为12 g/L时,3个细胞系体胚发育与成熟能力均最低,其中HY-1细胞系为12.00个/g,HY-3细胞系为0个/g。当Gelrite为8 g/L时,3个细胞系的体胚发育与成熟能力均最佳, HY-2细胞系为396.00个/g,畸形胚比例为10.33%。Gelrite浓度对体胚发育与成熟影响差异显著(P< 0.01)(表4)。
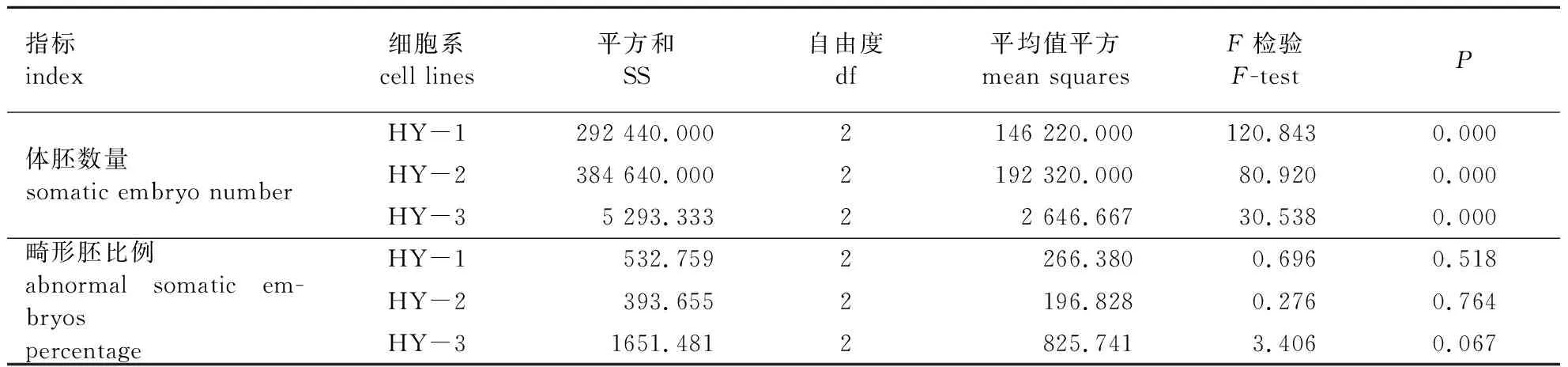
表4 Gelrite浓度对红皮云杉不同细胞系体胚发育与成熟的影响方差分析
2.3 体胚萌发与植株再生
红皮云杉体胚成熟45 d后进行体胚萌发,不同基本培养基对红皮云杉体胚萌发的影响差异显著(P< 0.05)(表5)。在1/2 LM上体胚萌发能力最弱,其次是LM基本培养基,供试的4个基本培养基改良RJW体胚萌发能力最佳(图4a)。不同细胞系体胚萌发能力也不同,整体来看,HY-3细胞系体胚萌发能力较低,然后是HY-1,最后是HY-2。体胚萌发4个月后进行移栽培养(图4b、4c)。

表5 基本培养基对红皮云杉体胚萌发的影响

a.体胚萌发germination of somatic embryos;b.再生植株regenerated plants;c.再生植株移栽transplanting of regenerated plants。图4 红皮云杉体胚萌发与植株再生Fig.4 Germination and regeneration of somatic embryos of Picea koraiensis
3 讨 论
3.1 基本培养基

3.2 植物生长调节剂
植物生长调节物质被认为是体胚发生过程最重要的影响因素,对整个体胚发生过程的每一个环节起调控作用[21],因此,深入了解外源性和内源性激素对植物体胚发生的影响至关重要。针叶类植物愈伤组织的诱导一般在含有较高浓度的生长素和较低浓度的细胞分裂素的培养基上进行,且生长素被认为是胚性愈伤组织诱导阶段最为关键的因子[22]。不同树种反应不同,需要针对性筛选具体合适的浓度和组合[5,18]。研究发现,内源IAA保持较高水平是胚性细胞出现的标志,因此IAA水平在胚性愈伤组织诱导过程中起关键作用,而外源添加2,4-D可以改变外植体内源IAA水平,从而促进体细胞胚向胚性细胞转化[23]。本研究发现当NAA浓度为3.0 mg/L、6-BA浓度为0.5 mg/L时,胚性愈伤组织诱导率最高为50.00%,为红皮云杉胚性愈伤组织诱导的适宜培养基。
3.3 超低温保存技术
胚性愈伤组织超低温保存是体细胞胚胎发生过程中基因型选择和育苗的重要步骤[24]。由于优良基因型的选择是建立在离体和离体鉴定的基础上的,因此从体胚发生技术体系的建立到苗木生产可能需要漫长的过程。但是胚性愈伤组织会在增殖培养一段时间后胚性减弱甚至丧失[25],特别是针叶树种[26]。超低温保存是组织在超低温(-196 ℃)下长期保存生存能力的技术,在加拿大、美国、法国、瑞典等国家,针叶树无性系的体细胞胚胎发生和超低温保存已被广泛应用[27-28]。本试验超低温保存细胞系均成活,成功建立了红皮云杉的超低温保存技术,为规模化繁育奠定了基础。
3.4 ABA
胚性细胞转变为体细胞胚是一个复杂的过程,受多种因素的影响,在离体培养条件下,应尽量保持与合子胚发育相似的环境,以提高成熟体细胞胚的数量和质量[16]。针叶树体胚发育与成熟阶段一般需要撤除生长素、细胞分裂素且添加ABA的培养条件下进行。这种生长调节物质的转换是体胚成熟的一项重要措施,ABA不仅可以促进体胚成熟、防止畸形胚产生、抑制体胚的过早萌发[29],还可以调节储藏物质的积累,增强脱水耐受性并调控体细胞胚的休眠[30]。有报道表明,花旗松(Pseudotsugamenziesii)的体胚成熟ABA浓度范围为20~70 μmol/L时效果较好[31]。当挪威云杉体胚成熟过程中使用ABA处理1~9 d时,与对照相比含有ABA的培养基上成熟体细胞胚的产量增加了10倍[32]。Zhang等[33]报道了外源添加ABA在拟南芥(Arabidopsisthaliana)体胚发育不同阶段的作用,进一步表明体胚发育对ABA的依赖性,同时ABA还改善了体细胞胚的形态学特征和数量。Zhang等[34]对落叶松的研究表明,在添加ABA的培养基上,体细胞胚的发育同步化较好且可以进一步发育为成熟的体胚,而在未添加ABA的培养基上,体细胞胚的发育不同步,且形态发育不充分。本研究结果显示ABA的浓度对红皮云杉体胚畸形率和体胚发生数量产生较大的影响,以添加20 mg/L ABA效果最佳。
3.5 Gelrite
培养基的渗透压影响着植物的脱分化、再分化及器官的形成,针叶树种也不例外[29],在针叶树合子胚发育过程中水分状况变化对早期体细胞胚的发育进程至关重要。在不影响培养基水势的情况下,常常通过增加培养基内胶凝剂的强度来减少细胞的可用水量[35-37]。研究发现在体胚成熟培养基中添加0.8%~1.0% Gelrite和6%蔗糖获得的体胚积累了更多的贮藏蛋白质,当体胚发育伴随着干化时必须在高浓度凝固剂的培养基上培养,这种情况类似于合子胚的发育过程。本研究发现添加ABA 20 mg/L和Gelrite 6 g/L时,3个细胞系畸形胚比例均偏高,尤其是HY-1畸形胚比例高达77.14%。这可能因为Gelrite浓度偏低,培养物可用水量偏高,养分供应过大,从而导致体胚无法正常生长。而适当提高Gelrite浓度对3个细胞系的体胚数量增加虽无明显影响,但是畸形胚的比例显著下降,尤其是HY-2细胞系体胚数量为396.00个/g,畸形胚比例仅为10.33%。在前人研究的基础上,本研究找到适宜的Gelrite浓度,提高体胚数量的同时,降低了畸形胚的发生率(最低为7.33%),提高体胚转化率(最高为60.00%)。另外,成功建立了红皮云杉胚性愈伤组织超低温保存技术,为红皮云杉优良种质资源的保存和规模化繁育奠定基础。
红皮云杉胚性愈伤组织诱导的适宜培养基为改良RJW+NAA 3 mg/L+6-BA 0.5 mg/L;体胚发育与成熟适宜的培养基为改良RJW+ABA 20 mg/L+Gelrite 8 g/L;体胚萌发的适宜培养基为改良RJW基本培养基。
