以培养研究型人才为导向的基础化学实验教学设计与实践
2021-06-03王静李会平王小燕罗世忠王书文
王静,李会平,王小燕,罗世忠,王书文
青岛科技大学化学与分子工程学院,山东 青岛 266042
新时代全国高等学校本科教育工作会议指出,人才培养是大学的本质职能,一流大学建设必须聚焦人才培养[1]。各高校把握人才培养工作的新形势和新任务[2,3],将培养具有科研和创新能力的研究型人才作为高等教育战略目标[4,5]。研究型人才是指在具有扎实的理论知识、系统的研究方法和能力、掌握先进科学技术的同时,具有严谨求实的科研能力和勇于探索的创新能力,今后主要从事各专业的科学研究和创新工作[6]。对培养研究型人才具有重要作用的研究性教学模式,不同于单向的知识传授方式,而是以学生为主体,教师通过多方位启发,引导学生主动探究,充分参与,提倡学生自主学习,将所学理论与实践充分结合[7–9]。
基础化学实验作为面向大一新生的一门必修实践课程,在锻炼学生综合运用理论和实验知识、培养分析和解决问题能力,以及养成良好科学素养和习惯等方面起着不可替代的作用[2]。在传统的化学实验教学过程中,教师为学生准备好所需浓度的试剂和仪器,准确的实验步骤,详细的注意事项,确切的实验结果。学生进入实验室后,只需要“照方抓药”,验证实验结果,不利于思考、动手、总结,实验教学效果远远达不到预期的目标,创新能力难以得到培养[10]。实验课堂作为研究性教学环节的重要载体,要求融合知识传授、技能锻炼、能力培养、思维更新、素质提升于一体[11]。那么,如何将研究性教学模式应用于基础化学实验的课堂,就要求对基础化学实验的授课内容、传授方式、教学环境等环节进行缜密的设计和充足的准备。
“硫代硫酸钠溶液标定实验”是基础化学实验课程开设的氧化还原法滴定分析实验“硫代硫酸钠溶液的配制、标定及间接碘法测定铜含量”的一部分。在间接碘法标定硫代硫酸钠溶液的实验中,指示剂的加入时机、酸度、反应时间等因素均对实验结果有较大影响。本实验源于学生在标定过程中对基准物的思考,提出对反应条件、指示剂、滴定终点等实验条件如何确定的问题。教师根据学生提出的疑问,引导学生首先查阅文献,结合氧化还原滴定的理论知识,在理论分析计算的基础上,设计实验方案。学生以分组形式,各小组合理分工、相互配合完成实验动手操作、数据记录和整理。学生通过多次实验操作和总结分析,解决所提出的疑问,考查验证实验方案设计的合理性。在研究性教学模式的实施过程中,实验教学与系统科学研究方法相互渗透,学生在自主探索和研究中感受实验的乐趣和魅力,培养严谨的科学思维和良好的科学素养,有利于研究型人才的培养[12]。
1 实验设计
1.1 实验目的
(1) 掌握间接碘法标定Na2S2O3溶液的基本原理和方法。
(2) 学习考查实验条件的方法,掌握标定终点的判断方法。
(3) 培养学生查阅文献,分析、解决问题,综合运用理论与实践相结合的能力。
1.2 仪器与试剂
(1) 仪器:分析天平(Mettler Toledo,型号EL104100),酸度计(Mettler Toledo,型号EL20K),磁力搅拌器,台秤,烧杯(100 mL、500 mL),量筒(10 mL、20 mL、50 mL),250 mL容量瓶,25 mL移液管,250 mL碘量瓶。
(2) 试剂:Na2S2O3·5H2O (A.R.,s),Na2CO3(A.R.,s),K2Cr2O7(A.R.,s),KIO3(A.R.,s),10%KI溶液,6 mol·L−1HCl,3 mol·L−1H2SO4,1 mol·L−1H2SO4,0.5 mol·L−1H2SO4,0.2 mol·L−1H2SO4,1%淀粉溶液。
1.3 实验方法
1.3.1 0.1 mol·L−1Na2S2O3溶液的配制
称取20 g Na2S2O3·5H2O于500 mL烧杯中,加入200–300 mL新煮沸已冷却的去离子水,再加入0.2 g Na2CO3,待完全溶解后,用新煮沸已冷却的去离子水稀释至800 mL,储于棕色试剂瓶中。
1.3.2 0.1 mol·L−1Na2S2O3溶液的标定
方法一:
准确称取已烘干的K2Cr2O7(Mr= 294.2) 0.11–0.16 g于250 mL碘量瓶中,加入10–20 mL水使之溶解,再加入20 mL 10%KI溶液和5.0 mL 6 mol·L−1HCl,混匀后盖好塞子,水封,暗处放置5–10 min。反应结束后加50 mL水稀释一倍,用0.1 mol·L−1Na2S2O3溶液滴定至呈浅黄绿色,加入1 mL 1%淀粉溶液,继续滴定至蓝色变为绿色,即为终点。平行测定 3次,计算 Na2S2O3溶液的浓度c(Na2S2O3)[13]。
方法二:
准确称取质量为m(KIO3) = 1.0008 g (误差±0.0001g)的KIO3(Mr= 214.0)于100 mL烧杯中,加适量去离子水完全溶解后,转移,定容至250 mL容量瓶中。
准确移取25.00 mL上述碘酸钾溶液于250 mL碘量瓶中,加入体积V(KI)的10% KI溶液和浓度为c(H2SO4)的硫酸 V(H2SO4),混匀后盖好塞子并水封,暗处放置一定时间 t。反应结束后加体积为V(H2O)的去离子水稀释,立即用待标定的0.1 mol·L−1Na2S2O3溶液滴定至淡黄色,加入1 mL 1%淀粉溶液,继续滴定至蓝色恰好褪去呈无色溶液即为终点。记录消耗的Na2S2O3溶液的体积V(Na2S2O3),并计算Na2S2O3溶液的浓度c(Na2S2O3)。
1.4 反应方程式及计算公式

2 实验教学过程
实验教学中将学生分成小组,每个小组根据考查实验条件的影响因素分工操作,完成实验操作后,整理实验数据,分析实验结果。
2.1 方法一标定Na2S2O3溶液
采用 K2Cr2O7作为基准物标定 Na2S2O3溶液的实验方案(方法一)在基础化学实验课堂中已开展多年。实验数据见表1。

表1 K2Cr2O7作为基准物标定Na2S2O3溶液实验数据
实验过程中发现:(1) 使用6 mol·L−1盐酸作为酸性介质时,标定终点为CrCl3亮绿色。但在实验过程中发现由于盐酸的挥发性较强,极易形成酸雾。(2) 改为使用3 mol·L−1硫酸后,标定终点时反应产物有、I-和蓝绿色Cr2(SO4)3溶液。标定终点由淀粉与碘生成的蓝墨色突变到蓝绿色,颜色变化不显著,不利于终点观察。(3) K2Cr2O7毒性强,有强致癌性,污染严重。学生总结实验时提出是否可以采用KIO3作为基准物标定Na2S2O3溶液以解决这三个问题。
2.2 方法二标定Na2S2O3溶液
考虑到采用KIO3作为基准物标定Na2S2O3溶液,基准物反应条件和滴定过程均发生变化。这就要求对整个实验过程的条件重新进行摸索。学生首先查阅文献,小组分析讨论,最终确定需要考查的实验条件有:酸度、加水量、反应时间、KI溶液的加入量,以及滴定终点的判断方法。
2.2.1 溶液酸度的影响

在考查pH对实验的影响时,10%KI溶液的加入量为10 mL,反应时间3 min,基准物反应结束后加入50 mL水。由公式3计算可知基准物反应理论需要H2SO42.806 × 10−3mol,pH为4.3 (公式4),即滴定反应时pH最大为4.3。
基准物KIO3与KI在酸性条件下反应生成I2,滴定过程中必须考虑降低I2的挥发。同时为了实时测试反应溶液的pH,学生借鉴实验“乙酸离解常数的测定——电位滴定法”中pH的测定方法[13],搭建标定实验装置(图1)。

图1 Na2S2O3溶液标定实验装置图
结合计算结果,选择不同浓度和不同体积的硫酸溶液考查pH的影响,实验数据见表2。
在滴定过程中,考虑到减小I2挥发,滴定开始时搅拌速度较慢,加入淀粉指示剂后可增大搅拌速度。从表2中可以看出不同浓度的H2SO4对pH影响较大。浓度为3 mol·L−1时酸度较强,浓度为1 mol·L−1时体积从1 mL到2 mL的pH由5.89急剧减小为1.67,酸度骤然增强。而浓度为0.5 mol·L−1时体积从3 mL到4 mL的pH由5.15急剧降低为2.15。可见对加入一定浓度的H2SO4溶液,体积应严格控制在一定范围。从实验数据计算得到的c(Na2S2O3)来看,pH为0.8–4.3时标定得到的c(Na2S2O3)与方法一结果相近。

表2 溶液pH对Na2S2O3溶液标定的影响
2.2.2 加水量的影响
基准物反应条件是中性或弱酸性条件,实际实验操作的条件偏酸性。而滴定反应需要在中性或弱酸性条件下进行,以防止酸性过强Na2S2O3分解和I-被氧化。所以,基准物反应结束后需要降低溶液的酸度。标定实验过程中考虑加入一定体积的水来达到降低溶液酸度的目的。
统计显示,近五年来,遵医附院累计获国家自然科学基金112项,批准立项数连续7年在贵州省医疗机构中排名第一;2015-2017年,累计开展新技术、新项目426项,各级科技成果奖27项,连续获得2015年、2016年贵州省科技进步一等奖;先后荣获“全国优秀全科专业住培基地”“H7N9防控工作先进单位”“2018年度群众满意的医疗机构”等荣誉。
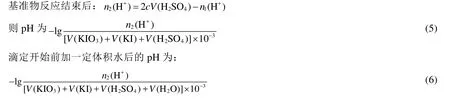
由公式6理论分析可以看出,加入少量水对溶液pH影响不大。学生通过实验考查滴定开始前加入不同体积水对pH的影响,数据见表3。
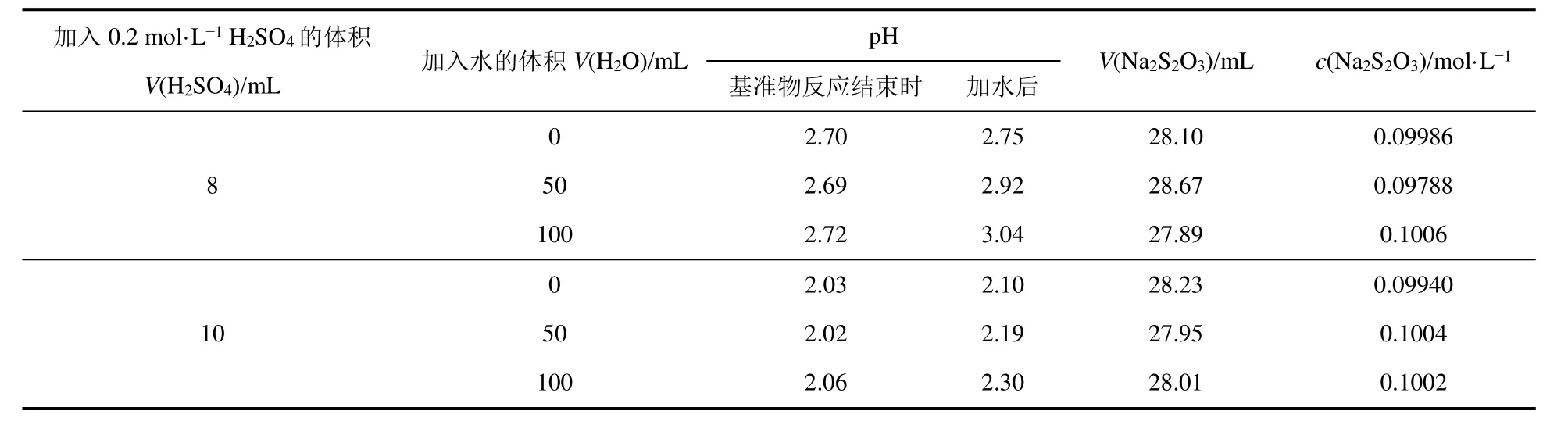
表3 滴定开始前加入不同体积水对Na2S2O3溶液标定的影响
2.2.3 反应时间影响
基准物KIO3作为氧化剂与KI反应中,在酸性条件下氧化性增强,且酸性越强,氧化性越强,反应速率也越快。而反应时间过长,会发生副反应,增加I2的挥发。表4是加入10 mL 10% KI溶液时,不同pH条件下,不同反应时间的实验数据。
表4数据显示,pH分别为2、3、4时,反应时间为3 min和5 min的实验数据基本一致。而不同pH时,反应时间为0 min时与方法一的实验结果最相近。说明KIO3作为基准物,与KI和H2SO4溶液的反应速率快,反应物混匀后无需放置,可立即开始滴定。
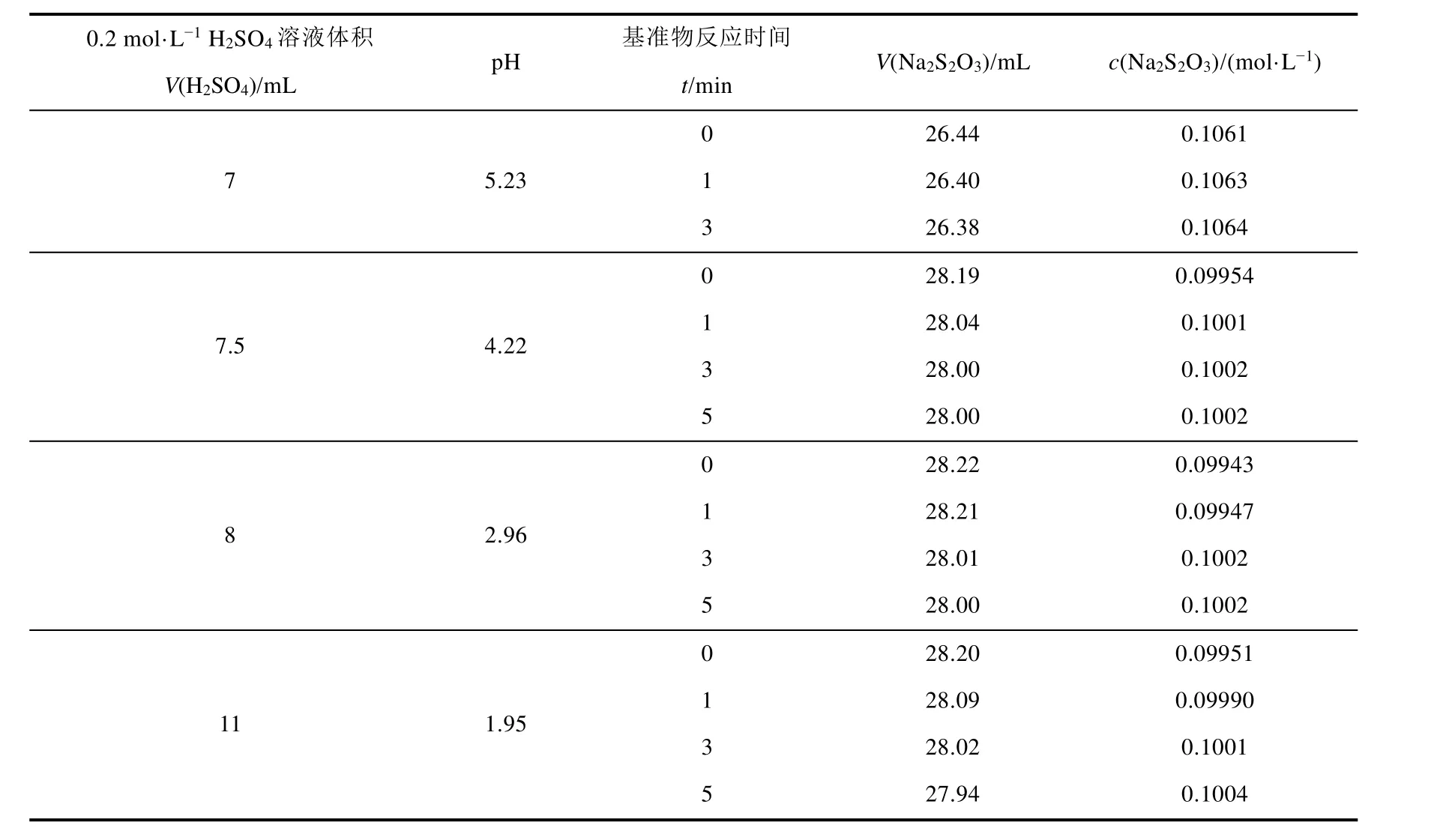
表4 不同pH条件下反应时间对Na2S2O3溶液标定的影响
2.2.4 KI加入量的影响
基准物反应需加入过量的KI,以增加反应物浓度,促使反应进行得更完全。而且过量I-与I2反应生成,增加I2溶解度,确保滴定反应定量进行。但若KI过量较多,会造成滴定反应产物I-浓度增加,致使反应进行不完全。为提高KI的加入速率,选择加入10% KI溶液。由公式7–9理论计算得出与KIO3反应需要KI的质量为0.6210 g,10% KI溶液体积约为5.6 mL。即基准物反应最少需要约5.6 mL的10% KI溶液。表5考查了不同pH条件下,加入不同体积的10% KI溶液的影响。

分析表5可以看出,加入5 mL 10% KI溶液时,由于KI量不足造成产生较多无法溶解的I2,滴定实验无法正常进行。pH为2–4时,10% KI溶液体积大于8 mL标定所得c(Na2S2O3)与方法一相近。pH为3,加入10 mL 10% KI溶液,以及pH为2,加入13 mL 10% KI溶液时标定所得Na2S2O3浓度与方法一最相近。
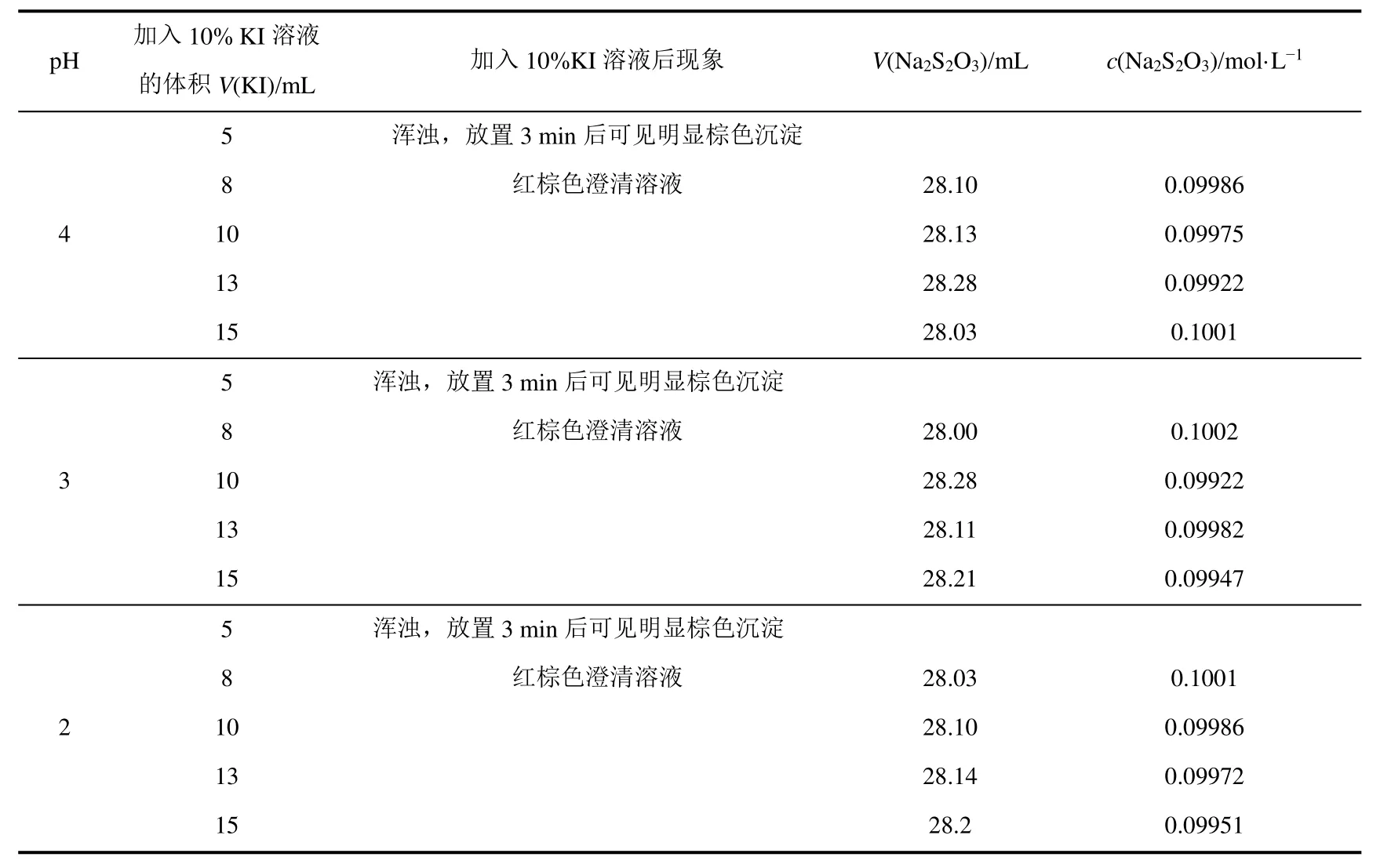
表5 不同pH时10%KI溶液的加入体积对Na2S2O3溶液标定的影响
2.3 实验数据讨论分析
将方法二与方法一的实验数据相比较可以看出,选择KIO3为基准物标定Na2S2O3溶液的条件是溶液pH小于4,硫酸的加入量应严格控制,以防止pH骤变。加入10% KI溶液的体积应大于10 mL,基准物反应速率快,反应物混合均匀后可立即开始滴定。滴定开始前水的加入对pH影响不大。滴定过程中,淀粉指示剂在滴定至溶液呈淡黄色时加入,继续滴定至蓝色恰好消失呈无色,即为滴定终点。
3 教学建议及总结
(1) 实验以学生为主体,教师主要起到引导作用,通过观察实验现象提出问题,引导学生整理所学理论知识,结合学习的实验内容,融会贯通,设计有理有据的实验方案。
(2) 根据基准物的不同和需要考查的实验影响因素,将全班分成小组进行实验。小组间积极开展针对实验基本操作技能和实验方案设计、实施的介绍和讨论。
(3) 该实验属于滴定分析中的氧化还原滴定,在实验方案的实施中,引导学生借鉴电位滴定法的实验装置,全面培养学生的综合实验技能。
(4) 培养学生学习整理实验数据,对比分析数据,得出实验结论的能力。实验报告以论文的形式完成,训练学生整理数据和撰写科技论文的能力。
(5) 实验内容具有较强的可操作性和研究性。教学实践证明能够激发学生的实验热情,有利于培养学生严谨的科学思维和勇于探索的研究精神。
