大鼠坐骨神经固有频率测定
2021-06-03尹露安云杨斌堂杨诣坤卢新刚严隽陶
尹露,安云,杨斌堂,杨诣坤,卢新刚,严隽陶
1.上海中医药大学附属岳阳中西医结合医院推拿科,上海200437;2.上海交通大学机械系统与振动国家重点实验室,上海200240
前言
固有频率也称为自然频率,指结构系统受到外界激励产生响应时,在其平衡位置附近作往复运动,其运动的频率仅取决于系统本身的物理特性(如质量、刚度),与外界激励无关,此频率称为固有频率[1-2]。不管外界有无激励,结构的固有频率始终存在,只是当外界有激励时,结构能按其固有频率产生振动响应。如果从生物力学角度将人体视为一个机械振动模型,各部分器官、组织都是一个振动系统,都有其相应的固有频率。当机体受到的外界激励频率与机体组织的固有频率接近或相等时,能引发共振从而激活组织系统的兴奋性,此时组织受迫振动的幅度最大[3-4]。基于共振现象,有研究者提出了多种固有频率的测算方法[2,5],且既往研究提示外在频率源作用于机体时,频率是影响神经肌肉系统兴奋性的主要因素[6-8]。因此,本研究通过检测相关实验中关注较多的大鼠坐骨神经的固有频率,观察神经正常状态、损伤状态以及离体状态下固有频率的变化,以期为康复治疗仪器频率的选择提供一定参考。
1 材料与方法
1.1 实验动物及分组
选取成年健康Sprague-Dawley大鼠18只,体质量220~250 g,由上海中医药大学附属岳阳中西医结合医院实验动物中心提供并饲养。饲养条件:温度24~26℃,湿度55%~65%,12 h光照12 h黑暗交替,自由摄食和饮水。将实验大鼠按体质量大小编号,采用随机数字表法分为正常组、坐骨神经损伤(SNI)7 d组、SNI 28 d组,每组各6只。实验检测中增加离体组,即正常组的离体神经检测,详见1.4检测方法。实验过程中对大鼠的处置严格遵守动物伦理准则和指南的相关规定。
1.2 主要仪器及试剂
SXP-1C手术显微镜(上海医光仪器有限公司),10%水合氯醛(上海西唐生物科技有限公司),手术剪、止血钳、组织镊、持针器(上海金钟),显微剪、显微镊、显微持针器(上海金钟),11-0显微外科带针缝合线、3-0带针缝合线(宁波灵桥),固有频率检测平台(上海交通大学机械系统与振动国家重点实验室)。
1.3 SNI模型制备
参照课题组前期模型制备方法[9]:a.术前24 h禁食水;b.10%水合氯醛腹腔注射麻醉,剂量0.3 mL/100 g;c.取右下肢备皮,俯卧位固定于操作台上,常规消毒;d.无菌状态于右侧坐骨切迹下约5 mm处沿坐骨神经走向做臀部横向切口,切口约1.5 cm,钝性分离筋膜及肌肉组织,撑开皮肤及肌肉后充分显露坐骨神经,显微手术器械将坐骨神经游离;e.在梨状肌下约10 mm处使用JZ06Cr 14 cm止血钳3扣的压力,以止血钳前1/3处完全闭合钳夹神经干,钳夹3次,每次10 s,中间间隔10 s,全程共50 s,造成宽约2 mm的神经损伤。松开血管钳后见钳夹段神经完全透明,但神经外膜处未见出血,造成Sunderland III度损伤[10]。钳夹后于显微镜下在损伤点上1 mm处用110缝合线进行外膜标记(图1);f.术后使用注射用青霉素钠消炎并缝合肌肉和皮肤。为保证实验的均一性,肌肉均缝一针,皮肤均缝两针,所有的钳夹及缝合均由同一操作人员完成。正常组不予处理。
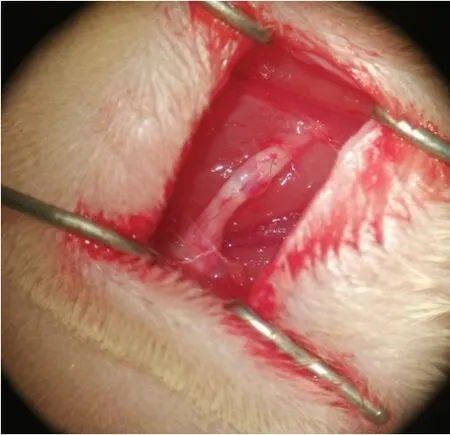
图1 大鼠坐骨神经钳夹伤模型Fig.1 Rat model with sciatic nerve clamp injuries
1.4 检测方法
于造模后第7天,将正常组大鼠麻醉后行坐骨神经剥离术(如1.3部分步骤a~d),将大鼠左侧卧位放置于振动测试平台,充分暴露坐骨神经。在大鼠坐骨神经自梨状肌下10 mm处,沿神经走向放置约1 mm×2 mm、厚约10 μm的反光膜(铝箔纸),振动台上放置一激光传感器,使激光光源向反光膜射出激光信号。应用振动平台施加扫频激励,使用Labview软件编写上位机界面,对数据进行分析与处理,可对采集的响应时域信号进行快速傅里叶变化,因频率源的输出能够在测量所需的范围内连续扫描,因此可以连续测出各频率点上的频率特性结果并立即显示特性曲线。通过OriginPro软件分析频率特性曲线的峰值处频率,即为固有频率(图2)。每只大鼠坐骨神经测量6次,取平均值确定为固有频率。然后逐一将正常组大鼠坐骨神经自梨状肌下10 mm处切除长约10 mm远端神经段,以同样方法进行离体坐骨神经段的固有频率测定(即1.1的离体组)。随后取SNI 7 d组大鼠,于SNI标记点下端沿神经走向放置反光膜,如上述操作进行固有频率检测。造模后第28天,将SNI 28 d组大鼠以同样方法进行坐骨神经固有频率检测。

图2 坐骨神经固有频率检测Fig.2 Sciatic nerve natural frequency detection
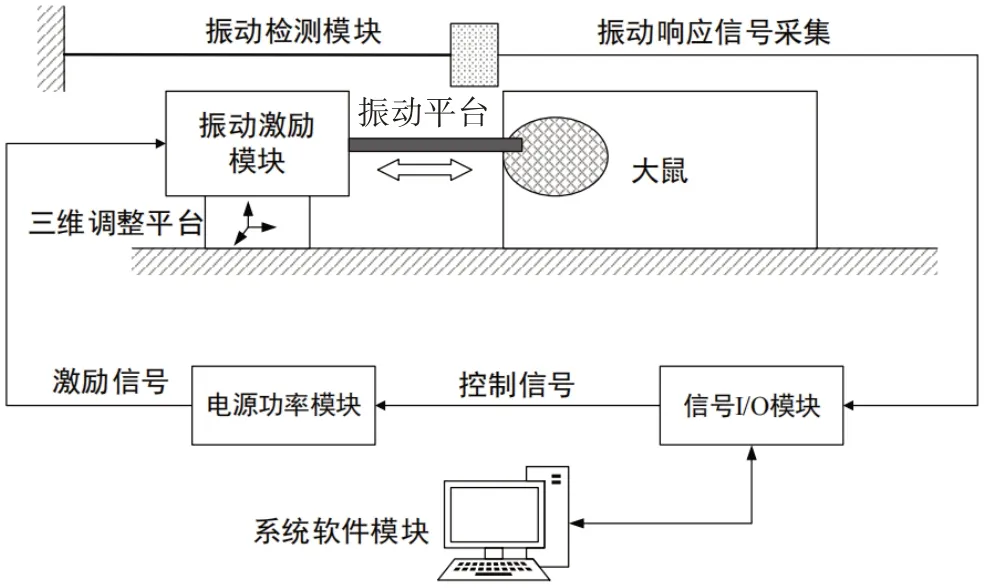
图3 系统功能框解图Fig.3 System function block diagram
1.5 统计学方法
采用SPSS25.0软件进行数据分析处理。符合正态分布的计量资料用均数±标准差表示,数据比较采用单因素方差分析,各组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠坐骨神经频率特异性曲线
正常组、离体组、SNI 7 d组、SNI 28 d组大鼠坐骨神经频率特异性曲线均显示单一峰值,见图4。
2.2 4种状态下大鼠坐骨神经固有频率比较
正常组、离体组、SNI 7 d组、SNI 28 d组固有频率(Hz)分别为9.666±0.113、9.840±0.390、9.668±0.303、9.366±0.474。4组坐骨神经组间固有频率比较,经检验数据服从正态分布且方差齐,使用单因素方差分析,结果显示差异无统计学意义(F=1.937,P=0.156);进一步组间两两比较显示,正常组与离体组、SNI 7 d组、SNI 28 d组比较,SNI 7 d组与SNI 28 d组比较,差异均无统计学意义(P>0.05)。固有频率测量值总体均数为9.635 Hz。
4组坐骨神经组内固有频率比较,正常神经、离体神经及SNI 7 d组神经3种状态下组内数据差异均无统计学意义(P>0.05),SNI 28 d组内固有频率数据比较差异有统计学意义(P=0.009)。见表1。
3 讨论
SNI是常见的下肢周围神经损伤,坐骨神经钳夹伤模型因保存有神经干的连续性、操作简便、术后瘢痕组织较少等优点,被广泛应用于周围神经损伤后运动、感觉等功能短期修复的实验研究[11]。根据大鼠坐骨神经Ⅲ度损伤恢复情况,实验研究应用物理治疗时一般选择损伤7 d后开始干预,且维持至损伤后28 d左右。因此,本实验选择坐骨神经Ⅲ度钳夹伤模型,以正常神经、SNI 7 d神经、SNI 28 d神经以及离体神经4种状态进行固有频率检测。
实验结果显示给予大鼠坐骨神经施加振动频率源后,不同状态下的组间固有频率均值略有差异,但经检验差异无统计学意义;组内固有频率比较中,正常神经、SNI 7 d神经以及离体神经3种状态下固有频率值差异不大,而SNI 28 d神经组内比较有差异,考虑可能为神经损伤28 d后损伤表面瘢痕组织的形成造成一定干扰,但组内个体固有频率仍维持在8.722~10.533 Hz。因此可认为实验大鼠坐骨神经固有频率约为9.635 Hz,且神经组织固有频率是其本身的特有属性,不会因所处状态不同而发生很大变化,对今后物理治疗仪器频率的选择有一定参考意义。

图4 各组大鼠坐骨神经频率特异性曲线Fig.4 Sciatic nerve frequency-specificity curves in different groups

表1 各组组内个体固有频率比较(Hz)Tab.1 Comparison of individual natural frequency among 4 groups(Hz)
由于周围神经损伤后的神经功能障碍和失神经支配的骨骼肌萎缩是目前神经科学、康复医学以及相关学科共同关注的难题[12-13]。随着中西医结合康复学的发展,多种物理治疗技术相继在临床中得以应用,其中振动疗法作为一种临床预防和康复治疗工具,在周围神经损伤后神经功能恢复、神经性疼痛的缓解以及肌肉骨骼系统调节等方面均显示出优势[14-16]。但最佳干预参数的选择以及振动干预的相关作用机制仍没有一致结论。研究发现除颅骨和眼球外,人体各器官固有频率一般为0~20 Hz[3],已有研究提示在适宜频率作用下能最大限度地激活神经肌肉系统的兴奋性,使得病理状态下的神经肌肉恢复正常生理功能;应用物理治疗时优选共振频率,必将增强该组织对能量的吸收,提高临床治疗效果[17-19]。因此,基于神经组织的固有频率研究振动疗法在坐骨神经损伤后神经再生修复的影响,以及探寻共振效应促进神经修复的潜在机制将是今后研究的方向。
