高亲和力抗eGFP纳米抗体的筛选与应用
2021-06-02刘晓芳周方月黄云祥钟引凤张茹云梁宇芳付金衡
刘晓芳,刘 贝,周方月,黄云祥,钟引凤,张茹云,梁宇芳,王 丹,付金衡*
(1.南昌大学a.生命科学学院,江西 南昌 330031;b.中德联合研究院,江西 南昌 330047;2.江西农业大学,江西 南昌 330045)
Shimomure等首次分离出的GFP[1]具有β桶和α-螺旋使其性质稳定[2],研究者常把它作为一种标签分子应用于抗体检测[3-4]、单分子荧光成像[5]、细胞内定位[6-7]等领域[8]。GFP/eGFP作为最常用的工具蛋白,在生命科学研究中具有很高的研究与应用价值,抗GFP/eGFP纳米抗体应运发展。与传统抗体相比,具有小体积,15 KDa分子质量;耐酸耐热较高稳定性、穿透力强、易于基因工程改造及表达、亲和性高等优点[9-10]的纳米抗体被广大科学研究者应用于各领域[11],例如在发育生物学中的有机体和细胞培养系统中[12-13],作为稳定生物学中构象状态的结晶伴侣[14,15];作为酶的活性调节剂或抑制剂[16,17];作为生物化学分析的免疫组化试剂[18]或作为“二抗”检测抗鼠抗Ig的免疫印迹和免疫荧光[19]等。特异性结合GFP/eGFP的抗GFP/eGFP纳米抗体在亚细胞定位[20]、细胞内信号通路研究和活细胞成像[21-22]以及靶向纳米材料[22]等方面被广泛应用。但对高亲和力的抗GFP/eGFP纳米抗体的研究鲜少报道。
本研究以eGFP蛋白免疫羊驼皮下部位,构建抗eGFP纳米抗体噬菌体展示文库;经过四轮淘选获得能与eGFP结合的纳米抗体,通过基因克隆技术在大肠杆菌Rosetta中表达,获得了高亲和力的纳米抗体4-28,HRP酶标纳米抗体4-28作为检测“二抗”,简化ELISA实验操作,纳米抗体4-28偶联纳米磁珠,免疫沉淀B13-eGFP融合蛋白,为抗eGFP纳米抗体的应用奠定基础。
1 材料与方法
1.1 实验材料与试剂
M13辅助噬菌体、噬菌粒载体pComb3XSS、E.coliTG1、E.coliDH5α、Rosetta(DE3)、pET-25b(+)载体均由本实验室保存;弗氏佐剂购自Sigma公司;质粒提取试剂盒、DNA纯化试剂盒、割胶纯化试剂盒购自天根生物有限公司;Taq酶、核酸内切酶、DNA连接酶等均购自TaKaRa公司;M13 Bacteriophage Antibody(HRP)购自北京义翘神州科技有限公司;HRP Anti His-Tag Mouse Monoclonal Antibody购自北京康为世纪生物科技有限公司;人外周血淋巴分离液、所需引物购自生工生物工程(上海)股份有限公司。
巢式PCR扩增VHH基因,所需引物分别为:
VH-LD:CTT GGT GGT CCT GGC TGC
CH2-R:GGT ACG TGC TGT TGA ACT GTT CC
VHH1:CATGCCATGACTGTGGCCCAGGCGGCCCAGKTGCAGCTCGTGGAGTC
VHH2:CATGCCATGACTCGCGGCCGGCCTGGCCATGGGGGTCTTCGCTGTGGTGCG
VHH3:CATGCCATGACTCGCGGCCGGCCTGGCCGTCTTGTGGTTTTGGTGTCTTGGG
1.2 实验仪器与设备
台式高速冷冻离心机、酶标仪、NanoDrop购自Thermo公司;超声波细胞粉碎机购自宁波新芝公司;凝胶成像系统购自上海天能科技有限公司;电泳仪购自BIO-RAD公司;恒温培养箱和恒温摇床购自上海一恒科技公司;PCR仪购自艾本德公司;DYY-I III稳压电泳购自为北京六一仪器厂。
1.3 方法
1.3.1 噬菌体展示文库的构建
分别取免疫前静脉血作阴性组和每次免疫后静脉血,监测血清效价;取eGFP四免羊驼后的静脉血50 mL提取总RNA,然后反转录成cDNA,两步巢式PCR进行扩增VHH基因,将纯化后的VHH基因克隆至M13噬菌粒载体pComb3XSS上,电转至E.coliTG1感受态细胞中,得到噬菌体文库。
1.3.2 抗eGFP纳米抗体的淘选与鉴定
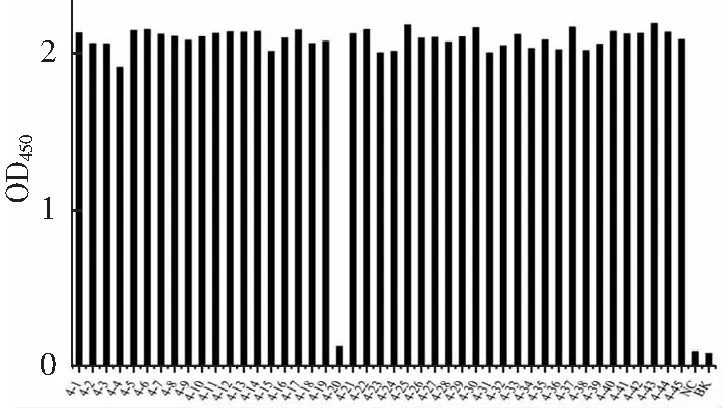
采用固相亲和淘选的方法,以eGFP为靶标从噬菌体文库中淘选特异性结合eGFP的纳米抗体。淘选策略如下,1)逐轮降低抗原包被在酶标板孔中的浓度:100~1 μg·mL-1;2)每轮均投入纳米抗体文库:1.0×1012cfu,3)逐轮降低抗体库与抗原结合时间:第1轮结合60 min,第2轮结合30 min,第3~4轮结合15 min;4)逐轮增加洗涤次数:第一轮分别用磷酸盐吐温缓冲液(PBST)和磷酸盐缓冲液(PBS)各洗涤5次,第二、三、四轮各洗涤10,15,20次;5)噬菌体洗脱:先采用pH 4.0的甘氨酸-盐酸洗脱掉亲和力较低的噬菌体,然后再采用pH 2.2的甘氨酸-盐酸洗脱得到特异性噬菌体,每一轮的洗脱条件一致。采用间接phage-ELISA鉴定从第3,4轮测定洗脱物滴度的平板上各随机挑取的45个单菌落,确定阳性克隆。
1.3.3 抗eGFP纳米抗体的原核表达与纯化
1)PCR扩增出阳性噬菌体克隆子片段;NcoI和NotI分别酶切4-28基因与pET-25b(+),将纯化的目的片段与表达载体用T4 DNA连接酶16 ℃过夜连接,连接产物转化至Rosetta(DE3)感受态中;菌落PCR验证随机挑取的10个克隆子并测序。
2)1%接种量转接至100 mL培养基,37 ℃ 220 r·min-1震荡培养至OD600≈0.6-0.8时加入终浓度为0.1 mmol·L-1IPTG,30 ℃ 220 r·min-1震荡培养6 h;收集培养物;PBS重悬离心后的菌体,将超声破碎后的上清经Ni-NTAResin纯化,SDS-PAGE分析纯化结果。
1.3.4 ELISA鉴定抗eGFP纳米抗体活性及特异性
1)将1 μg·mL-1的eGFP 4 ℃过夜包被;PBST甩洗3次,4%脱脂乳37 ℃封闭1 h;PBST甩洗3次,100 μL·孔-1加入稀释至不同浓度纯化后的纳米抗体4-28,37 ℃孵育30 min;PBST洗板3次,加入二抗,37 ℃孵育30 min;PBST甩洗拍干6次,加入预热的TMB单组份显色液,37 ℃孵育8-10 min,最后加入浓H2SO4终止液终止反应,酶标仪测OD450。
2)分别将eGFP,GFP,黄色荧光蛋白(YFP),牛血清白蛋白(BSA),卵清蛋白(OVA)稀释至1 μg·mL-1包被于酶标板中,按照1)的实验方法进行操作,测OD450。
1.3.5 亲和力测定
采用OCTET系统生物传感器测定纳米抗体4-28与eGFP的亲和力,将200 μL生物素化的eGFP固定在链酶亲和素的探针上,洗涤,加入200 μL纳米抗体,使抗原抗体结合,结束后进行解离;最后通过软件进行拟合运算计算出动力学参数。
1.3.6 HRP偶联纳米抗体4-28及工作浓度和稳定性鉴定
1)采用过碘酸钠法将HRP偶联抗eGFP纳米抗体4-28,向0.3 mg的溶于HAc-NaAc、(pH 5.6)溶液中HRP中加入NaIO4,使其HRP表面的糖分子氧化成醛基,1 mmol·L-1醋酸钠缓冲液(pH 4.4)每隔4 h透析两次后,加入150 μg的纳米抗体(4-28)4 ℃反应4 h,加入CH3BHNa(5 mol·L-1)反应后用乙醇胺封闭,加入终饱和度45%的硫酸铵粉末,离心取沉淀即为偶联物。
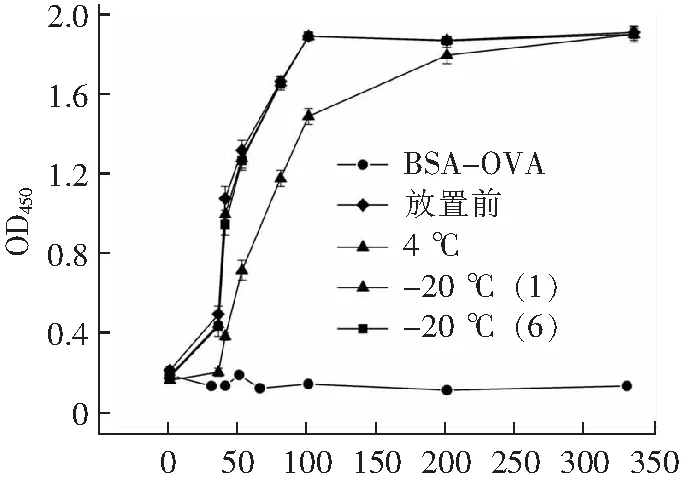
2)直接ELISA鉴定其工作浓度及稳定性,分别包被eGFP和BSA/OVA 1μg·mL-1,封闭后加入稀释不同倍数的HRP偶联纳米抗体4-28,加入预热的TMB单组份显色液反应8-10 min后终止,测OD450值。分别将放置-20 ℃ 2个月和6个月的HRP偶联纳米抗体4-28直接ELISA(同上)的实验操作验证其稳定性。
1.3.7 B13-EGFP融合蛋白的原核表达与纯化
分别将eGFP PCR产物和pET-25b-B13经HindIII、NheI双酶切后T4DNA连接酶连接,钙转至Rosetta(DE3)感受态中;随机挑选5个克隆子菌落PCR后测序。诱导表达与纯化参照1.3.3操作。
1.3.8 纳米抗体4-28偶联纳米磁珠及免疫沉淀B13-EGFP融合蛋白
1)羧基化的纳米磁珠偶联高亲和力的纳米抗体4-28,在磁力架的作用下,将磁珠固定在离心管壁上,活化3~4次,加入活化缓冲液、EDC和Sulfo-NHS,室温孵育15 min;磁珠被固定在管壁上后吸弃上清,加入纳米抗体4-28适时反应后4 ℃过夜偶联;重复封闭两次,加入保存液4 ℃保存备用。
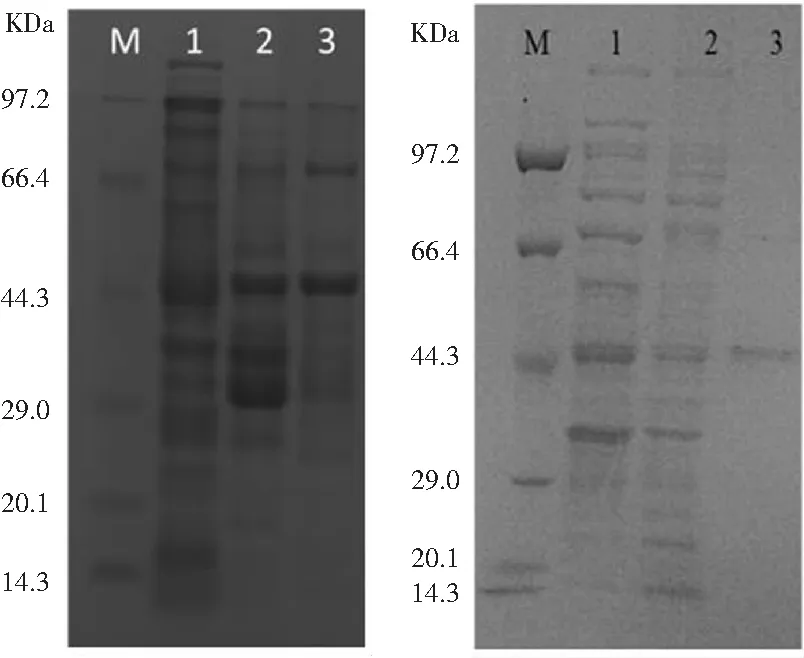
2)根据抗原抗体反应原理,免疫沉淀B13-eGFP融合蛋白。将含有pET-25b-B13-eGFP质粒的Rosetta细胞诱导表达后超声破碎,加入抗eGFP纳米抗体4-28偶联磁珠,并用碳酸盐缓冲液(CBS)洗涤磁珠沉淀物3次,去除未结合的杂蛋白,SDS-PAGE鉴定上清液和磁珠沉淀物。
2 结果与讨论
2.1 噬菌体展示文库的构建
四免后的羊驼抗血清滴度超过1.28×106(图1a)。采用两步巢式PCR扩增VHH基因,第一步扩增得到了约750 bp的片段(图1b),第二步扩增得到了约500 bp的目的基因(图1c);将VHH基因克隆至M13噬菌粒载体pComb3XSS后转化至E.coliTG1,收获到库容量为1.85×108cfu纳米抗体原始库,经MI3KO7救援后得到滴度为4×1013cfu·mL-1的噬菌体展示文库。
2.2 抗eGFP纳米抗体的淘选与鉴定
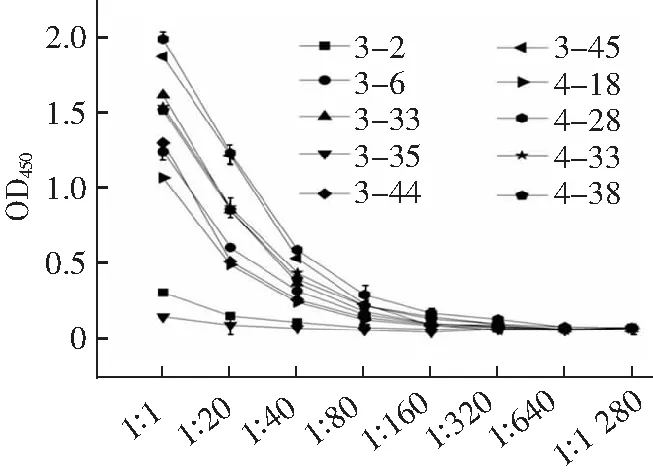
抗体的亲和常数KD=Koff(解离常数)/Kon(结合常数),KD值越小,抗体的亲和力越高。本研究拟获得高亲和力的抗eGFP纳米抗体,因此在原有的基础上适当调整了淘选策略。通过逐轮降低抗原包被浓度、逐轮减少抗体文库与抗原的结合时间,以期保留Kon值较大的纳米抗体;通过逐轮增加洗涤次数、并在洗脱前用pH 4.0的甘氨酸盐酸除去Koff相对较大的纳米抗体,淘选数据(表1)中表明抗eGFP特异性纳米抗体有效富集(富集度为52.17);由于第三四轮淘选时,包被抗原的浓度依次从20降低到5再到1 μg·mL-1以及逐轮增加淘选条件严格程度,使第三轮和第四轮的回收率和富集度没有明显增加,甚至出现了一定程度的降低(富集度小于1),该结果表明,本研究采用的淘选策略有效的富集了高亲和力纳米抗体,除掉了低亲和力纳米抗体。采用间接ELISA鉴定第3、4轮克隆子,结果如图2、3所示,阳性率达到了95.56%和97.78%;2采用DNAstar软件进行多序列对比分析,得到了10种纳米抗体序列;将这10种纳米抗体的噬菌体分别稀释至同一浓度,采用ELISA测试其结合活性,结果如图4所示,克隆4-28的OD450最高。

稀释比/W(a)

表1 淘选结果

NC:阴性对照;BK:空白对照。
NC:阴性对照;BK:空白对照。
稀释比
2.3 原核表达载体的构建与表达
按照1.3.3的方法构建原核表达载体,菌落PCR验证如图5所示,将750 bp处条带测序且测序结果显示序列正确,表达载体构建成功。将构建好的表达载体转化至大肠杆菌Rosetta感受态中,IPTG(0.1 mmol·L-1)30 ℃诱导表达6 h后超声破碎,破碎上清经Ni-NTAResin纯化后得到与预期大小相符的20 kDa左右的纳米抗体4-28蛋白(图6),BCA定量蛋白浓度为1.2 mg·mL-1。

泳道M:DNA marker DL2000;泳道1-10:随机挑取的转化子。
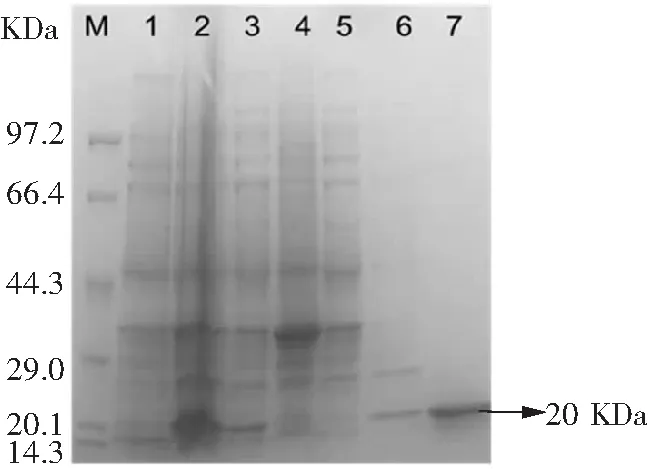
M:蛋白marker;泳道1:诱导前菌体总蛋白;泳道2:诱导后菌体总蛋白;泳道3:破碎上清;泳道4:破碎沉淀;泳道5:镍柱纯化流穿液;泳道6:20 mmol·L-1咪唑洗涤液;泳道7:100 mmol·L-1咪唑洗脱液。
2.4 抗eGFP纳米抗体的结合活性及特异性分析
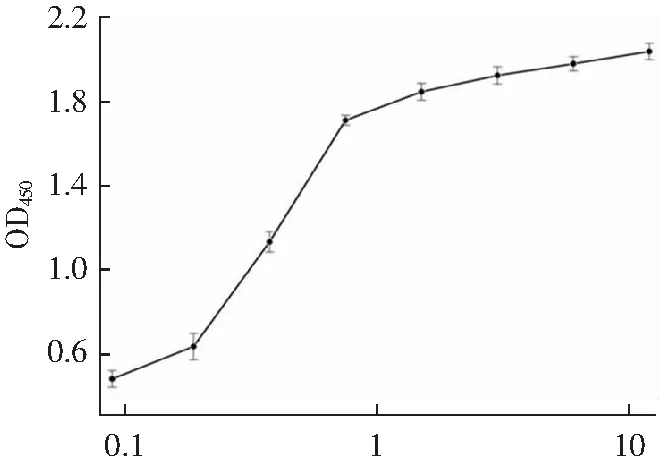
采用ELISA分析的结合活性,如图7所示,随着抗eGFP纳米抗体4-28浓度的增加,其OD450值逐渐升高并趋于稳定,表明纳米抗体4-28结合活性良好;将eGFP/GFP/YFP/BSA/OVA稀释至相同浓度包被后,加入相同浓度的纳米抗体,测OD450,如图8所示,该抗体和eGFP、GFP蛋白结合,和YFP、BSA、OVA结合很弱或不结合,表明纳米抗体4-28特异性良好。
抗体浓度/(μg·mL-1)(a)
2.5 亲和力测定分析
采用ForteBio Octet研究纳米抗体与eGFP的亲和力。结果如图8所示,纳米抗体4-28的结合常数(Kon)和解离常数(Koff)分别为2.74×105M-1和2.65×10-5M-1s-1,则KD为9.67×10-11M。表2为10种独特序列的抗eGFP纳米抗体的亲和力常数(KD),其中3-2和3-45未检测到信号。纳米抗体作为单价抗体,只有一个结构域,其亲和力与传统单克隆抗体相比较低,已有文献报道的纳米抗体亲和力常数多在1 μM-1 nM。本研究获得的纳米抗体4-28亲和力相对较高,表明实验中采用的淘选策略是正确的。

T/s

表2 10种纳米抗体亲和力常数
2.6 HRP标记纳米抗体4-28工作浓度及稳定性鉴定
如图9所示,4 ℃放置一周后,抗体活性下降,-20 ℃放置,时间长短对抗体活性无影响,由图9可知该酶标抗体的使用稀释范围为1:10 000~1:25 000(浓度100~40 ng·mL-1),相比于市场上现有的检测二抗(稀释范围1:5 000~1:20 000)其灵敏度更高。
2.7 融合蛋白的诱导表达及免疫沉淀
表达后的B13-eGFP融合蛋白经Ni柱纯化时,仅用100 mmol·L-1咪唑洗脱目的蛋白,结果如图10a所示,获得分子量为45 kDa左右的胞内可溶性的蛋白条带,经IP鉴定是目的B13-eGFP融合蛋白,但只用一个浓度的咪唑洗脱液洗脱目的蛋白时,目的蛋白纯度经Quantity one分析只达到了19.1%。抗EGFP纳米抗体与羧基化磁珠偶联后免疫沉淀破碎后的融合蛋白,结果如图10b所示,SDS-PAGE凝胶电泳显示在45 KDa出现与B13-eGFP融合蛋白大小一致且纯度高的目的条带,与蔡召忠等用Ni柱分离纯化PEP-1-VP3融合蛋白[23]相比,该分离目的蛋白的方法简单快速且纯度高。
浓度/(ng·mL-1)
(a) (b)
3 总结
在羊驼免疫效价超出1.28×106时,成功构建了抗eGFP纳米抗体文库。依据抗原-抗体相互作用的动力学规律,在淘选时通过调整eGFP的包被浓度、文库与eGFP结合时间、洗涤次数、噬菌体洗脱方式等条件获得了10种高亲和力的纳米抗体,其中纳米抗体4-28亲和力最高,达到了9.67×10-11M。此外,纳米抗体4-28与eGFP和GFP有较好的结合,与YFP等蛋白无明显结合。本研究获得的高亲和力纳米抗体在肿瘤检测等免疫学研究中有望成为非常理想的工具抗体。高亲和力的抗eGFP纳米抗体4-28与HRP酶进行偶联用作检测二抗,检测范围在1:10 000~1:25 000(浓度100~40 ng·mL-1),相比于市场上现有的检测二抗(稀释范围1:5 000~1:20 000)其灵敏度更高。高亲和力的纳米抗体能够特异性的和eGFP/GFP标记的目的蛋白快速结合,在免疫沉淀实验中,利用磁分离技术,可简单快速分离得到沉淀复合物。
