基于TAS2R38探究黄连“苦寒败胃”的生物基础
2021-05-27陈昺伃张璐卢冬雪严晶孙志广
陈昺伃 张璐 卢冬雪 严晶 孙志广

〔摘要〕 目的 基于苦味受體38(bitter taste receptor, TAS2R38)探讨久服、误服黄连导致“苦寒败胃”的生物基础。方法 ICR小鼠随机分为5组,分别为空白对照组、黄连低(0.5 g/kg)/中(1.5 g/kg)/高(4.5 g/kg)剂量组和苯甲地那铵组(0.225 g/kg),每组12只。各组小鼠分别灌胃给予相应的药物,持续8周。于第2、4、8周处理动物,RT-qPCR检测小鼠胃肠TAS2R38 mRNA表达水平;观察小鼠胃排空、肠推进;ELISA测定小鼠胃泌素和胆囊收缩素;HE染色评估胃肠黏膜损伤程度。结果 与空白对照组相比:苯甲地那铵和黄连均显著增加TAS2R38 mRNA表达水平,其中黄连组呈剂量依赖性(P<0.01);苯甲地那铵延缓胃排空(P<0.05),黄连在第2周时促进胃排空(P<0.01),但在第4、8周则延缓胃排空,特别是中、高剂量组(P<0.05);苯甲地那铵与黄连均呈时间依赖性地抑制肠蠕动,尤以黄连高剂量组表现明显(P<0.01);苯甲地那铵与黄连均抑制胃泌素的分泌、促进胆囊收缩素的分泌(P<0.05,P<0.01);HE染色显示苯甲地那铵和黄连均可损伤胃肠组织。结论 长期使用黄连可通过激动TAS2R38,影响小鼠胃肠动力,调节胃肠激素分泌,加重胃肠组织损伤,可能是其“苦寒败胃”的生物基础之一。
〔关键词〕 TAS2R38;黄连;苦寒败胃;生物基础
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.02.012
〔Abstract〕 Objective Based on the bitter taste receptor 38 (TAS2R38) to explore the biological basis of "KuHanBaiWei" caused by long-term or mistaken intake of Huanglian (Coptidis Rhizoma). Methods ICR mice were randomly divided into five groups, including the control group, the Huanglian (Coptidis Rhizoma) in low-dose group (0.5 g/kg), middle-dose group (1.5 g/kg), high-dose group (4.5 g/kg) and denatonium benzoate group (0.225 g/kg), with 12 mice in each group. All mice were treated with the corresponding drugs by gavage for 8 weeks. The mice were killed at 2nd, 4th, and 8th weeks, RT-qPCR was performed to examine the mRNA expression of TAS2R38 in gastrointestinal tract of mice; the gastric emptying and small intestinal propulsion of mice were observed; ELISA was used to detect gastrin and cholecystokinin in mice; HE staining was used to assess the gastrointestinal mucosal lesions. Results Denatonium benzoate group and Huanglian (Coptidis Rhizoma) group could significantly increase the mRNA expression of TAS2R38 in a dose-dependent manner compared with the control group (P<0.01); denatonium benzoate delayed gastric emptying (P<0.05); Huanglian (Coptidis Rhizoma) could promote gastric emptying at the 2nd week (P<0.01), and delay gastric emptying at the 4th and 8th week, especially in the middle-dose group and the high-dose group (P<0.05); both denatonium benzoate and Huanglian (Coptidis Rhizoma) inhibited intestinal peristalsis in a time-dependent manner, especially in the high-dose group (P<0.01); both denatonium benzoate and Huanglian (Coptidis Rhizoma) inhibited the secretion of gastrin and promoted the secretion of cholecystokinin (P<0.05, P<0.01); HE staining showed that both denatonium benzoate and Huanglian (Coptidis Rhizoma) could damage gastrointestinal tissue. Conclusion Long-term use of Huanglian (Coptidis Rhizoma) can affect
gastrointestinal motility, regulate gastrointestinal hormone secretion and aggravate gastrointestinal injury in mice by activating TAS2R38, which may be one of the biological basis of "KuHanBaiWei".
〔Keywords〕 TAS2R38; Huanglian (Coptidis Rhizoma); "KuHanBaiWei"; biological basis
黄连因其有效性和功效多样性在临床被广泛应用,但长期使用或不当使用时极易引起纳差、腹泻、脘痞等症状,几千年的中医临床经验总结将这类情况称为“苦寒败胃”。所谓“苦寒败胃”,一方面是指苦药“能泻、能燥”,误服或过服均易耗伤津液及胃阴;另一方面是苦寒药清热力大,误服久服则必伤脾阳、助胃寒。后天之本受困于苦寒之品,水精不布,五经不行,气不得化,统摄无力,则倦怠消瘦、纳差痞满、腹痛、泄泻等症俱存,正所谓“百病皆由脾胃衰而生也”。有研究[1]发现黄连的有效成分如小檗碱等可以和苦味受体(bitter taste receptor, TAS2R)结合,而TAS2R被激活后可以影响胃肠功能[2]。TAS2R是一类表达于味蕾上的味觉受体细胞,作为味觉受体第二家族的成员介导苦味的感知。研究表明[3-8],TAS2R仅分布在口腔,还广泛分布在消化系统,特别是TAS2R38,它在消化系统的表达高且保守稳定[9-10],成为TAS2R家族的代表性研究对象。
基于上述情况,我们提出了本研究的科学假说:苦寒中药的代表性药物—黄连能够激活TAS2R38,引起胃肠功能的变化,这可能是其“苦寒败胃”的生物基础。
1 材料
1.1 实验动物
SPF级ICR小鼠110只,雌雄各半,体质量18~20 g,购自南京市江宁区青龙山动物繁殖场,合格证号201920449,生产许可证号SCXK(苏)2017-0001,使用许可证号SYXK(苏)2018-0049。将小鼠随机分为空白对照组、黄连低剂量组(0.5 g/kg,1/3临床等效量)、黄连中剂量组(1.5 g/kg,临床等效量)、黄连高剂量组(4.5 g/kg,3倍临床等效量)、苦味受体激动剂苯甲地那铵组(0.225 g/kg),每组12只。小鼠笼内饲养,所有鼠笼均有充足的饲料及饮用水。各组小鼠分别灌胃给予相应的药物,持续8周,于第2、4、8周处理动物。所有动物实验均遵循南京中医院大学伦理委员会规定。
1.2 实验药物制备
制备黄连水煎液:黄连200 g,蒸馏水浸泡药材0.5 h后煎煮,旋转浓缩水煎液浓度为1 g/mL。制备营养半固体糊:羧甲纤维素钠5 g、淀粉4 g、奶粉8 g、印度墨汁1 mL,在装有蒸馏水的烧杯中边加热边搅拌,使其溶解成黑色半固体糊状物,定容至150 mL。
1.3 主要试剂及仪器
苯甲地那铵、印度墨汁(大连meilunbio公司,批号D124654-5g、MB9903);HE染色试剂盒(上海Solarbio公司,批号G1120);无水乙醇(南京化学试剂有限公司,批号32061);二甲苯(上海凌峰化学试剂有限公司,批号20160217);4%多聚甲醛(上海Biosharp公司,批号1810898);胃泌素(gastrin,GAS)、胆囊收缩素(cholecystokinin,CCK)ELISA试剂盒(南京金益柏生物科技有限公司,批号JEB-12849、JEB-12772);羧甲基纤维素钠(国药集团化学试剂有限公司,批号20180702);引物(上海生工生物公司合成);Tris(德国Biofroxx公司,批号1115GR500、SBJ-R0031-96T);HiscritalI QRT SuperMix、Fast Pure Gel DNA Extraction Mini Kit、ChamQ SYBR qPCR Master Mix(南京Vazyme公司,批号R223-01、DC301、Q331-02);SYBR safe DNA gelstain、6×DNA Loading Bufer、100bp DNA Ladder(美国Thermo Fisher Scientifc公司,批号 S33102、10816015、SM0241);琼脂糖(上海Utrapure公司,批号16500-100)。
電子天平(德国Sartorius公司,型号:BSA224S-CW);离心机(湘仪离心机有限公司,型号:L420);石蜡切片机(德国Leica公司,型号:RM2245);多模式组织切片成像系统(美国Perkin-Elmer公司,型号:Mantra);实时荧光定量PCR仪(美国Thermo Fisher Scientific公司,型号:Q6)。
2 方法
2.1 TAS2R38 mRNA检测
RT-qPCR检测胃肠组织中TAS2R38 mRNA的相对表达量。取动物胃肠组织样本,按试剂说明书操作提取组织总mRNA,逆转录为cDNA,逆转条件为25 ℃ 10 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃,逆转录完成后-80 ℃保存。TAS2R38的引物序列为:TAS2R38-F AAGACCCACTGAGCCACAAC;TAS2R38-RGAGAAGCGGACAATCTTGGA。cDNA的扩增程序为:预变性95 ℃ 30 s,变性95 ℃ 10 s,退火60 ℃ 30 s,40个循环周期。釆用2-ΔΔCt方法计算样品中TAS2R38mRNA相对含量。
2.2 胃排空、肠推进测定
小鼠禁食不禁水12 h后,0.5 mL营养半固体糊灌胃,20 min后眼球取血并脱颈处死。剖开腹腔,取出小鼠的胃,用吸水纸擦干后称其全重。沿着胃大弯将胃体剪开,洗去胃里面的残留物后用吸水纸擦干,称其净重,计算小鼠的胃内残留率。轻柔分离肠系膜,取出小鼠小肠,在白色桌面上直线平铺小肠,用量尺测量黑色半固体糊前沿到幽门的距离以及回盲部到幽门的小肠长度,计算小肠推进比。
胃内残留率=(胃全重-胃净重)/灌服半固体糊重量×100%
小肠推进比=黑色半固体糊前沿到幽门的距离/回盲部到幽门小肠全长×100%
2.3 GAS、CCK检测
小鼠眼球取血后,静置分层离心(12 000 r/min,10 min)取上清,参照ELISA试剂说明书检测血清样本中GAS和CCK的含量。
2.4 胃肠组织HE染色
取出胃肠组织后,常规固定、脱水、石蜡包埋、切片、烤片、复水、染色、脱水、封片,显微镜拍照观测。
2.5 数据统计及分析
使用GraphPad Prism 8软件作图并进行统计分析,数据以“x±s”表示,组间比较采用One-Way ANOVA检验,P<0.05为差异有统计学意义。
3 结果
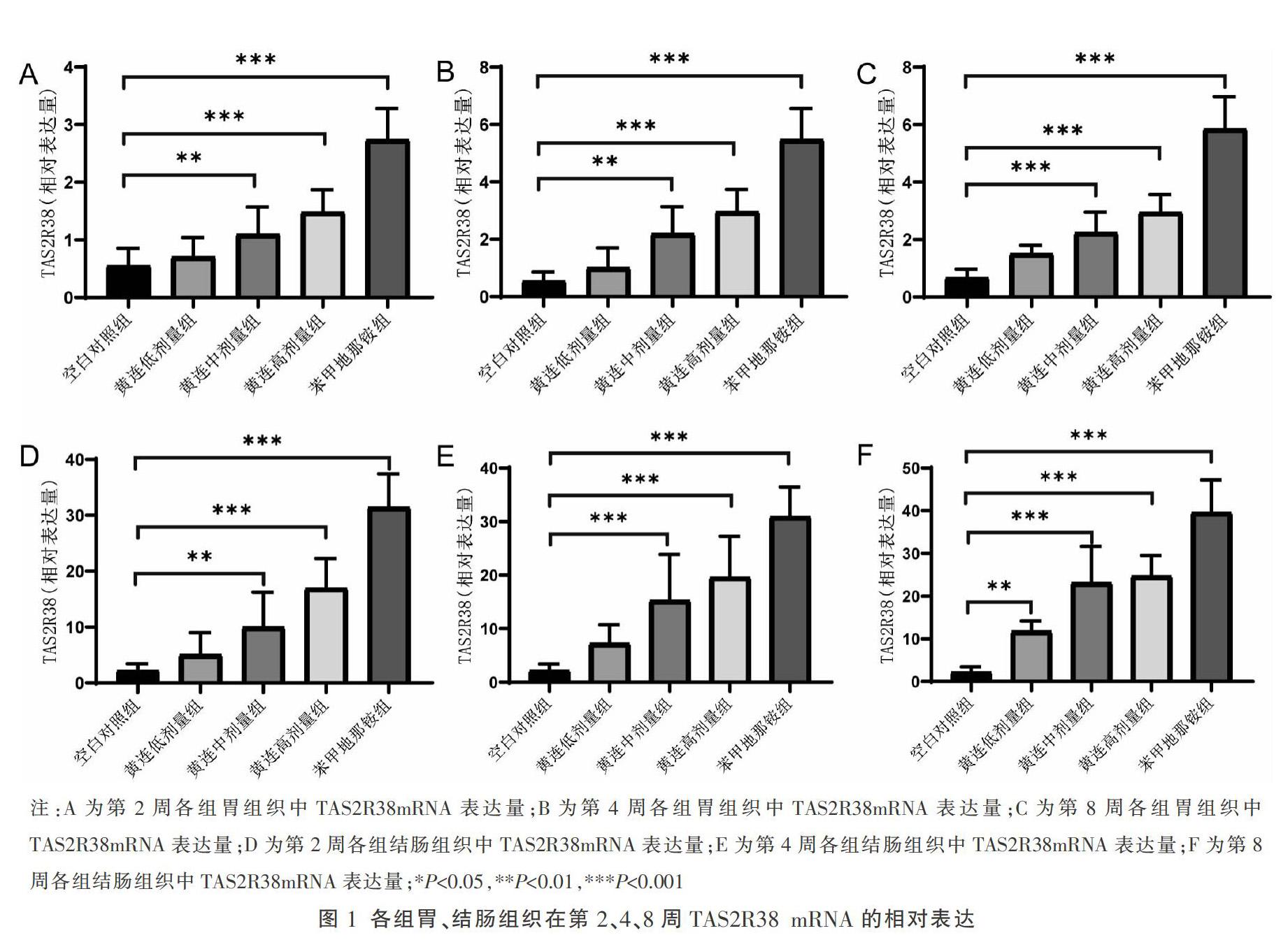
3.1 黄连对TAS2R38 mRNA表达的影响
与空白对照组相比,苯甲地那铵组胃、结肠中的TAS2R38 mRNA表达明显升高(P<0.001),同时黄连组中TAS2R38 mRNA水平也随着给药剂量增加和给药时间延长而升高(P<0.01,P<0.001)。见图1。
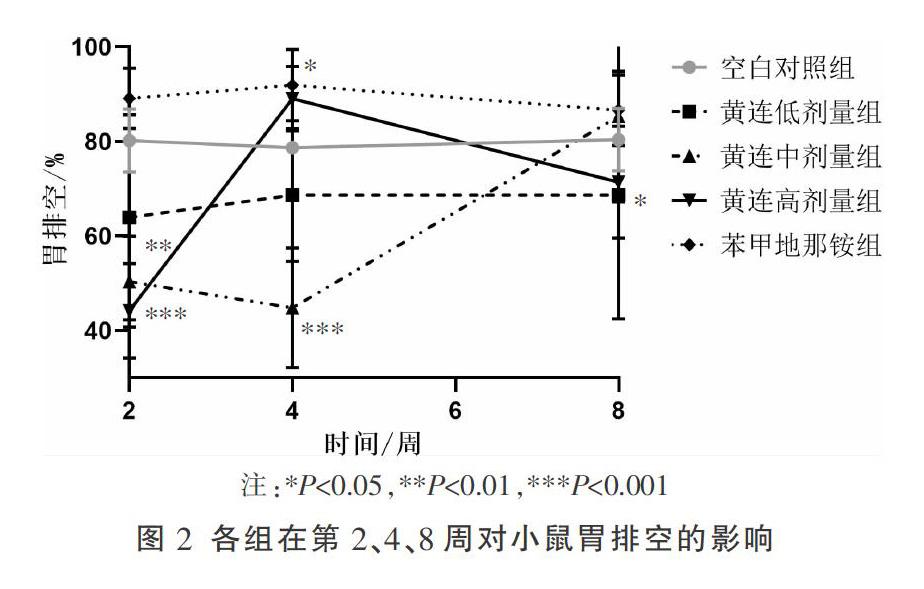
3.2 黄连对小鼠胃排空的影响
与空白对照组比较,苯甲地那铵组的胃残留率一直较高,这说明苦味受体被激活后有持久的延缓胃排空的作用。相较于空白对照组,黄连在第2周增强胃排空(P<0.01,P<0.001),但自第4周开始,黄连组逐渐呈现延缓胃排空的趋势,特别是中、高剂量组(P<0.05)。见图2。
3.3 黄连对小鼠肠推进的影响
与胃排空不同,相较于空白对照组,苯甲地那铵在第2周时会促进肠道蠕动(P<0.05),但这种促进作用随着给药时间的延长逐渐消失(P>0.05)。同样,与空白对照组相比,第2周时黄连各剂量组增加了肠道蠕动(P<0.05)。但隨着时间的推移,黄连促进肠蠕动的作用消失,高剂量组肠推进率显著下降(P<0.01)。见图3。
3.4 黄连对小鼠GAS、CCK分泌的影响
苯甲地那铵从第2周起持续抑制GAS分泌(P<0.05),黄连组虽然表现出抑制GAS分泌的趋势,但P值无明显统计学意义。在第2周,苯甲地那铵与黄连各剂量组均可促进CCK分泌(P<0.05,P<0.01,P<0.01),但随着时间的推移这种促进作用消失(P>0.05)。见图4。
3.5 黄连对胃肠组织的影响
胃组织HE染色结果显示空白对照组上皮细胞完整,胃壁细胞正常,无明显损伤;而苯甲地那铵组和黄连组随着给药时间的延长,出现明显的胃腺体减少,上皮细胞缺损以及炎性细胞浸润。结肠的HE染色中,空白对照组上皮细胞排列规整,隐窝结构正常。苯甲地那铵组和黄连组随着给药剂量的增大和给药时间的延长,结肠组织破环程度逐渐加重,隐窝萎缩且间隙增大,杯状细胞数目减少,炎性细胞可浸润至肌层。见图5。
4 讨论
黄连作为大苦大寒之品,因其疗效确切广泛、临床使用颇多,而不规范使用导致的脾胃损伤也时有发生。TAS2R是人类基本味觉中受体数量最多的[11],这与物种的生物进化过程密切相关。最早认为苦味与毒物或有害食物相关[12],苦味感受器越敏感,越能调动人体诸如呕吐、腹泻等自我保护措施[13]。TAS2R所引起的保护机制,与久服、过服黄连所致“苦寒败胃”的胃肠功能紊乱这一病理表征不谋而合。上述实验结果表明:(1)使用苦寒中药黄连能激活TAS2R38,显著提高其mRNA水平的表达。(2)黄连对胃肠功能的影响基本与TAS2R38激动剂苯甲地那铵类似,这说明黄连对胃肠功能的调节作用可能与TAS2R38被激活有关。(3)黄连在连续用药超过4周后,就会对胃肠动力产生负性作用,特别是中、高剂量组。这提示我们,临床使用黄连时应注意使用时间和剂量,避免过久及过量使用。
TAS2R参与调节胃肠运动,有学者[2]在胃内苯甲地那铵给药后口服营养素激发试验中发现,健康志愿者出现了营养素容量耐受性降低、饱腹感增强等表现,这与本实验抑制胃排空的结果一致。也有报道[14]称TAS2R激动剂对食物的摄入也有双向影响,它可以刺激胃饥饿素分泌,增加小鼠的食物摄入量,但这种作用的维持时间很短暂,食物摄入量在最初30 min内不断上升,随后在接下来的4 h内持续下降。这些研究均表明TAS2R在改变胃肠动力、干扰饥饿信号等方面发挥作用。
胃肠道是体内最大的内分泌系统,其分泌的激素可以调节胃肠道内外组织的功能,并在机体的代谢稳态中发挥重要作用,本实验证实了黄连、TAS2R38、胃肠激素之间的密切关系。有研究[15]表明大多数表达CCK的味觉细胞可能是苦味细胞,与野生型小鼠相比,敲除CCK受体的小鼠对苦味化合物的神经反应减少,这说明CCK可以作为一种重要的功能神经递质,激活外周组织中的苦味神经纤维。相反,TAS2R的激动剂如苯硫脲,也可以激动肠内分泌细胞上的TAS2R38,刺激CCK的释放[16]。
实验结果提示,TAS2R除了影响胃肠动力及胃肠激素的分泌,也参与了组织的病理改变。有报道[17-18]称,苯甲地那铵可以破坏鸡的空肠上皮形态并诱导与TAS2R相关的细胞凋亡/自噬。TAS2R相关的下游通路如PLCβ-PKC可以通过调节促炎细胞因子的产生来增强结肠炎的进展[19]。
2019年發表在PNAS上的一篇文章发现寄生虫感染可以激活肠道簇状细胞中TAS2R介导的信号通路,在这一过程中苦味受体家族有8个亚型出现了明显上调趋势,有8个亚型出现了显著下调趋势[20]。在本研究中,我们基于TAS2R38初步探索了黄连“苦寒败胃”的生物学基础,其深入的机制仍需进一步挖掘。
参考文献
[1] YUE X, LIANG J, GU F,et al. Berberine activates bitter taste responses of enteroendocrine STC-1 cells[J]. Molecular And Cellular Biochemistry, 2018, 10: 447.
[2] AVAU B, ROTONDO A, THIJS T, et al. Targeting extra-oral bitter taste receptors modulates gastrointestinal motility with effects on satiation[J]. Scientific Reports, 2015, 5: 15985.
[3] LISZT K I,LEY J P,LIEDER B,et al. Caffeine induces gastric acid secretion via bitter taste signaling in gastric parietal cells[J]. Proceedings of the National Academy of Sciences, 2017, 114(30): E6260-E6269.
[4] CAREY R M, LEE R J. Taste receptors in upper airway innate immunity[J]. Nutrients, 2019, 11(9): 167-179.
[5] ZAGORCHEV P, PETKOV G V, GAGOV H S. Bitter taste receptors as regulators of abdominal muscles contraction[J]. Physiological Research, 2019, 68(6): 991-995.
[6] GRASSIN-DELYLE S, SALVATOR H, MANTOV N, et al. Bitter taste receptors (TAS2Rs) in human lung macrophages: Receptor expression and inhibitory effects of TAS2R agonists[J]. Frontiers in Physiology, 2019, 10: 1267.
[7] LU P, ZHANG C H, LIFSHITZ L M, et al. Extraoral bitter taste receptors in health and disease[J]. The Journal of General Physiology, 2017, 149(2): 181-197.
[8] SHAW L, MANSFIELD C, COLQUITT L, et al. Personalized expression of bitter taste receptors in human skin[J]. PlosOne, 2018, 13(10): e0205322.
[9] PRANDI S, VOIGT A, MEYERHOF W, et al. Expression profiling of Tas2r genes reveals a complex pattern along the mouse GI tract and the presence of Tas2r131 in a subset of intestinal Paneth cells[J]. Cellular and Molecular Life Sciences, 2018, 75(1): 49-65.
[10] WU S V, CHEN M C, ROZENGURT E. Genomic organization, expression, and function of bitter taste receptors (T2R) in mouse and rat[J]. Physiological Genomics, 2005, 22(2): 139-149.
[11] ROPER S D, CHAUDHARI N. Taste buds: Cells, signals and synapses[J]. Nature Reviews Neuroscience, 2017, 18(8): 485-497.
[12] GLENDINNING J I. Is the bitter rejection response always adaptive?[J]. Physiology & Behavior, 1994, 56(6): 1217-1227.
[13] MEYERHOF W, BATRAM C, KUHN C, et al. The molecular receptive ranges of human TAS2R bitter taste receptors[J]. Chemical Senses, 2010, 35(2): 157-170.
[14] JANSSEN S, LAERMANS J, VERHULST P J, et al. Bitter taste receptors and α-gustducin regulate the secretion of ghrelin with functional effects on food intake and gastric emptying[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(5): 2094-2099.
[15] YOSHIDA R, SHIN M, YASUMATSU K, et al. The role of cholecystokinin in peripheral taste signaling in mice[J]. Frontiers in Physiology, 2017, 8: 866.
[16] JEON T I, SEO Y K, OSBORNE T F. Gut bitter taste receptor signalling induces ABCB1 through a mechanism involving CCK[J]. The Biochemical Journal, 2011, 438(1): 33-37.
[17] JIANG J, LV Z, QI L, et al. Denatonium as a bitter taste receptor agonist damages jejunal epithelial cells of yellow-feathered chickens via inducing apoptosis[J]. Animals, 2020, 14(6): 1223-1233.
[18] HAMDARD E, SHI Z C, LV Z, et al. Denatonium benzoate-induces oxidative stress in the heart and kidney of Chinese fast yellow chickens by regulating apoptosis, autophagy, antioxidative activities and bitter taste receptor gene expressions[J]. Animals, 2019, 9(9): 701.
[19] ZHOU J F, LAI W M, YANG W J, et al. BLT1 in dendritic cells promotes Th1/Th17 differentiation and its deficiency ameliorates TNBS-induced colitis[J]. Cellular & Molecular Immunology, 2018, 15(12): 1047-1056.
[20] LUO X C, CHEN Z H, XUE J B, et al. Infection by the parasitic helminth Trichinella spiralis activates a Tas2r-mediated signaling pathway in intestinal tuft cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(12): 5564-5569.
