烟草NtMYB59基因克隆及过表达对绿原酸含量的影响
2021-05-26赵利杰刘萍萍谢小东张剑锋罗朝鹏武明珠
王 中,赵利杰,刘萍萍,郑 美,谢小东,王 晨,张剑锋,罗朝鹏,杨 军,武明珠*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001 2.湖南省烟草公司郴州市公司,湖南省郴州市北湖区燕泉北路 423000
绿原酸(Chlorogenic acid),又名咖啡单宁,是植物在有氧呼吸过程中经苯丙氨酸途径合成的一种苯丙素类物质[1-2]。茄科作物多酚类物质中绿原酸含量最高,占多酚总含量的80%[3]。烟叶中含有3%~5%的绿原酸,绿原酸是烟草中仅有的单宁类物质,也是烟叶中含量最高的多酚类化合物,约占多酚总量的70%~90%[4-5]。绿原酸不仅影响烟草的生长发育,对烟叶香吃味、调制特性及色泽等也有重要影响[6]。由于烟草中多酚类物质挥发性低,分解后能进入烟气,因此对烟气香味有直接影响[7]。另外,多酚类物质与烟气含水率呈负相关[8]。烟叶中棕色素的成分主要是绿原酸和蛋白质,所以烟叶色泽和绿原酸含量密切相关[9]。
MYB转录因子被认为是植物转录因子中最大的一类转录因子,在拟南芥中MYB转录因子占转录因子总数的10.4%[10]。MYB转录因子具有高度保守的DNA结合结构域(MYB结构域),MYB转录因子的二级和三级结构域通常具有三螺旋结构,并且在第二和第三螺旋之间通过转角连接形成典型的螺旋-转角-螺旋结构(helix-coilhelix)[11]。有研究认为,第二个和第三个螺旋分别参与DNA的结合与识别,而第一个螺旋没有明确的结构意义[12-13]。根据MYB结构域数量,将其分为R1/R2-MYB、R2R3-MYB、3R-MYB和4R-MYB 4种类型[14],其中R2R3-MYB是植物中最重要也是含量最多的一类MYB转录因子。由于R2R3-MYB转录因子的DNA结合域和转录调控区域的多样性和特异性,其功能也具有多样性[14]。R2R3-MYB广泛参与植物生长发育过程,包括次生代谢物调控、细胞分化与形态建成及细胞信号转导等。也有研究发现MYB转录因子在植物应对生物与非生物胁迫中也具有重要作用[15]。MYB类的转录因子参与绿原酸的合成调控,过表达拟南芥MYB12转录因子的转基因番茄绿原酸含量提高2倍[16]。在烟草中过表达拟南芥MYB111转录因子基因,转基因烟草绿原酸含量提高4.5倍[17]。金鱼草转录因子AmMYB308和AmMYB330转入烟草中可抑制烟草绿原酸等多酚类物质的合成[18]。与一些需要同其他转录因子结合才能产生调控作用的转录因子(如Bhlh、WD40)不同,MYB家族转录因子可直接调控基因的表达[18]。但目前烟草中调控绿原酸的转录因子研究报道还较少,因此研究调控绿原酸的转录因子对于调控烟草中绿原酸含量有着重要意义。本课题组前期利用烟草全基因组表达谱芯片分析正常生长条件下烟草全生育期、全组织的基因表达谱以及不同生物或非生物胁迫条件下烟草基因组的表达谱数据,对已知绿原酸合成相关基因与所有烟草转录因子的进行共表达分析,发现其中NtMYB59转录因子基因表达量与绿原酸合成基因表达量呈正相关。通过同源克隆方法得到了NtMYB59基因,并对该基因进行了生物信息学分析和组织表达特异性表达分析,以及过表达该基因烟草的绿原酸含量检测,旨在为全面解析植物绿原酸合成调控途径提供依据。
1 材料与方法
1.1 烟草材料
供试烟草(Nicotiana tabacum)K326种子经体积分数10%NaClO消毒后,播种于MS培养基上,置于恒温光照培养箱中[温度(25±1)℃,光照强度2 000 lx],长至2~3片真叶时采集整株幼苗用于基因克隆[19]。同时采集种植于光照培养箱中的K326和过表达NtMYB59基因的转基因烟草植株旺长期的第5叶位叶片用于检测绿原酸含量(质量分数)。
田间试验设置在湖南郴州桂阳县烟草基地。供试品种K326,烟苗长至5片真叶时移栽,采集盛花期不同部位的烟草组织,包括根、茎、不同叶位的叶片(第5、第10和第15叶位叶片)、腋芽及花等,样品采集后置于液氮速冻,超低温冰箱(-80℃)保存备用。
1.2 烟草总RNA的提取及cDNA合成
分别采用北京密码子生物科技有限公司的ExProRNA提取试剂盒和[宝生物工程(大连)有限公司]的PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒进行RNA提取及cDNA反转录,具体实验步骤参照试剂盒说明书。
1.3 烟草NtMYB59基因全长克隆
根 据NCBI(https://www.ncbi.nlm.nih.gov/)数据库中检索得到的拟南芥AtMYB59基因的CDS序列,在中国烟草基因组数据库(www.tobaccodb.org)中进行Blast比对分析,并使用Primer Premier6软件对Blast结果中相似性最高的基因序列设计引物,上游引物NtMYB59-F:5'-ATGGTGCAAGAGG AAATCAGAAGAGGT-3',下游引物NtMYB59-R:5'-CCGAAAGTTACTCCAGTCAAAATC-3',PCR引物由北京六合华大基因科技有限公司合成。PCR反应体系:10μLPremixTaq、上下游引物各1μL、2 μL cDNA、最后用ddH2O补至20µL。PCR程序:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸60 s,共30次循环;72℃延伸10 min。
取3μLPCR扩增产物用琼脂糖凝胶(质量体积分数1.5%)电泳进行检测,并使用[宝生物工程(大连)有限公司]的DNA纯化回收试剂盒对目的片段进行切胶回收,具体实验步骤参照试剂盒说明书。纯化回收得到的目的片段连接到pMD19-T载体[宝生物工程(大连)有限公司]上,转化大肠杆菌感受态细胞DH5α,以培养皿平板上的菌斑为模板进行PCR阳性克隆验证,同时对菌斑进行扩繁。验证为阳性的菌液由北京六合华大基因科技有限公司进行测序。
1.4 烟草NtMYB59基因及编码蛋白生物信息学分析
使用Expasy在线软件(https://web.expasy.org/translate/)将NtMYB59基因序列翻译成氨基酸序列;使用NCBI数据库的Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具分析核酸及氨基酸序列的同源性;使用DNAMAN软件进行氨基酸序列多重比对分析;使用ProtParam(http://web.expasy.org/protparam/)在线软件分析NtMYB59蛋白的理论分子量、等电点及各种氨基酸含量;使用Protscale(https://web.expasy.org/protscale/)在 线 软件分析NtMYB59蛋白的亲水性及疏水性;使用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)在线软件预测NtMYB59蛋白是否有信号肽;NtMYB59蛋白的细胞定位分析使用PSORT(https://www.genscript.com/psort.html)在线软件;使用Pfam(http://pfam.xfam.org/search/sequence)在线分析软件预测蛋白的保守结构域;二级结构预测使用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)软件;三级结构预测使用SWISS-MODEL(http://swissmodel.expasy.org/)软件;采用邻接法(Neighbor-joining,NJ)构建系统进化树。
1.5 烟草NtMYB59基因表达分析
采用实时荧光定量PCR技术分析NtMYB59基因在烟株盛花期不同组织中的相对表达量。荧光定量PCR引物根据基因克隆得到的NtMYB59基因序列设计,上游引物NtMYB59-q-F:5'-TGGGTTAAT TACTTGAATCCTGATCTC-3',下游引物NtMYB59-q-R:5'-CAGTTCGCCCTGGTATTTTTCGT-3';内参基因选用烟草L25基因,上游引物L25-q-F:5'-CCCCTCACCACAGAGTCTGC-3',下游引物L25-q-R:5'-AAGGGTGTTGTTGTCCTCAATCTT-3'。所用实时荧光定量PCR仪为美国伯乐公司的Bio-Rad CFX96,所用试剂SYBR Premix ExTaqTM为宝生物工程(大连)有限公司产品。定量PCR反应体系20μL:10μL SYBR Premix Ex TaqTM,cDNA 2μL,上、下游引物各1μL,ddH2O 6μL。PCR程序:94℃预变性30 s;94℃变性5 s,60℃退火20 s,72℃延伸20 s,45个循环。基因相对表达量的计算采用2-ΔΔCT方法[20]。以烟株盛花期茎节的相对表达量为对照(设定为1),基因的相对表达量为该基因在其他组织中的表达量与对照的比值。
1.6 烟草绿原酸含量测定
取50 mg冷冻保存的烟叶样品,于液氮中研磨成粉末。转入1.5 mL预冷的V(甲醇)∶V(水)=4∶1提取液中,常温下超声30 min,4℃下静置12 h;然后在4℃,20 000 r/min条件下离心10 min,取上清液。提取的上清液用超高效液相-三重四极杆质谱联用仪(安捷伦科技有限公司)测定绿原酸含量。分析条件:色谱柱ACQUITY uplc HSS T3(2.1×50 mm,1.8µm),3µL,流速0.4 mL/min,流动相A为体积分数0.1%甲酸水溶液,B为体积分数0.1%甲酸的甲醇溶液。梯度洗脱:0 min,5%B;1 min,60%B;3 min,70%B;3.01 min,95%B;4 min,95%B;4.01 min,5%B;5 min,5%B。
2 结果与分析
2.1 烟草NtMYB59基因克隆
以烟草整株幼苗(2~3片真叶)的cDNA为模板,经由设计的特异基因克隆引物进行PCR扩增。通过琼脂糖凝胶电泳检测PCR扩增产物,发现PCR产物条带长度约为700 bp左右,见图1。PCR产物经过切胶回收及纯化后连接克隆载体并测序,测序得到的基因序列全长为666 bp,共编码221个氨基酸。
2.2 烟草NtMYB59基因及编码蛋白的生物信息学分析
NtMYB59基因核苷酸序列与其他物种的MYB59基因核苷酸序列相似性较低,与拟南芥、玉米、丹参及苹果的相似性分别为52.06%、52.84%、51.49%和37.83%。但通过DNAMAN软件对烟草(NtMYB59)、拟南芥(AtMYB59)、玉米(ZmMYB59)、可可树(TcMYB59)等物种的MYB59蛋白序列进行比对发现,不同物种的MYB59蛋白序列相似性较高,特别在C端的相似性更高,且从烟草中得到的NtMYB59基因的保守结构域具有DNA结合域螺旋-转角-螺旋的特征,见图2。因此,将该基因命名为NtMYB59。
用MEGA 7.0软件对NtMYB59和不同物种MYB59氨基酸序列进行比对并构建系统进化树,结果表明NtMYB59与玉米(Zea mays)在亲缘关系上较为接近,在进化上属于同一分支,见图3。
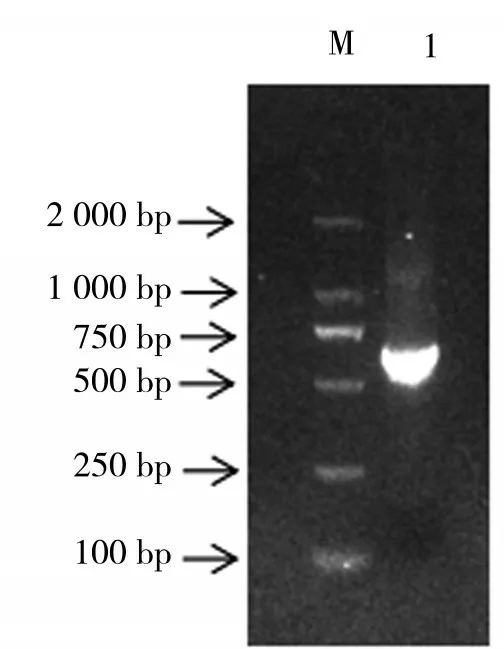
图1 NtMYB59基因的PCR电泳图Fig.1 PCR electrophoretogram of NtMYB59 gene
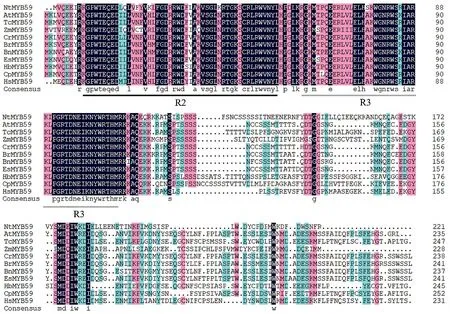
图2 烟草NtMYB59蛋白与其他植物MYB59蛋白序列比对Fig.2 Sequence alignment of tobacco NtMYB59 protein and MYB59 protein of other plants
分析发现,NtMYB59蛋白预测分子量为26.26 kDa,等电点为8.33。有35个带负电荷的氨基酸(Asp+Glu)和37个带正电荷的氨基酸(Arg+Lys)。其在酵母体内的半衰期大于20 h,在大肠杆菌体内大于10 h,蛋白的不稳定系数为64.90%,预测为不稳定蛋白。该蛋白疏水性绝对值最大为0.937,亲水性最大为1.778,亲水区域大于疏水区域,推测其为亲水性蛋白。分析发现该蛋白没有信号肽,不是分泌型蛋白,且定位于细胞核中。
通过蛋白的二级结构预测(图4)发现,NtMYB59蛋白的二级结构主要由无规则卷曲(Coil)和螺旋(Helix)组成,具有典型的螺旋-转角-螺旋构象,这与MYB转录因子家族的蛋白二级结构特征相符。用Pfam预测NtMYB59的保守结构域,发现该蛋白在8~55和61~106区段含有两个Myb_DNA-结合保守结构域。SWISS-MODEL预测NtMYB59蛋白的三级结构(图5),预测得到的三级结构符合R2R3-MYB蛋白的结构特征,进一步证明了NtMYB59蛋白属于MYB基因家族。
2.3 烟草不同组织部位NtMYB59基因表达分析
通过分析NtMYB59基因在烟草盛花期不同组织中的表达,发现NtMYB59基因在不同叶位的叶片、侧根、须根以及花中的表达量较高,在茎秆、茎节、腋芽以及花蕾中的表达量较低,见图6。说明NtMYB59基因表达具有组织差异性。
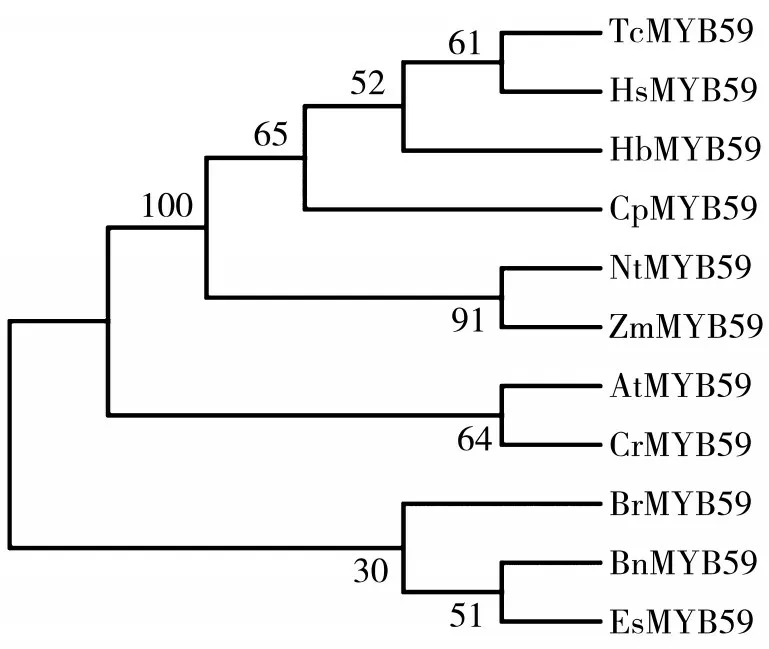
图3 植物MYB59转录因子氨基酸序列进化树Fig.3 Evolutionary tree of plant MYB59 transcription factor
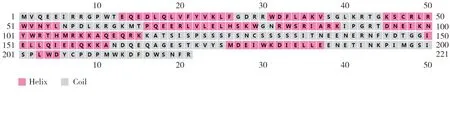
图4 NtMYB59蛋白二级结构预测Fig.4 Predicted secondary structure of NtMYB59 protein
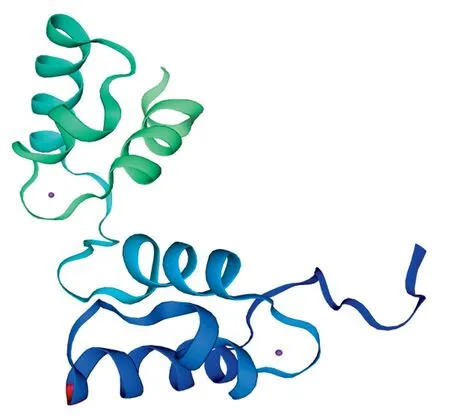
图5 NtMYB59蛋白三级结构预测Fig.5 Predicted tertiary structure of NtMYB59 protein
2.4 在烟草中过表达NtMYB59基因对绿原酸含量的影响
NtMYB59基因序列克隆测序完成后,构建该基因的过表达载体,并用叶盘法转化烟草K326品种。通过测定烟草旺长期T2代阳性转基因植株(OE-1、OE-2、OE-3、OE-4和OE-5)第5叶位的叶片绿原酸含量,发现转基因植株叶片中绿原酸含量显著上升,5个独立转化株与对照(K326)相比绿原酸含量分别增加43.4%、28.3%、19.5%、62.9%和55.7%(图7),说明NtMYB59基因对绿原酸合成具有调控作用。
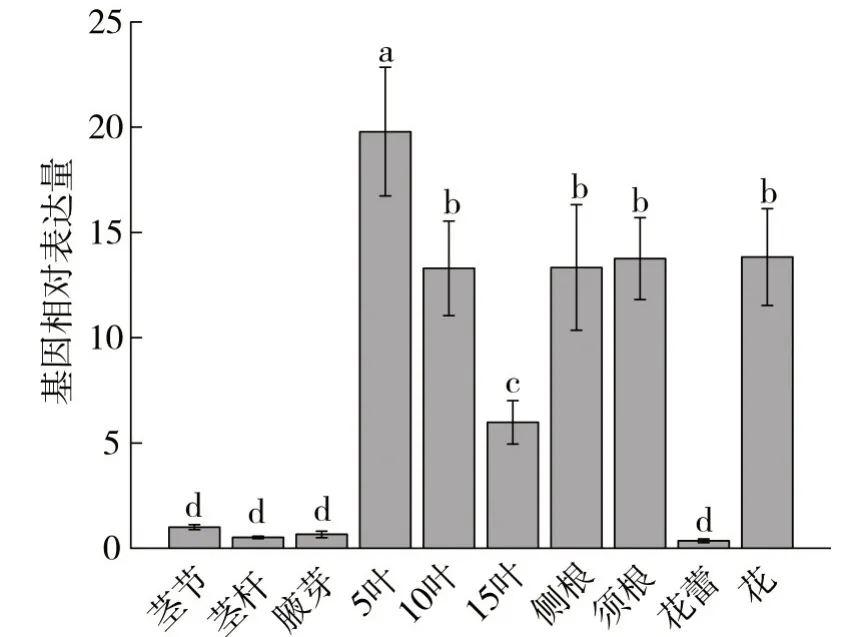
图6 NtMYB59基因在烟草盛花期不同组织中的表达Fig.6 Expression of NtMYB59 gene in different tissues at full flowering stage of tobacco
3 讨论
目前在植物中已经鉴定出多个MYB转录因子基因,在拟南芥中的研究发现MYB转录因子参与了花青素的生物合成,以及绿原酸、类黄酮代谢及植物次生细胞壁的形成等多种次生代谢过程[16,21-22]。本试验中采用基因同源克隆方法从普通烟草K326中克隆得到一个MYB转录因子基因,命名为NtMYB59。蛋白的二级结构预测结果表明NtMYB59蛋白具有MYB转录因子典型的螺旋-转角-螺旋构象,用Pfam预测NtMYB59的保守结构域,发现该蛋白在8~55和61~106区段含有两个Myb_DNA-结合保守结构域,这两个结构域可能与DNA的识别与结合有关,这与前人报道的R2R3-MYB转录因子的结构特征相一致[23]。
NtMYB59的基因表达具有组织特异性,在叶片、侧根、须根以及花中的表达量比较高,在茎秆、茎节以及花蕾中的表达量比较低。在对小麦MYB转录因子的研究中发现,TaMYB59基因在其根中的表达量也较高,与烟草NtMYB59不同的是其在叶片中表达量相对较低[24];在菊花中的研究发现菊花的CmMYB59基因在根及叶中的表达量最高[25],但是菊花CmMYB59与烟草NtMYB59不同,在茎中的表达量也比较高,说明MYB59基因在植物的生长发育过程中的表达模式有一定的相似性,但也存在差异性,MYB59基因在不同的物种中调控功能可能存在差异。
通过测定转NtMYB59基因烟草T2代植株叶片中的绿原酸含量发现,过表达NtMYB59基因烟草中的绿原酸含量显著提高。这与本课题组通过基因芯片大数据分析预测的NtMYB59基因参与调控绿原酸合成基因的结果相一致。绿原酸和植物的抗逆性密切相关,过表达拟南芥MYB12转录因子不仅增加了绿原酸含量,还增加了拟南芥抵御干旱及氧化胁迫的能力[26]。烟草中过表达NtMYB59基因能否增加烟草的抗逆性及其调控机制还需进一步研究。
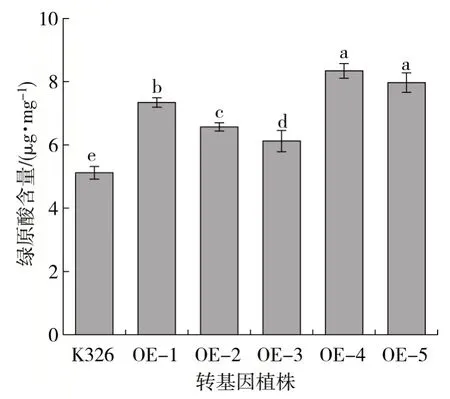
图7 过表达NtMYB59基因对绿原酸含量的影响Fig.7 Effects of over expression of NtMYB59 gene on chlorogenic acid content
4 结论
通过同源克隆方法从烟草中克隆获得1个MYB转录因子基因,并通过生物信息学方法对该基因和基因编码的蛋白进行分析,并将该基因命名为NtMYB59。通过分析NtMYB59基因在烟草不同组织中的表达发现,该基因在烟株第5叶位叶片中的表达量最高。通过测定过表达NtMYB59基因烟草中的绿原酸含量发现,在烟草中过表达NtMYB59基因可显著的提高烟草叶片中的绿原酸含量,说明NtMYB59基因能够调控烟草中的绿原酸合成。
