采用室内质量控制和室间质评数据评定肿瘤标志物检验项目的测量不确定度
2021-05-26秦妍妍杨延敏
秦妍妍,杨延敏
北京丰台医院检验科,北京 100070
测量不确定度(measurement uncertainty,MU)是表征赋予被测量量值分散性的非负参数[1],是对测量结果质量的定量表征。MU在实验室主要被用于提高检验结果质量、选择可靠检测程序及帮助临床改进对患者结果的解释与应用、将报告测量量值与医学参考值或临床决定限进行比较或同一患者的前、后两次测量量值比较[2]。很多国际组织机构,如国际标准化组织(International Organization for Standardization,ISO)[3],国际临床化学与检验医学联合会(International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)[4]、国际实验室认可合作组织(International Laboratory Accreditation Cooperation,ILAC)[5]要求评定测量不确定度。ISO15189:2012《医学实验室-质量和能力的具体要求》[3]认可明确规定测量不确定度的估计值可能包括确认患者的数值符合实验室设定的质量目标,以及将患者检测值与先前同类数值或临床决定限值进行有意义的比较,明确指出,报告临床结果时,医学实验室应确定每个测量程序的MU 及性能要求,当操作者、仪器设备或试剂发生变化时,实验室应定期评估和审查MU并更新。ISO已被等同转换为国家标准GB/T22576[6],这使我国临床检验人员必须要面对检验结果不确定度的问题。中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)颁布的《医学实验室——测量不确定度的评定与表达》的技术报告[7],介绍了“自上而下(top-down)”的评定方法,从不精密度和偏移两个方面评定不确定度。其中,评定不精密度引入的不确定度多使用室内质量控制(internal quality control,IQC)数据,评定偏移引入的测量不确定度多使用与有证参考物质(certified reference material,CRM)进行比较、应用室间质量评价(external quality assurance,EQA)数据及与参考测量方法比较。目前,在常规临床医学实验室实际工作中,肿瘤标志物检验项目的CRM成本高昂且较难获取,参考测量程序要求高且方法复杂,一般常规临床医学实验室无法建立相应的参考测量程序,而EQA 数据较易得到,可反映医学实验室的正确度,且更能用于评价该实验室较长时间跨度的常规工作[8-9]。
目前由于MU 评定方法不统一,缺少一致化的MU 评价标准等问题,限制了其在医学检验临床实践中的应用。此外,由于在医学检验科学中,定量检测项目MU 概念相对较新,因此医学检验人员在面对实验室认可、认证的要求时,无法准确有效评价和应用临床实验室的MU。本文尝试收集本实验室肿瘤标志物IQC数据和北京市临床检验中心肿瘤标志物EQA数据,采用top-down方法,评定肿瘤标志物检验项目MU,探讨利用实验室常规工作中易获取数据建立一种方便可行的MU评估方法;并与北京市临床检验中心EQA计划的的允许总误差(allowable total error,TEa)及基于生物学变异推导出的TEa[10-11]进行比较,以观察本实验室肿瘤标志物检验项目的检测水平。
1 材料与方法
1.1 仪器与试剂 雅培i2000化学发光免疫分析仪(美国雅培公司生产)及其配套试剂、校准品。
1.2 检测指标 甲胎蛋白(α-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125 (carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)、糖 类 抗 原199(carbohydrate antigen 199,CA199)、总前列腺特异性抗原(total prostate-specific antigen,t-PSA)、游离前列腺特异性抗原(free prostate specific antigen,f-PSA)共7项。
1.3 质控品与EQA样本 质控品购自美国伯乐公司(批号:54642)。质控品工作日每天测定1 次,收集2019 年7月1日至2019 年12 月31日在控数据,该时间段内各项质控品批号一致。EQA 样本由北京市临床检验中心提供,实验室在规定时间内以与测量患者样本相同的方式测量EQA样本,并将结果反馈到北京市临床检验中心网站。
1.4 数据来源
1.4.1 测量复现性引入的相对测量不确定度[urel(Rw)]分量评定 采用室内质量控制数据不精密度来表示。收集本实验室2019 年7~12 月共6 个月相同批次在控的室内质控数据,以确保考虑到由于不同操作员、试剂、试剂批号和仪器维护保养而引入的潜在变化,计算变异系数作为不精密度分量。
1.4.2 偏移引入的相对测量不确定度[ucrel(bias)]分量评定 收集本实验室参加北京市临床检验中心2017—2019年肿瘤标志物室间质量评价共计6次[7,12-14],质评成绩均100%合格。同时采纳EQA组织者给出的公认值Ccons,i、本实验室测量值xi、本组EQA数据得出的测量复现性RSDR,i和参加单次EQA的实验室数量m。由于每次EQA 的公认值很难一致,所以通过EQA 数据评定由偏移引入的测量不确定度时多采用相对值进行计算。
1.5 不确定度计算 收集本实验室IQC 数据和北京市临检中心EQA 数据,采用top-down 法进行测量不确定度的评定。
1.5.1 实验室内测量复现性引入的相对测量不确定度[urel(Rw)]评定 统计实验室连续6个月(1次/d),1 个浓度水平相同批号质控品室内质控数据,统计质控累积的均值、标准差和变异系数,依据公式(1)计算,其中CV(Rw)为批间变异系数,x为内室内质控数据的均值,S(Rw)为标准差。
1.5.2 偏移引入的相对测量不确定度urel(bias)评定 包括评估偏移时重复测量引入的不确定度[方法和实验室偏移,RMSrel(bias)]和评估偏移所使用方法本身的不确定度[urel(Cref)]。按照下列公式计算:(a)根据实测值和北京市临床检验中心提供的公认值,依据公式(2)计算每次EQA的相对偏移量值(brel,i),其中xi为实验室本身每次测量值,Ccos,i为每次EQA 的公认值。(b)计算方法和实验室相对偏移[RMSrel(bias)]:依据公式(3)计算,其中n为EQA 次数。(c) 计算单次EQA 公认值的测量复现性引入的相对测量不确定度[urel(cons,i)]:依据公式(4)计算,其中RSDR,i为单次EQA的相对测量复现性,m为参加单次EQA的实验室数量。(d)计算多次EQA 公认值的测量重复性引入的相对测量不确定度[urel(Cref)]:依据公式(5)计算,其中n为EQA 次数。(e)计算偏移引入的相对测量不确定度ucrel(bias):依据公式(6)计算。
1.5.3 相对合成标准不确定度评定(urel) 依据公式(7)计算。
1.5.4 相对扩展不确定度评定(urel) 依据公式(8)计算,对于95%置信水平,k=2。

1.6 目标不确定度的设定与比较 将计算的相对扩展不确定度分别与北京市临床检验中心室间质量评价允许总误差TEa、基于生物学变异推导出的TEa进行比较,以观察肿瘤标志物检验项目的检测水平。
1.7 统计学方法 采用Microsoft Excel 2010,计算测量不确定度和相关分量。
2 结果
2.1 实验室内测量复现性引入的相对测量不确定度 统计实验室2019年7~12月的肿瘤标志物1个浓度水平室内质控(同一批号)数据,使用不同批号的试剂进行检测,经多次校准、常规仪器维护、校准品批号改变等并由不同的实验室工作人员轮流操作,见表1。

表1 7项肿瘤标志物检验项目的相对实验室内测量复现性
2.2 偏移引入的不确定度
2.2.1 实验室和方法偏移 统计2017—2019 年的6次EQA 结果,记录与室内质控浓度接近样本的偏移,计算RMSrel(bias),见表2。
2.2.2 偏移所使用方法本身的不确定度 下载每次EQA 的能力验证报告,记录本室设备所在分组的实验室数(m)和单次EQA 的相对实验室内测量复现性(RSDR,i,%),计算urel(Cref),结果见表3。
2.3 相对合成标准不确定度和相对扩展不确定度 将上述不确定度分量进行合成,并与北京市临床检验中心室间质量评价TEa、基于生物学变异推导出的TEa进行比较,见表4。7项肿瘤标志物检验项目的相对扩展不确定度分别是AFP,11.9%;CEA,11.5%;CA125,11.8%;CA153,9.7%;CA199,9.80%;t-PSA,11.6%;f-PSA,15.9%(k=2)。7项检验指标均符合北京市临床检验中心室间质量评价TEa 要求;CEA、CA125、CA153、CA199、t-PSA的相对扩展不确定度符合基于生物学变异最佳的TEa 质量规范要求,AFP 的相对扩展不确定度未达到基于生物学变异最佳的TEa质量规范要求。

表2 7项肿瘤标志物检测项目的方法和实验室偏移
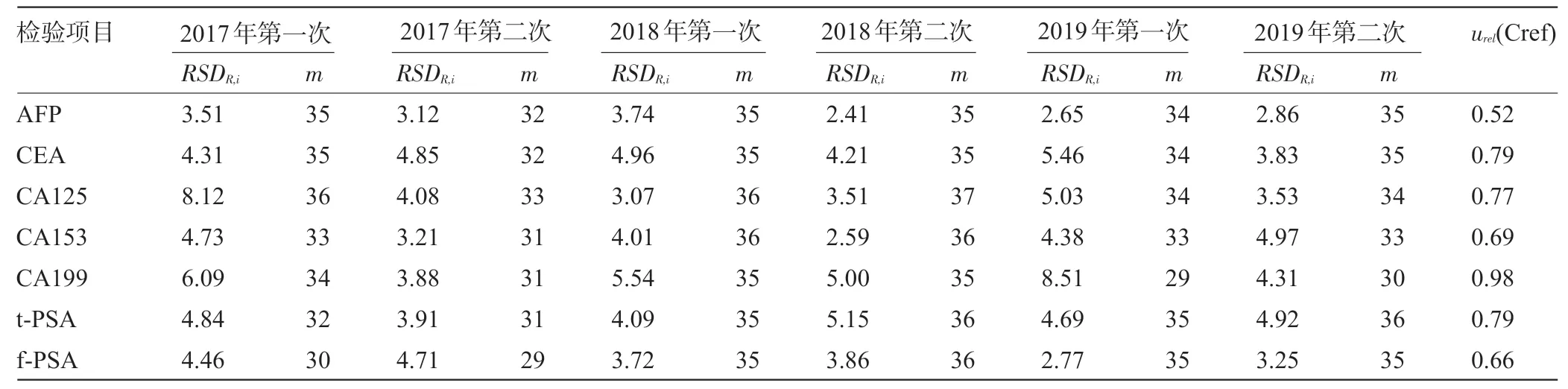
表3 7项肿瘤标志物检测项目的EQA公认值相对测量不确定度
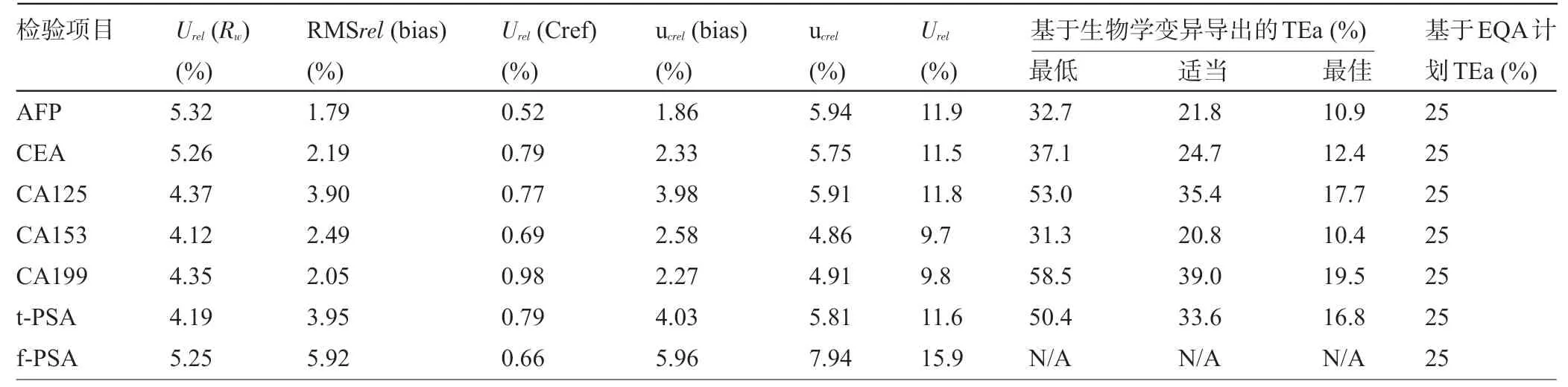
表4 7项肿瘤标志物检验项目的相对合成不确定度和相对扩展不确定度及其与不同质量规范TEa比较
3 讨论
在许多恶性肿瘤疾病中,肿瘤标志物检测在患者治疗和监测管理中发挥重要作用,为此对肿瘤标志物检验质量也提出了更高的要求。对医学实验室来说,如何正确认识和提高其测量质量是一个挑战,测量不确定度作为质量管理评价指标,为肿瘤标志物检验结果的准确性提供了良好的保障。
测量不确定度评定大致可分为“自下而上(bottom-up)”和“自上而下(top-down)”两种方法[15]。bottom-up 是基于对测量的全面、系统分析后,识別出每个可能的不确定度来源并加以评定,该方法已得到计量机构和标准物质供应商的认可,主要应用于执行参考测量程序的认证实验室和参考物质赋值中的不确定度评定,常规临床医学实验室应用较少。top-down方法是在控制不确定度来源或程序的前提下,评定每个测量值的不确定度,即运用统计学原理直接评定特定测量系统之受控结果的测量不确定度。通常通过质量控制数据和能力验证数据进行评定,主要考虑偏移的影响和实验室内的复现性,方法简便,适于常规临床医学实验室应用。有研究证实:在通常情况下,如果临床实验室测量结果不确定度的评估是正确的,两种方法的评估结果应非常相近,可以互换[16-17],这意味着临床实验室可以使用更简单的自上而下的方法来确定测量不确定。CNAS 技术报告也推荐使用top-down 方法,通过不精密度和偏移两个方面评定测量不确定度。童清等[18]使用top-down 方法,采用室内质控与能力验证数据,从实验室内复现性和偏移两个主要分量对北京市47 家三级医院检验科酶学项目测量不确定度进行评估;王尉等[19]使用top-down方法,采用北京市临床检验中心EQA 数据初步建立了北京地区常规凝血项目目标测量不确定度;国外PADOAN等[20]、MAGNUSSON 等[21]使用top-down 方法,采用室内质量控制数据和室间质量评价数据,评估生化部分项目不确定度。MEIJER等[22]提出测量不确定度可以通过EQA数据估计方法和实验室偏移。在这种情况下,实验室间比对的数据以与参考物质数据相同的方式使用(即估算偏移)。为了对实验室间比对数据的偏移有一个合理清晰的了解,实验室应在规定的时间段内至少参与6个批次实验室室间比对计划[12]。
本研究采用top-down法对本实验室7项肿瘤标志物检验项目评定其测量不确定度,评定过程相对简单,数据易得。不精密度来源于室内质控数据,这些数据来自常规临床医学实验室一段较长期间(通常6个月或更长时间)的日常工作,包含了各种影响因素(不同批号试剂、不同批号校准品、多次校准、不同操作者、仪器维护等分量),这样评估的测量不确定度能够客观、准确地反映本实验室实际测量结果。该方法实用、简便,只要开展了IQC的项目,就可用此方法评定不精密度引入的不确定度。在评定偏移引入的不确定度时,应用了本室最近3 年共6 批次室间质量评价成绩合格的EQA 数据,选取的数据跨越了较长的时间,EQA结果又足够可信,数据也易获得,所需的计算是直接的,不增加实验室工作量,相比于购买昂贵的CRM 或被测量尚无法计量溯源到公认的参考系统的项目进行测量不确定度评定而言,这不失是一种既经济又实用的方法。重要的是,常规临床医学实验室可以独立计算测量不确定度。并且,随着参与时间、参与频次的增加,使用EQA数据持续更新实验室测量不确定度的数据,可以作为定期评定的方法,具有良好的临床应用前景。
本研究将评定相对扩展不确定度分别与北京市临床检验中心室间质量评价TEa、基于生物学变异推导出的TEa进行比较,从表4结果可知,在目前的实验条件和方法下,7 项肿瘤标志物检验指标均符合北京市临床检验中心室间质量评价TEa要求,多数肿瘤标志物检测指标均能达到基于生物学变异最佳的TEa的质量规范要求。北京市临床检验中心室间质量评价TEa 具有广泛的接受度,通常室间质量评价计划设置的最低目标是使大多数实验室均能通过,从而鉴别少数质量不能达到最基本要求的实验室或测试项目,因此多数实验室能够通过室间质量评价计划,但并不很关注所选测试项目的的具体检测性能。北京市临床检验中心每年发放2~3 次质评样本,基于测量不确定度的结果可用来常规监测实验室检测质量。而基于生物学变异的目标更具有实用性,可以更全面客观地了解各实验室的检测水平,特别是有助于进一步区分免疫项目的检测性能。本实验室AFP 的相对扩展不确定度未达到基于生物学变异最佳的TEa质量规范要求,进一步分析其不确定度各分量贡献的大小,主要原因为不精密度,要减小本实验室AFP 扩展不确定度,可通过进一步提高AFP 的不精密度来实现,可采取如下措施:加强仪器定期维护和保养、规范校准品及质控品的复溶和分装保存、严控试剂机载时间、规范操作流程,加强人员培训等。同时也提示临床实验室可根据自己目前实际情况,评估自身能达到的质量水平,为实验室设置合适的质量评价目标,结合不确定度评定指导实验室的质量管理与持续改进。
综上所述,应用top-down,结合实验室室内质量控制数据和室间质量评价数据,评定临床实验室肿瘤标志物检验结果的测量不确定度是一种简单易行的方法,适用于常规临床医学实验室,对促进临床实验室标准化管理,提高临床检验质量有重要指导意义。
