沉默Orai1通过调控内质网应激抑制急性脑梗死大鼠海马神经元凋亡①
2021-05-25文远超
李 航 熊 波 文远超 张 刚
(遵义市第一人民医院,遵义医科大学第三附属医院神经外科,遵义563000)
脑梗死(cerebral infarction,CI)又称缺血性卒中(cerebral ischemic stroke,CIS),是导致老龄人群致残和死亡的重要原因。一旦发生缺血,数小时甚至数分钟内就会发生序惯性脑损伤,使细胞内外能量代谢平衡被打破,相关区域的血管单元功能受到影响,导致神经元细胞被损害。有研究显示,内质网是Ca2+在细胞内储存的主要场所,脑缺血后短时间内会造成细胞内钙超载,使内质网的生理功能紊乱,引发内质网应激(endoplasmic reticulum stress,ERS)[1-2]。ERS发生时原本存在于内质网上的Ca2+大量转移到细胞浆,在此过程中会使钙依赖相关的降解酶被激活而使细胞膜结构破坏,最终造成细胞凋亡的发生[3]。有研究表明,钙释放激活钙通道调节分子1(calcium release-activated calcium modulator 1,Orai1)缺失介导的Ca2+内流障碍对急性CIS有神经保护作用,但其具体机制不详[4]。同时也有研究表明,在细胞静息状态下,STIM1和Orai1蛋白分别分布于内质网和细胞膜上,但当细胞内钙库耗竭时,二者在内质网-细胞膜结构上形成功能性钙离子释放激活钙通道(Ca2+release-activated calcium chan⁃nel,CRAC),促使细胞外内流Ca2+,导致细胞内钙超载,引起内质网应激并介导神经元凋亡[5]。本研究拟通过注射Orai1干扰慢病毒下调急性CI大鼠脑缺血区组织中Orai1基因表达,观察其对脑神经功能的保护作用,探讨其可能作用机制,为心脑血管疾病防治提供新的思路和方法。
1 材料与方法
1.1 材料 无特定病原体(SPF)级雄性SD大鼠60只,鼠龄6~7周,体重(220±20)g,由湖北省动物实验中心提供,动物合格证编号:SCXK(鄂)2018-0031。温度为24℃,湿度为50%,通风良好,明暗光照交替12 h,标准饲料喂养,自由进食及饮水。2,3,5-三苯基氯化四氮唑(TTC,货号T8877)购自美国Sigma公司;实时定量PCR试剂盒、Furo-3/AM、BCA试剂盒和TUNEL凋亡检测试剂盒购自美国Thermo Fisher公司;Orai1、间质相互作用分子1(STIM1)、Cleaved-Caspase-3、Bax、Bcl-2、同源蛋白(CHOP)、葡萄糖调节蛋白78(GRP78)、肌醇酶-1(IRE-1)、Caspase-12和GAPDH抗体均购自美国Cell Signaling Technology公司;HRP标记的羊抗兔或小鼠IgG抗体购自武汉博士德生物工程有限公司;Orai1慢病毒shRNA干扰质粒载体、阴性对照慢病毒质粒载体的构建以及慢病毒包装、浓缩和纯化均由汉恒生物科技(上海)有限公司完成,shRNA-Orai1特异性序列为F:5′-AGAAACACACTCTTTGGCAdTdT-3′;R:5′-AATGCT⁃GTCACCTCGCdTdT-3′。
1.2 方法
1.2.1 模型构建与分组处理 60只SPF级雄性SD大鼠,适应性饲养1周后,随机分成4组,即假手术组(sham)、模型组(model)、Orai1干扰组(shRNAOrai1)、阴性对照组(shRNA-NC),15只/组。腹腔注射2%戊巴比妥钠麻醉后,采用改良Longa线栓法制作急性CI大鼠模型[6]。术前24 h,shRNA-Orai1组和shRNA-NC组大鼠采用立体定位经侧脑室(前囟后1 mm,旁开1.5 mm,深3.5 mm)分别注射0.2 ml Orai1 shRNA干扰慢病毒(shRNA-Orai1)溶液及其阴性对照慢病毒(shRNA-NC)溶液,注射过程中保持缓慢、匀速并及时关注大鼠呼吸节律以避免产生脑疝,慢病毒滴度为2×108TU/ml,sham组和model组大鼠分别注射等量生理盐水。
1.2.2 神经功能缺损评分 各组大鼠于造模24 h后,采用Zea-Longa五级评分法评估神经功能[7],评分越高代表神经功能损伤越严重,具体评分标准:0分,状态正常;1分,轻度神经功能缺失,不能完全伸展左前肢;2分,中度神经功能缺失,向左侧转圈;3分,中度神经功能缺失,向左侧倾倒;4分,无意识,不能自发行走。
1.2.3 TTC法评估大鼠脑梗死面积 造模24 h后,在每组随机挑选5只大鼠处死并取脑,剔除小脑和低位脑干后迅速放入-20℃冰箱,20 min后取出并切片,保持切片厚度为2~3µm,随后使用2%TTC液染色,37℃避光染色25 min后可观察到梗死区域呈白色。拍照并使用ImagePro Plus 6图像分析软件计算CI百分比。CI面积百分比(%)=CI组织总面积/脑组织面积×100%。
1.2.4 荧光探针法检测大鼠海马组织内Ca2+浓度 造模24 h后,断头处死,取脑并分离出海马,将海马剪成浆状后使用胰酶消化制备成单细胞悬液,然后用Furo-3/AM荧光探针(4 mol/L)负载45 min,最后使用荧光分光光度计检测细胞内Ca2+浓度[8]。
1.2.5 TUNEL染色检测大鼠海马组织神经元凋亡 造模24 h后,断头处死取脑,剥离大鼠大脑并分离出海马组织,洗净后用10%甲醛固定24 h后脱水处理,常规石蜡包埋,制作3~4µm石蜡切片,采用脱氧核糖核酸末端转移酶介导的缺口末端标记法(TU⁃NEL)标记凋亡的神经元。海马CA1区神经元呈线型紧密有序排列,且细胞核明显,细胞体积偏大,显微镜下观察并统计神经元凋亡细胞数。神经细胞凋亡率(%)=TUNEL阳性细胞数/总细胞数×100%
1.2.6 qRT-PCR检测大鼠海马组织中Orai1的mRNA表达 收集各组大鼠海马组织,按照Trizol试剂盒说明书提取样本总RNA,紫外分光光度计检测总RNA浓度。用逆转录试剂盒将RNA逆转为cD⁃NA,并以cDNA为模板进行qRT-PCR扩增。Orai1引物序列,F:5′-TGGCCGTGCACCTGTTC-3′,R:5′-TTGCTCACAGCCTCGATGTT-3′;GAPDH引 物 序列,F:5′-TCCACCACCCTGTTGCTGTAG-3′,R:5′-CCACAGTCCGCCATCACT-3′。反应条件为95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸45 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算Orai1的mRNA相对表达量。
1.2.7 Western blot检测大鼠海马组织中相关蛋白表达 收集各组大鼠海马组织,加入适量RIPA裂解液,冰上充分裂解30 min,4℃条件下12 000 r/min离心20 min,收集上清,BCA法测定蛋白浓度。取20µg蛋白进行SDS-PAGE电泳分离蛋白,并将蛋白转移至PVDF膜,5%脱脂牛奶室温封闭30 min,分别加入一抗稀释液(Orai1、STIM1、Cleaved-Caspase-3、Bax、Bcl-2、CHOP、GRP78、IRE-1、Caspase-12、GAPDH,1:1 000),4℃孵育过夜。次日,洗膜后加入HRP标记的羊抗兔或小鼠IgG(1:20 000),室温孵育1 h,洗膜,滴加化学发光试剂,于暗室显影分析。以GAPDH为内参计算各蛋白相对表达量。
1.3 统计学分析 所有数据均采用SPSS22.0软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分 如图1所示,与sham组相比,model组大鼠神经功能评分升高(P<0.01);与model组和shRNA-NC组相比,shRNAOrai1组大鼠神经功能评分降低(P<0.01)。
2.2 各组大鼠CI面积 如图2所示,sham组大鼠无CI面积,其他各组大鼠均出现CI面积。与model组和shRNA-NC组相比,shRNA-Orai1组大鼠CI面积比例降低,差异有统计学意义(P<0.01)。
2.3 各组大鼠海马组织Ca2+浓度 如图3所示,与sham组相比,model组大鼠海马组织中Ca2+浓度升高,差异有统计学意义(P<0.01);与model组和shR⁃NA-NC组相比,shRNA-Orai1组大鼠海马组织中Ca2+浓度降低,差异有统计学意义(P<0.05)。

图1 各组大鼠神经功能缺损评分比较Fig.1 Comparison of neurological scores in each group
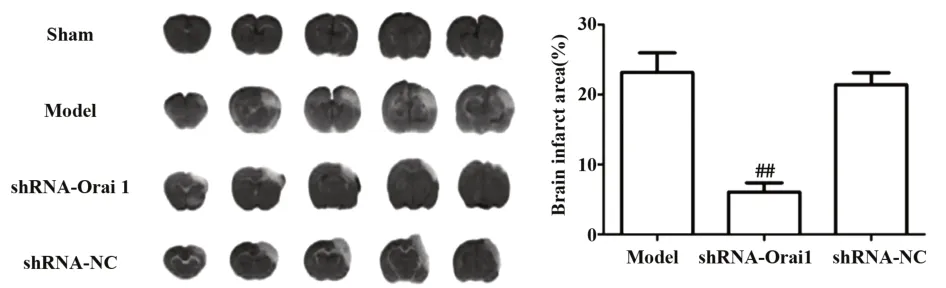
图2 各组大鼠脑梗死面积比较Fig.2 Comparison of brain infarct area in each group

图3 各组大鼠海马组织Ca2+浓度比较Fig.3 Comparison of Ca2+concentration in hippocampal tissues of rats in each group
2.4 各组大鼠海马神经元凋亡水平 如图4、5所示,与sham组相比,model组大鼠海马组织神经元凋亡率及凋亡蛋白Cleaved-Caspase-3和Bax表达水平均升高,抗凋亡蛋白Bcl-2表达水平降低,差异均有统计学意义(P<0.01);与model组和shRNA-NC组相比,shRNA-Orai1组大鼠海马组织神经元凋亡率及Cleaved-Caspase-3和Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高,差异均有统计学意义(P<0.01)。
2.5 各组大鼠海马组织中Orai1 mRNA及其蛋白表达 如图6所示,与sham组相比,model组大鼠海马组织中Orai1 mRNA及蛋白表达水平升高,差异有统计学意义(P<0.01);与model组和shRNA-NC组相比,shRNA-Orai1组大鼠海马组织中Orai1 mRNA及蛋白表达水平降低,差异有统计学意义(P<0.01)。
2.6 各组大鼠海马组织中STIM1蛋白表达 如图7所示,与sham组相比,model组大鼠海马组织中STIM1蛋白表达水平升高,差异有统计学意义(P<0.01);与model组和shRNA-NC组相比,shRNAOrai1组大鼠海马组织中STIM1蛋白表达水平降低,差异有统计学意义(P<0.01)。
2.7 各组大鼠海马组织中内质网应激相关蛋白CHOP、GRP78、IRE-1和Caspase-12表达 如图8所示,与sham组相比,model组大鼠海马组织中CHOP、GRP78、IRE-1和Caspase-12蛋白表达水平升高,差异有统计学意义(P<0.01);与model组和shR⁃NA-NC组相比,shRNA-Orai1组大鼠海马组织中CHOP、GRP78、IRE-1和Caspase-12蛋白表达水平降低,差异有统计学意义(P<0.01)。

图4 TUNEL染色(×200)Fig.4 TUNEL staining(×200)
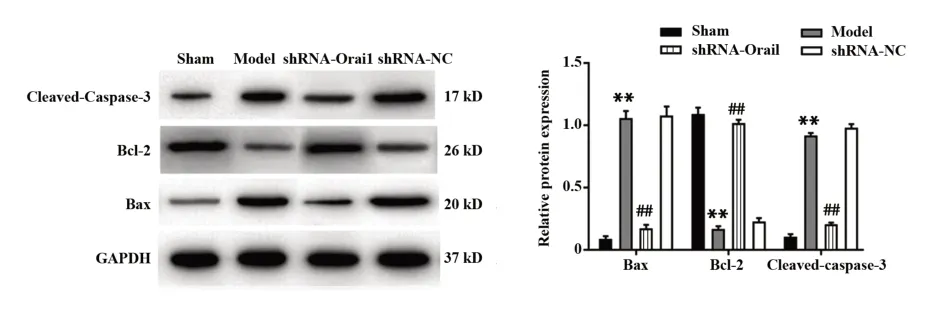
图5 各组大鼠海马组织中凋亡蛋白表达比较Fig.5 Comparison of apoptotic proteins expression in hip⁃pocampal tissue of rats in each group

图6 各组大鼠海马组织中Orai1基因表达比较Fig.6 Comparison of Orai1 gene expression in hippocam⁃pal tissue of rats in each group
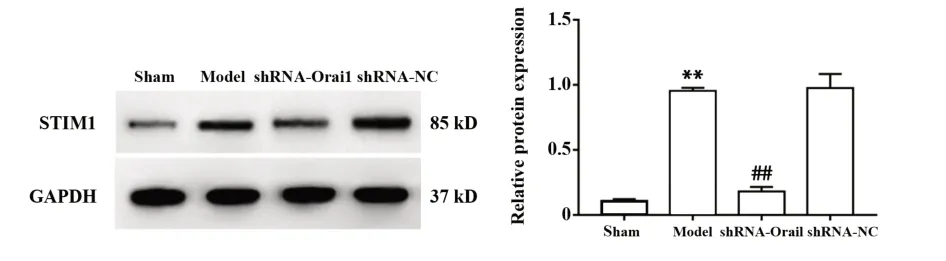
图7 各组大鼠海马组织中STIM 1蛋白表达比较Fig.7 Comparison of STIM 1 protein expression in hippo⁃campal tissue of rats in each group

图8 各组大鼠海马组织中内质网应激相关蛋白表达比较Fig.8 Comparison of endoplasmic reticulum stress-relat⁃ed proteins expression in hippocampal tissue of rats in each group
3 讨论
CIS后缺血半暗带神经元的保护及功能恢复,是临床治疗的重要靶标,也是决定临床预后的重要因素。无论是药物还是手术处理,实现局部血管再通、血流恢复,均有可能引起缺血半暗带的再灌注损伤,严重者可进一步加重神经功能障碍。既往研究提示,氧化应激、钙超载及兴奋性毒性等因素均参与其中[9-10]。Ca2+是神经元最普遍的信号转导分子,而钙超载是脑缺血后导致细胞损伤最重要的一类离子失衡,Orai1通道介导的Ca2+内流障碍对急性CIS有神经保护作用[11]。本研究通过改良Longa线栓法制作急性CI大鼠模型,并干预脑组织中Orai1基因表达,结果显示:干扰Orai1可明显降低CI大鼠的神经功能评分、CI面积及海马组织神经元凋亡率,同时上调海马组织中Bcl-2蛋白表达,下调Cleaved-caspase-3和Bax蛋白表达,说明抑制Orai1基因表达可有效减轻急性CI大鼠神经损伤,具有脑保护作用。
Ca2+作为信使参与多种神经细胞功能活动的调节,而Ca2+超载是脑缺血后导致细胞损伤中最重要的一类离子失衡。当各类刺激发生时,会使海马神经细胞中的Ca2+大量内流,造成细胞内的Ca2+超载,而Ca2+失衡会引发蛋白激酶C的持续激活,同时其持续激活会进一步促进细胞Ca2+内流,加重Ca2+超载,这两个过程循环往复使得蛋白酶和核酸内切酶的活化及合成过程被促进,最后导致神经元功能结构的损害及细胞的凋亡[12-13]。有研究显示,缺血后Ca2+内流是导致大鼠海马神经元凋亡的主要原因[14]。本研究结果也显示,模型组大鼠海马内Ca2+浓度明显升高,而Orai1干扰组大鼠海马内Ca2+浓度明显降低,说明脑缺血大鼠模型中海马组织高表达的Orai1可诱导Ca2+大量内流造成神经元凋亡,而抑制Orai1表达可阻断神经元凋亡的相关下游机制。
内质网是Ca2+在细胞内储存的主要场所,当内质网膜上的钙通道被外源性化合物诱导而发生改变时就会出现Ca2+超载或Ca2+耗竭现象,使内质网的生理功能紊乱,从而影响蛋白的合成、折叠及修饰过程,最终导致ERS的发生,进而引发细胞凋亡[15]。有研究表明,在细胞静息状态下,STIM1和Orai1蛋白分别分布于内质网和细胞膜上,但当细胞内钙库耗竭时,二者在内质网-细胞膜结构上形成功能性CRAC,促使细胞外内流Ca2+,导致细胞内钙超载,引起ERS并介导神经元凋亡[5]。待细胞内钙恢复后,STIM1-Orai1复合体稳定性逐渐下降,STIM1蛋白多聚体解聚,逐渐恢复至静息状态。本研究结果显示,与假手术组相比,模型组大鼠海马组织内STIM1和Orai1蛋白表达显著增多,与模型组相比,Orai1干扰组大鼠海马组织内STIM1和Orai1蛋白表达显著减少。说明Orai1介导钙内流,抑制Orai1可对脑缺血后神经元起保护作用,STIM1和Orai1蛋白可能是神经系统疾病替代疗法的新靶点。
GRP78是内质网腔内的一种分子伴侣,是公认的内质网应激的标志性蛋白[5]。正常情况下与内质网膜上的活化转录因子6、肌醇激酶1(inositol-re⁃quiring kinase-1,IRE-1)和内质网激酶(PKR-like ER kinase,PERK)处于紧密结合状态,都没有活性。但当ERS发生时,GRP78会从这3种跨膜蛋白上解离出来,与未折叠或错误折叠的蛋白结合,恢复蛋白质的正确结构,使相关蛋白质能够正确合成,从而保证机体内环境的平衡稳定,故GRP78的表达水平在一定程度上反映了细胞ERS保护性反应的程度[16]。活化的PERK和IRE-1可通过激活TRAF2蛋白进一步活化Caspase-12,而后活化的Caspase-12易位至细胞质,剪切Caspase-9前体产生活化的Cas⁃pase-9,进而激活下游凋亡蛋白Caspase-3表达,诱导细胞凋亡[17]。CHOP也是内质网应激的标志性蛋白,在非ERS状态时,CHOP主要存在于细胞质,含量很低,在细胞发生ERS时,CHOP活化并高表达后转移至线粒体,通过线粒体途径使抗凋亡蛋白Bcl-2的表达被抑制,而促凋亡蛋白Caspase-3的表达被促进,最终导致细胞凋亡发生[18-19]。本研究结果显示,与假手术组比较,模型组大鼠海马组织内内质网应激相关蛋白CHOP、GRP78、IRE-1和Caspase-12蛋白表达水平显著上调,与模型组比较,Orai1干扰组大鼠海马组织内质网应激相关蛋白表达水平显著下调。提示急性CI能够直接导致细胞内Ca2+稳态的调节异常,诱发ERS,进而加剧胞浆Ca2+超载,诱导细胞凋亡。
综上所述,下调Orai1基因表达可改善急性CI大鼠神经功能,减少CI面积和神经细胞凋亡,其机制可能与平衡海马内Ca2+的浓度,抑制内质网应激相关。
