不同保存温度和反复冻融次数对鸭疫里默氏杆菌DNA的影响
2021-05-24苗小猛徐景峨陶宇航张亚楠杨粤黔
刘 嘉,苗小猛,徐景峨*,陶宇航,蒲 龄,杨 莉,张亚楠,李 婷,余 波,赵 滨,杨粤黔
(1.贵州省畜禽遗传资源管理站,贵州 贵阳 550001;2.贵州省畜牧兽医研究所,贵州 贵阳 550005)
鸭疫里默氏杆菌(Riemerellaanatipestifer,RA)可引起鸭、鹅等禽类感染慢性或急性败血性浆膜炎,对我国养鸭业造成极大的威胁及冲击[1]。其主要的免疫原性外膜蛋白为外膜蛋白A(Outer membrance protein A, OmpA),广泛存在于目前已经测序的所有鸭疫里默氏杆菌菌株中,故常被作为鸭疫里默氏杆菌的鉴定因子[2]。荧光定量PCR技术相对于普通PCR技术而言更为灵敏、便捷、直观,可针对微生物DNA、RNA目的片段进行快速定量检测[3]。故可根据OmpA基因保守序列设计荧光定量PCR引物以准确、迅速鉴定鸭疫里默氏杆菌。然而,在实际检测和科研过程中,由于样本量大小或者仪器检测量的原因,往往存在DNA样品保存备用或者对同一DNA样品反复检测的需求[4],因此研究不同保存温度和反复冻融次数对鸭疫里默氏杆菌检测效果的影响具有一定的现实意义。本研究建立了鸭疫里默氏杆菌荧光定量PCR鉴定方法,并探究了保存于室温、4 ℃、-20 ℃、-80 ℃条件下及-20 ℃、-80 ℃下反复冻融的不同浓度梯度组鸭疫里默氏杆菌DNA样品浓度及荧光定量Ct值的变化,以期为鸭疫里默氏杆菌的实际检测和科学研究提供参考依据。
1 材料与方法
1.1 试验材料
由贵州省畜牧兽医研究所畜禽疫病研究室分离、鉴定并保存的鸭疫里默氏杆菌(血清I型)及大肠杆菌(编号ATCC25922)、沙门菌(编号ATCC13076)、多杀性巴氏杆菌(A型)。
1.2 主要试剂及仪器
胰酶大豆肉汤培养基、LB培养基购于环凯微生物科技(广东)有限公司;四季青新生牛血清购于天杭生物科技(浙江)有限公司;琼脂糖、DNA Marker DL2000、SYBR Green RT-PCR试剂盒购于宝生物(大连)有限公司;DNase/RNase-free H2O、2×Es Taq Masterm Mix购于康为世纪生物科技(北京)有限公司、Gold view核酸染液购于索莱宝科技(北京)有限公司。
仪器主要有:普通PCR仪(T 100,Bio-Rad)、实时荧光定量PCR仪(Mastercyler ep realplex,Eppendorf)、超微量分光光度计(N 50,IMPLEN)、水平电泳仪(DYCP-31E,北京六一生物科技有限公司)、凝胶成像系统(Gel DocTMEQ170-8060,Bio-Rad)等。
1.3 检测指标及方法
1.3.1 DNA的提取 将鸭疫里默氏杆菌、多杀性巴氏杆菌菌株接种到5 mL胰酶大豆肉汤液体培养基(加5%的初生牛血清),将大肠杆菌、沙门菌菌株接种到5 mL的LB液体培养基中,置于37 ℃摇床15 h后,12000 r/min离心10 min,弃上清并收集菌体。加入ddH2O重悬洗涤菌体,洗涤完成后,采用水煮法[5]提取总DNA。
1.3.2 DNA浓度的检测 使用IMPLEN超微量分光光度计记录DNA浓度、OD260/OD280。
1.3.3 DNA的梯度稀释 提取DNA后,原液A用ddH2O依次进行101、102、103倍梯度稀释,分别记为B、C、D组。
1.3.4 保存温度 DNA样品梯度稀释后,A、B、C、D每组各60个样品,每个样品15 μL。分别保存于室温、4 ℃、-20 ℃、-80 ℃,每组样品各15个,每组每个保存温度设3个重复。于0、7、14、21、28 d进行浓度测定及荧光定量分析。
1.3.5 反复冻融 DNA样品A、B、C、D组,每组30个样品,每个样品15 μL。分别保存于-20 ℃、-80 ℃,每组各15个样品,共3个重复。反复置于室温冻融,冻融次数分别为0、7、14、21、28次,使用核酸蛋白仪检测反复冻融后DNA的浓度,使用荧光定量PCR检测Ct值。
1.3.6 引物设计 使用Primer Premier 5.0软件设计OmpA(GenBank: KY399243.1)引物,上游引物为5′-AATAGGTGTTGGTGCTCAT-3′,下游引物为5′-CAAACTCTTGCCTGTAAAT-3′,产物大小为112 bp,退火温度为56 ℃。由生工生物工程股份有限公司合成。
1.3.7 引物特异性检测 将4种菌的DNA分别按照95 ℃,5 min;(94 ℃,30 s;56 ℃,30 s;72 ℃,1 min)×30;72 ℃,5 min的程序进行普通PCR扩增,反应体系为2×Es Taq Masterm Mix 12.5 μL、上游引物1 μL、下游引物1 μL、DNA样品2 μL、ddH2O 8.5 μL。扩增产物于1.5%凝胶电泳,判定是否出现特异性单一条带。
1.3.8 琼脂糖凝胶电泳 称取15 g琼脂糖加热溶解于100 mL超纯水中,并加入10 μL的Gold view核酸染液,制成1.5 %琼脂凝胶。将PCR产物及DNA Marker DL 2000各5 μL点入胶孔中,在220 V电压下水平电泳10 min,结束后将胶块置于凝胶成像系统中照相、保存。
1.3.9 荧光PCR检测 反应体系为SYBR®Prime Ex TaqTM Ⅱ 12.5 μL、上游引物1 μL、下游引物1 μL、DNA样品2 μL、ddH2O 8.5 μL。扩增程序为95 ℃,5 min;(94 ℃,30 s;56 ℃,30 s;72 ℃,1 min)×30;72 ℃,5 min。使用Eppendorf 实时荧光定量PCR仪进行扩增,收集Ct值。同时,将大肠杆菌、沙门菌、多杀性巴氏杆菌、鸭疫里默氏杆菌的DNA分别进行荧光定量PCR,判定是否为特异性扩增曲线。
1.3.10 数据分析 DNA浓度、Ct值等原始数据用 Excel 2010 整理,使用SPSS 19.0的One-way Anova程序进行方差分析,以Tukey法进行多重比较,显著水平为P<0.05,结果用“均值±标准误”表示。
2 结果与分析
2.1 引物特异性检测
由图1可知,凝胶电泳后,仅有第1泳道的鸭疫里默氏杆菌出现单一的112 bp目的条带,而大肠杆菌、多杀性巴氏杆菌、沙门菌、ddH2O均未出现产物条带。经过荧光定量PCR检验后,发现仅有鸭疫里默氏杆菌出现特异性扩增曲线,其余样本均未出现(图2)。表明引物特异性良好,可以用于鸭疫里默氏杆菌荧光定量PCR检测。
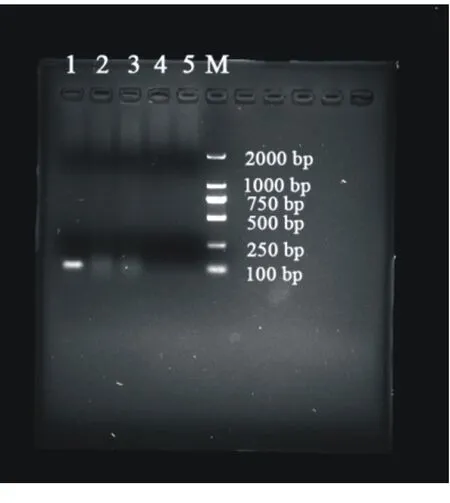
1:鸭疫里默氏杆菌;2:大肠杆菌;3:多杀性巴氏杆菌;4:沙门菌;5:ddH2O;M:DNA分子质量标准。

1:鸭疫里默氏杆菌;2:大肠杆菌;3:多杀性巴氏杆菌;4:沙门菌;5:ddH2O。图2 DNA荧光定量PCR检测曲线
2.2 鸭疫里默氏杆菌DNA的稀释
用水煮法提取鸭疫里默氏杆菌的DNA,经检测,所提DNA的OD260/OD280均在1.8~2.2,DNA纯度较好。测定浓度后用ddH2O依次进行101、102、103倍梯度稀释,稀释后浓度见表1。将原液DNA和稀释DNA进行荧光定量PCR检测,发现随着浓度的下降,Ct值逐渐升高(图3)。

表1 DNA原始浓度和稀释浓度 ng/μL
2.3 保存温度对鸭疫里默氏杆菌DNA的影响
将A、B、C、D等4个不同浓度的鸭疫里默氏杆菌DNA保存于室温、4 ℃、-20 ℃、-80 ℃,于0、7、14、21、28 d进行浓度测定及荧光定量。由表2可知:在0 d时,温度对DNA浓度无显著性影响(P>0.05);在7 d时,保存于-20 ℃、-80 ℃的DNA浓度显著高于室温和4 ℃(P<0.05);在14 d时,保存于常温的DNA样品浓度与其他温度组相比显著降低50%(P<0.05),B组保存于4 ℃的DNA样品浓度显著低于-20 ℃和-80 ℃保存的样品;在21 d时,A、B组常温下DNA样品浓度比其他温度组显著降低89%,且在-20 ℃保存时浓度最高(P<0.05),而C、D组保存于4 ℃、-20 ℃、-80 ℃下的DNA浓度间均无显著性差异(P>0.05);在28 d时,保存于常温的DNA样品出现更明显的降解,浓度降至10 ng/μL以下,A、B组浓度表现为-80 ℃>-20 ℃>4 ℃>常温(P<0.05),而C、D组保存于4 ℃、-20 ℃、-80 ℃下的DNA浓度间均无显著性差异(P>0.05)。
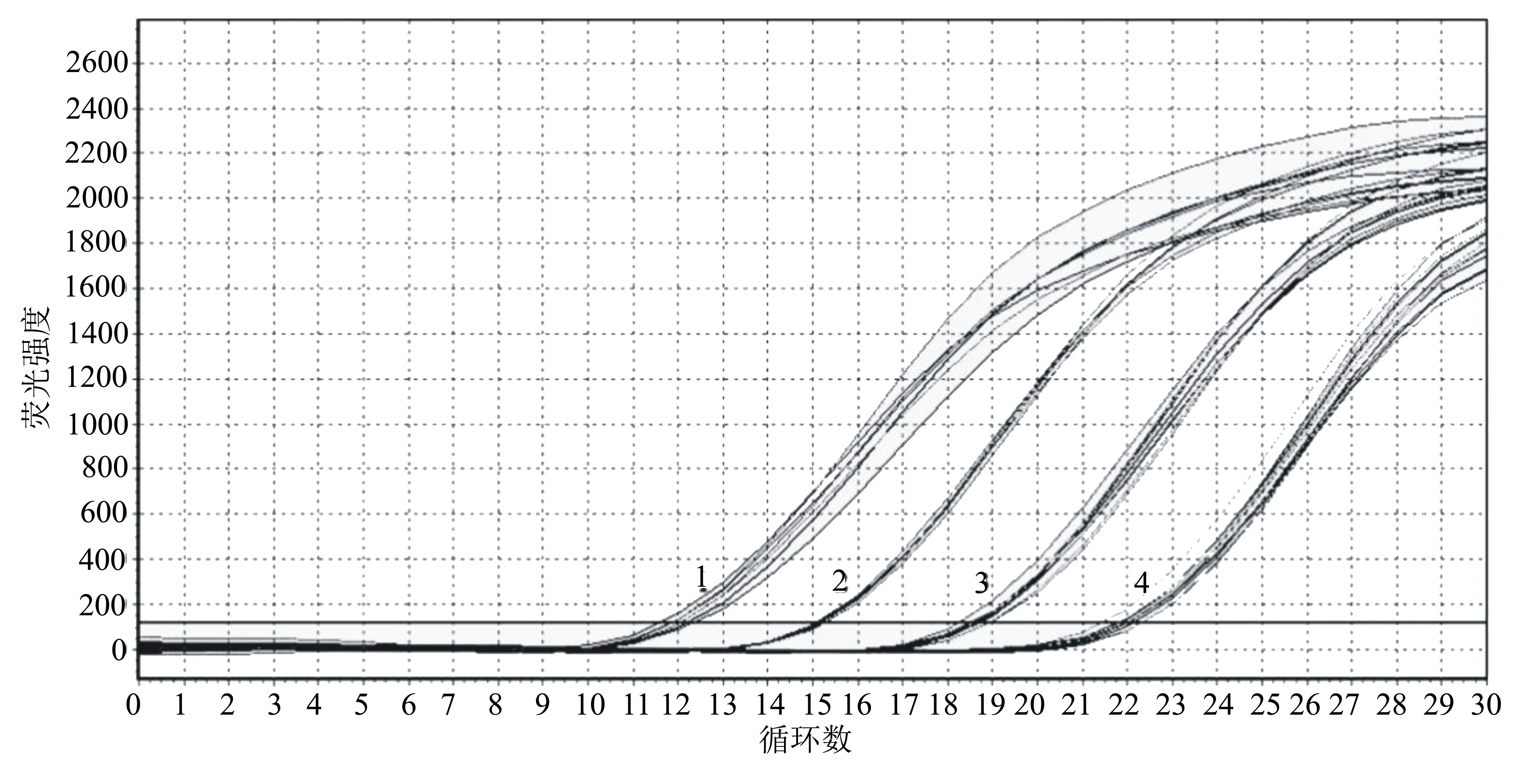
1:原始浓度A;2:101倍稀释浓度B;3:102倍稀释浓度C;4:103倍稀释浓度D。图3 梯度稀释后荧光PCR检测曲线
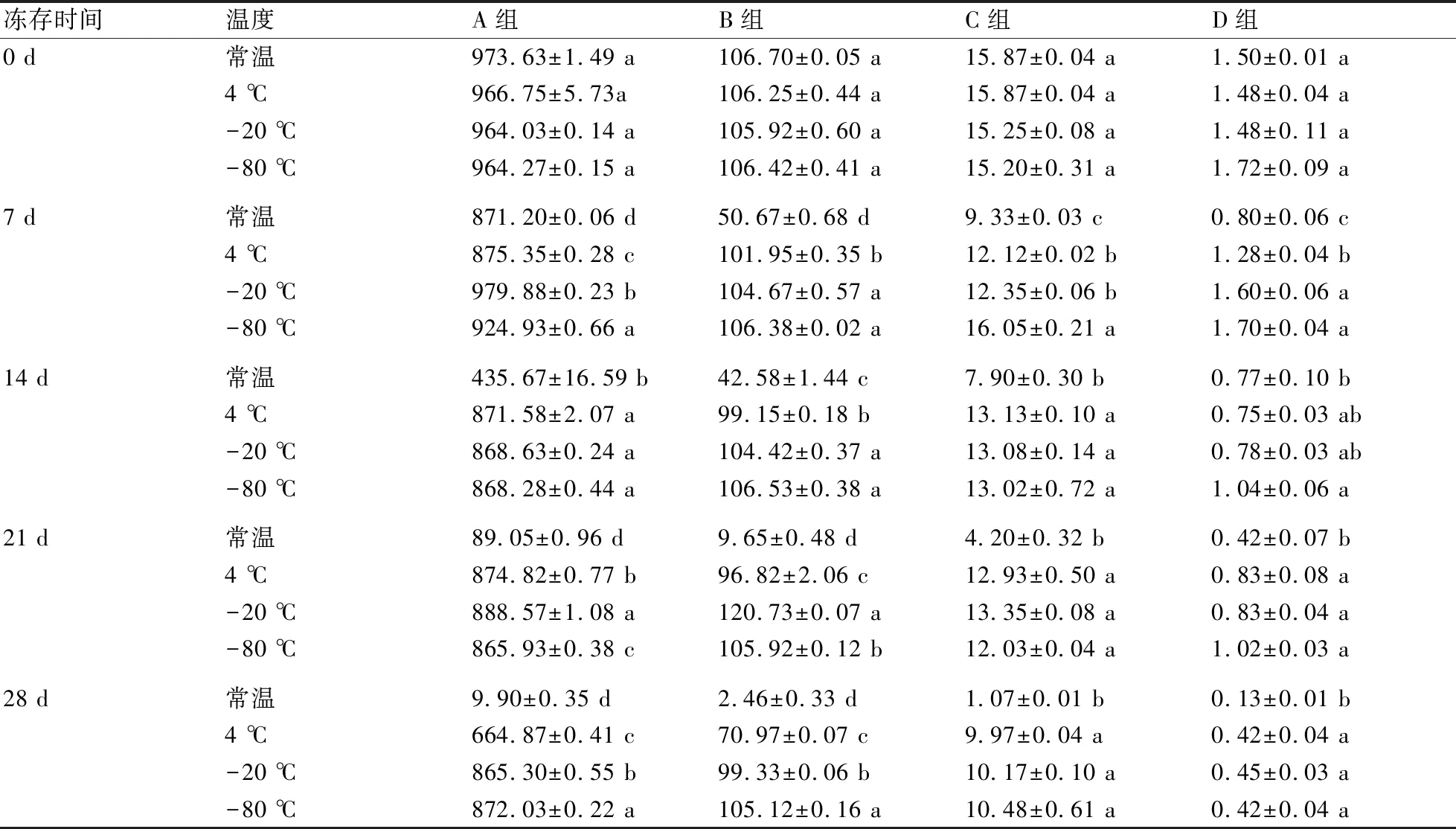
表2 不同保存温度下鸭疫里默氏杆菌DNA浓度的变化 ng/μL
荧光定量检测结果见表3。0 d时各组样品Ct值无明显的组间差异(P>0.05);7~28 d时,常温保存的DNA样品Ct值整体高于其他温度(P<0.05);7 d时,A、B、C组保存于-80 ℃时的Ct值最低(P<0.05),而14 d时D组DNA样品Ct值并没有表现出温度导致的组间差异(P>0.05)。
2.4 冻融次数对鸭疫里默氏杆菌DNA的影响
由表4可知,相同浓度组经历不同的冻融次数后,于-20 ℃、-80 ℃保存的DNA浓度均随着冻融次数的增加而显著下降(P<0.05)。其中,对于高浓度A组而言,冻融7次之后,DNA浓度分别下降了42.48%、47.22%,但14~28次冻融较7次并未出现较大幅度的降解。中高浓度B组在-20 ℃、-80 ℃下保存时,经7次冻融,浓度分别下降了34.72%、43.05%,经14~28次冻融后出现较小幅度的浓度降低(P<0.05)。-20 ℃保存的C组经0、7、14次冻融后浓度无明显变化(P>0.05),经21次冻融后出现显著下降趋势(P<0.05);在-80 ℃下,DNA经28次冻融后浓度出现大幅度的下降(P<0.05),较0次下降了78.29%,较14次下降了65.19%,较21次下降了50.00%。而保存于-20 ℃的低浓度D组经7次冻融后,浓度下降了34.80%,经28次冻融则下降了82.80%;保存于-80 ℃时,第7次冻融后浓度较0次下降了83.87%,经28次冻融后则浓度下降了91.13%,在7、14、21、28次冻融处理间浓度无显著差异(P>0.05)。

表3 不同保存温度下鸭疫里默氏杆菌DNA样品Ct值变化
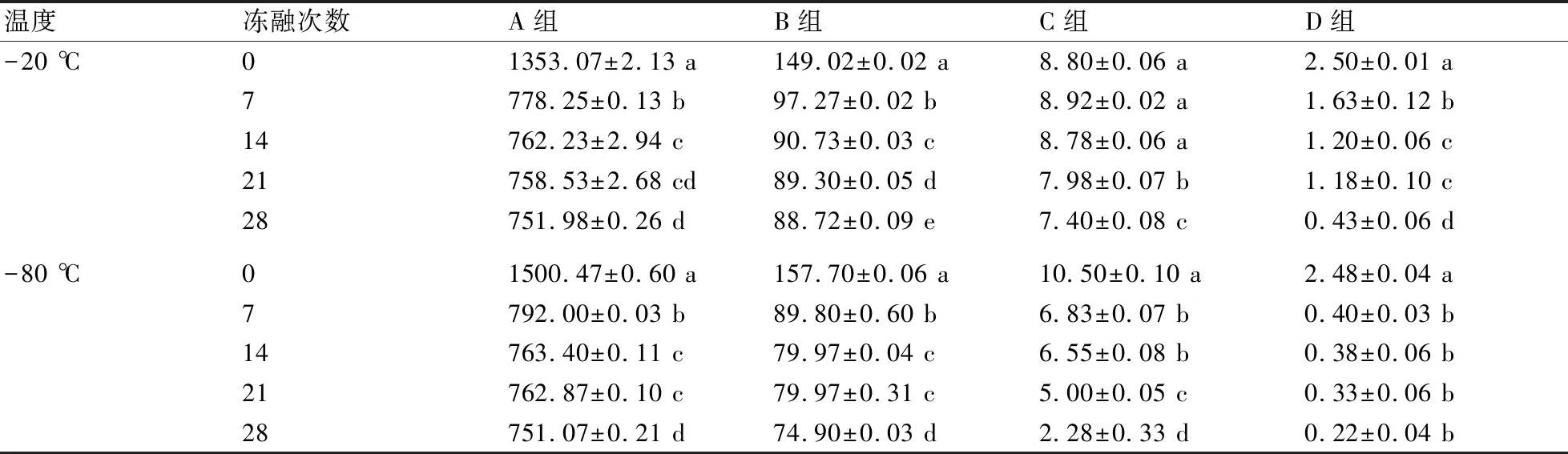
表4 鸭疫里默氏杆菌DNA样品经反复冻融后的浓度变化 ng/μL
荧光定量PCR检测结果见表5。结果表明,-20 ℃、-80 ℃保存的A组、B组DNA样品的Ct值均未受冻融次数的影响(P>0.05),A组的Ct值均为12左右,B组的Ct值为15左右。C组、D组DNA样品的Ct值则随冻融次数的增加而上升(P<0.05),其中在-20 ℃下,C组7次与14次冻融样品的Ct值之间,以及21次与28次冻融样品的Ct值之间,均无显著差异(P>0.05);D组0次、14次、21次冻融样品的Ct值之间,7次、14次、21次冻融样品的Ct值之间,21次、28次冻融样品的Ct值之间,均无显著性差异(P>0.05)。在-80 ℃下,C组0、7、14次冻融样品的Ct值之间无显著差异(P>0.05),而经21、28次冻融后,样品的Ct值显著增加(P<0.05);低浓度D组样品经0~21次冻融后,Ct值无显著变化(P>0.05),经28次冻融后则显著增加(P<0.05)。
3 讨论
3.1 鸭疫里默氏杆菌荧光定量PCR检测方法的构建
鸭疫里默氏杆菌病又称鸭传染性浆膜炎,是由革兰氏阴性病原菌鸭疫里默氏杆菌引起的慢性或急性败血性疾病,病鸭表现出纤维素性心包炎、肝周炎等病理症状[6],可引起鸭群接触性传染,主要侵害2~8周龄雏鸭,致死性较高[7]。一般将OmpA基因、motb基因[8]、tonB基因[9]、16SrRNA[10]作为鸭疫里默氏杆菌鉴定因子。其中,免疫原性外膜蛋白OmpA基因广泛存在于目前已知的鸭疫里默氏杆菌菌株中,故常被用于鉴定鸭疫里默氏杆菌[11]。由于采用普通PCR方法进行扩增后仍需进行凝胶电泳分析,虽成本较低,但扩增产物易出现降解、污染,检测结果不直观,且易产生假阳性[12]。荧光定量PCR是实验室常用的优于普通PCR的实时定量PCR技术,其中染料法较探针法更经济、简便,在扩增过程中能产生大量荧光信号进行实时监测,具有更高的特异性和敏感性,可针对病料的DNA、RNA进行快速定量检测[13]。本研究选用OmpA基因保守序列设计鸭疫里默氏杆菌荧光定量PCR鉴定的引物,经验证,所设计引物仅针对鸭疫里默氏杆菌DNA出现单一的112 bp目的条带(凝胶电泳)和特异性扩增曲线(荧光定量PCR),具有良好的特异性。
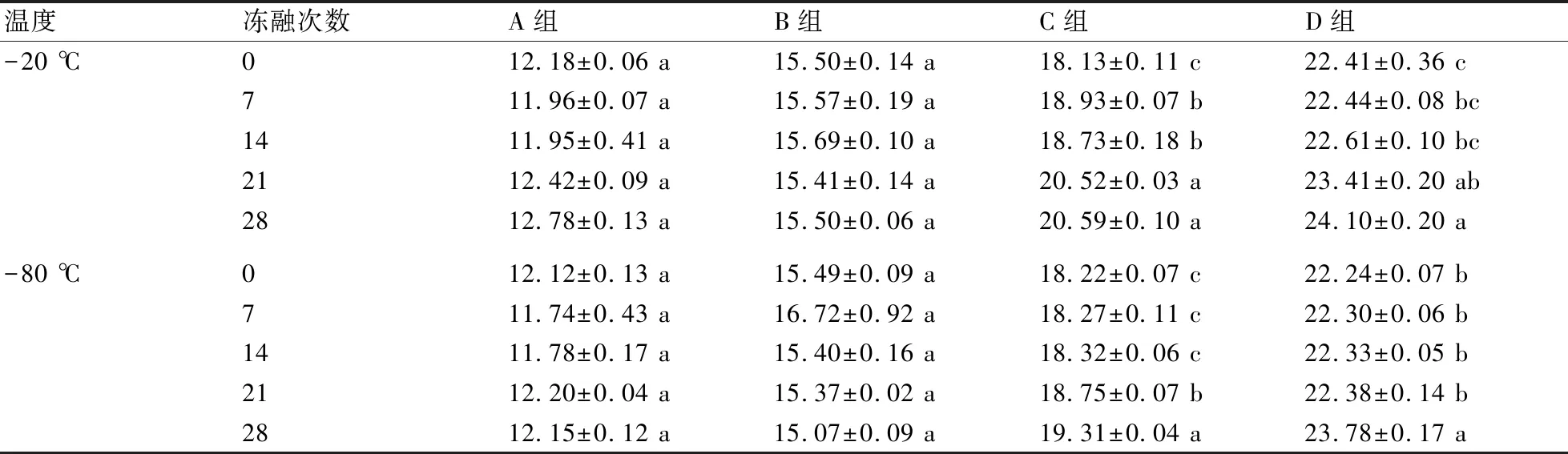
表5 鸭疫里默氏杆菌DNA样品经反复冻融后荧光检测Ct值的变化
用ddH2O将鸭疫里默氏杆菌DNA原液依次经101、102、103倍梯度稀释后进行荧光定量PCR检测,发现随着DNA浓度的下降,循环阈值(Cycle threshold,Ct值)逐渐升高,表明DNA浓度越高则检测灵敏度越好,与以往研究结果[14]相符。
3.2 冻存温度对鸭疫里默氏杆菌DNA的影响
有研究表明,冻存时间对于DNA的完整性、纯度无影响,但会造成DNA数量上的损失[15]。张淑雅等[16]研究表明,DNA样品降解效率与时间呈正相关,常温条件下降解速度快于4 ℃ 、-20 ℃的。DNA的降解主要受DNA酶的影响,温度越低,酶活性越差,故降解越慢。另有研究表明,超过1周后,DNA于室温保存比4 ℃保存浓度下降更明显[17]。宋艳红等[18]研究表明,人乳头瘤病毒DNA在4 ℃条件下保存2周则DNA水平相对稳定,4周后则低浓度组的DNA水平出现降低甚至消失的现象。在本研究中,保存温度对不同浓度的鸭疫里默氏杆菌DNA浓度造成不同程度的影响,保存于常温的DNA样品出现明显的降解,尤其低浓度组DNA样品的Ct值于21 d后出现较大提高,与庄养林等的研究结果[19]相符。故建议鸭疫里默氏杆菌DNA样品的保存温度应低于4 ℃,长期保存则应选择-20 ℃或-80 ℃。
3.3 反复冻融对鸭疫里默氏杆菌DNA的影响
裸露的DNA双链化学特性较为稳定,但是其物理结构容易破碎,在力学作用下DNA序列将不再完整,导致PCR扩增效率下降[20]。反复冻融造成固液体积交替,冰晶的形成导致DNA结构产生力学损伤。本研究中鸭疫里默氏杆菌DNA样品浓度随冻融次数的增加而下降,Ct值反之,与王韵淞等[21]的研究结果一致。范念斯等[22]的研究表明,DNA样品应避免反复冻融,平行保存于-20 ℃条件下的DNA样品可避免DNA浓度发生剧烈变化。王亨莉等[23]的研究表明,较高浓度的DNA样品经21次反复冻融将不影响定量结果,而低浓度组则出现较大波动。本研究发现,较高浓度鸭疫里默氏杆菌DNA样品的Ct值未受冻融次数的影响,保存于-20、-80 ℃中均可;而较低浓度DNA样品则在21次、28次冻融后出现降解,且更适合保存于-20 ℃。而洪恩宇等指出,保存于-80 ℃冰箱的较高浓度的RNA经多次反复冻融后会因浓度原因而出现降解效率的不明显[24]。故浓度对于反复冻融情况下核酸完整性保存具有关键性影响。
4 结论
本研究根据OmpA基因保守序列成功建立了鸭疫里默氏杆菌荧光定量PCR鉴定方法, 鸭疫里默氏杆菌DNA样品保存温度应低于4 ℃,且低浓度DNA样品应避免21次以上的反复冻融。
