白藜芦醇对脂多糖诱导人视网膜色素上皮ARPE-19细胞损伤的保护机制研究
2021-05-23宋慧王英豪
宋慧,王英豪
视网膜炎性反应可导致多种眼科疾病的发生与发展,主要包括葡萄膜炎、糖尿病性视网膜病变和年龄相关性黄斑变性[1-2]。脂多糖(lipopolysaccharides,LPS)在葡萄膜炎和细菌性眼内炎等眼科炎性疾病中可导致视网膜色素上皮(retinal pigment epithelium,RPE)细胞的炎症反应[3-4],进而诱导线粒体损伤,导致细胞凋亡[5]。因此,寻找能降低RPE细胞炎症程度、改善线粒体功能损伤的药物对于眼部疾病的治疗至关重要。白藜芦醇(resveratrol,RES)具有广泛的药理活性,在抗炎性反应、抗细胞凋亡、抗肿瘤等方面效果显著[6-8]。RES属于一种无毒的天然植物化合物,通过激活线粒体凋亡途径,抑制视网膜母细胞瘤细胞增殖并诱导细胞凋亡,可作为抗该肿瘤的佐剂[9]。近期一项研究[10]提出,RES可以抑制过氧化应激诱导的人视网膜色素上皮(human retinal pigment epithelial,hRPE)细胞凋亡,其作用机制可能与调节该细胞的周期有关。然而,RES对hRPE细胞损伤保护的分子机制尚不明确。hRPE细胞中丰富的线粒体对于维持细胞稳态至关重要。为了适应环境变化,线粒体可以迅速改变能量的来源以维持细胞代谢能力,最终通过释放参与细胞死亡途径的蛋白质而导致细胞凋亡[11]。细胞有一个综合的机制以抵消线粒体的损害,其中重要的部分是移除功能失调的线粒体,即线粒体自噬或吞噬[12]。早期研究[13]提出,Aldolase/AMPK信号通路参与线粒体的自噬过程,其活化可促使自噬,进而维持细胞内环境稳定。目前为止,RES是否能通过调节线粒体功能改善hRPE细胞损伤尚不清楚。因此,本文从RES对LPS诱导下hRPE ARPE-19细胞活力和凋亡的影响角度进行研究,以期为视网膜疾病的预防和治疗寻找新的思路。
1 材料与方法
1.1 材料与仪器
ARPE-19细胞购自武汉巴菲尔公司(来自上海ATCC细胞库);DMEM培养基购自Invitrogen公司,批号:12100-500;胰蛋白酶及胎牛血清均购自Gibco公司,批号分别为80871和C10 268951;RES购自上海宝曼生物科技有限公司,批号:111535- 200502;SDS-PAGE试剂盒购自武汉谷歌生物有限公司,批号:B1027;细胞计数试剂盒8(cell counting kit 8,CCK8)购自上海工程生物公司,批号:P0012A;Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物有限公司,批号:C1062S;Hoechst染色试剂盒购自上海Thermo Fisher Scientific公司,批号:C0003;二氢脱氧吗啡(compound C,CC)试剂购自上海Selleck公司,批号:ab 120843;LPS购自上海宝曼生物科技有限公司,批号:623311;磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自上海Thermo Fisher Scientific公司,批号:1209-32;甘油购自江苏凯基生物有限公司,批号:HY-0904;三磷酸腺苷(adenosine triphosphate,ATP)试剂盒购自江苏凯基生物有限公司,批号:1209-83;二辛喹酸(bicinchoninic acid,BCA)试剂盒购自上海Thermo Fisher Scientific公司,批号:CY- 201906;四甲基罗达明乙酯购自上海Thermo Fisher Scientific公司,批号:HB-20 180812;Tris缓冲液(tris buffer,TBS)购自江苏凯基生物有限公司,批号:3980-431;增强化学发光显色液(enhanced chemiluminecence,ECL)购自上海Thermo Fisher Scientific公司,批号:BP-20 190321;Lipofectamine2000购自上海Invitrogen公司,批号:120M-4017V;兔抗Cleaved caspase-3、p-AMPK、aldolase、α-tubulin和β-actin抗体均购自美国CST公司,批号分别为ab102986、ab190863、ab1339086、ab184736和ab1109376。
1.2 细胞培养
将冻存于液氮中的ARPE-19细胞株进行复苏,待细胞贴壁融合至适当密度后进行传代培养。具体操作如下:从培养箱中取出培养瓶至超净工作台,无菌PBS清洗2遍,加入适量浓度的胰蛋白酶消化至细胞变圆,然后加入新鲜培养液终止消化,将细胞吹散后转移至离心管中,1,000 rpm离心5 min,加入含10%胎牛血清的完全培养液吹散分装于2个培养瓶中,置于5%CO2、37℃恒温条件下培养。
1.3 细胞分组及处理
将对数生长期细胞分为5组。(1)对照组(NC组):采用正常完全培养液培养。(2)LPS组:采用含100 ng/mL的LPS培养液培养。(3)LPS+RES组(LR组):采用100 ng/mL的LPS和40 μM的RES共同处理。(4)LPS+CC组(LC组):采用100 ng/mL的LPS和10 μM的CC共同处理。(5)LPS+CC+RES组(LCR组):采用100 ng/mL的LPS和10 μM的CC和40 μM的RES共同处理。每组细胞实验设置5个复孔,均培养24 h。
1.4 细胞活力检测
把对数生长期细胞消化、重悬、接种于96孔板中,每孔加入200 μL细胞混悬液,边缘孔用200 μL PBS填满后培养过夜。细胞贴壁后,按照“1.3”项处理细胞后,取出96孔板,弃上清,每孔加入10 μL CCK8溶液,孵育1.5 h后采用酶标仪检测450 nm处的光密度(optical delnsity,OD)并计算细胞活力。细胞活力(%)=OD实验组/OD对照组×100%。
1.5 Hoechst染色
将对数生长期细胞以每孔5×104个接种于6孔板上培养24 h,按照“1.3”项处理细胞后,收集细胞制备成悬液,用醋酸-乙醇固定液固定,0.01 M的PBS漂洗5 min,Hoechst工作液室温染色15 min,0.01 M的PBS漂洗3次,每次5 min,最后用甘油与PBS比例为1:9的混合液封片,荧光显微镜观察。
1.6 细胞凋亡检测
收集各组处理后的细胞,悬浮细胞直接转移至离心管,贴壁则用胰酶消化后转移至离心管,再用PBS清洗细胞3次,5000 r/min离心6 min,收集细胞,按照Annexin V-FITC/PI试剂盒说明书检测细胞凋亡情况。
1.7 ATP含量检测
收集各组处理后的细胞,然后裂解细胞、离心、取上清,采用BCA试剂盒检测总蛋白浓度。利用ATP试剂盒检测各组细胞中ATP含量,采用化学发光仪测定吸光度值。
1.8 线粒体膜电压测定
线粒体膜电压(mitochondrial membrane potentials,MMP)通过收集各组细胞,采用10 μM四甲基罗达明乙酯染色细胞测定,在37℃条件下反应15min,再利用流式细胞仪检测荧光强度。
1.9 蛋白免疫印迹实验
待药物处理完成后,PBS清洗细胞2次,每孔加入200 μL的裂解液,置于冰上充分裂解30 min,收集细胞裂解液,4 ℃条件下离心12,000 rpm,收集上清液。BCA法检测上清中总蛋白浓度,每孔上样40 μg进行电泳分离,恒压70V,电泳3h。然后在恒流275mA条件下电转70 min,5%脱脂牛奶封闭1 h后,将目的条带放入对应的一抗溶液(稀释比1:1000)中,4℃摇床孵育过夜。TBS洗膜3次,每次10 min,再把条带放入盛二抗(稀释比1:3000)的平皿中室温孵育1 h,TBS洗膜3次,每次10 min。加入4 mL的ECL显影液显色3 min,凝胶成像系统曝光。
1.10 统计学方法
采用SPSS 19.0统计软件进行统计分析,计量资料用均值±标准差()表示,多组比较采用单因素方差分析,各组间两两比较用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 RES诱导ARPE-19细胞增殖
Hoechst染色发现,各组Hoechst染色阳性ARPE-19细胞数分别为:NC组(798.32±34.54)个、LPS组(108.32±24.21)个、LR组(578.54±46.21)个。3组之间比较,差异具有统计学意义(F=108.412,P=0.000)。与NC组比较,LPS组和LR组阳性细胞数明显减少(tLPS=36.579、tLR=8.518,均P=0.000);与LPS组比较,LR组阳性细胞数明显增多(t=20.155,P=0.000),差异均具有统计学意义(图1)。
2.2 RES降低LPS诱导的ARPE-19细胞凋亡
各组细胞凋亡率分别为:NC组(2.20±1.03)%、LPS组(26.48±3.92)%、LR组(13.83±3.02)%。3组之间比较,差异具有统计学意义(F=43.437,P=0.000)。与NC组比较,LPS组和LR组增高(tLPS=13.395,tLR=8.150,均P=0.000);与LPS组比较,LR组降低(t=5.716,P=0.000),差异均有统计学意义(图2)。
2.3 RES降低LPS诱导的ARPE-19细胞线粒体损伤
3组细胞ATP比较,差异具有统计学意义(F=46.803,P=0.000)。与NC组比较,LPS组和LR组明显降低;与LPS组比较,LR组明显升高(表1、2)。

图1 各组存活ARPE-19细胞的核染色图(×200倍)。1A NC组;1B LPS组;1C LR组
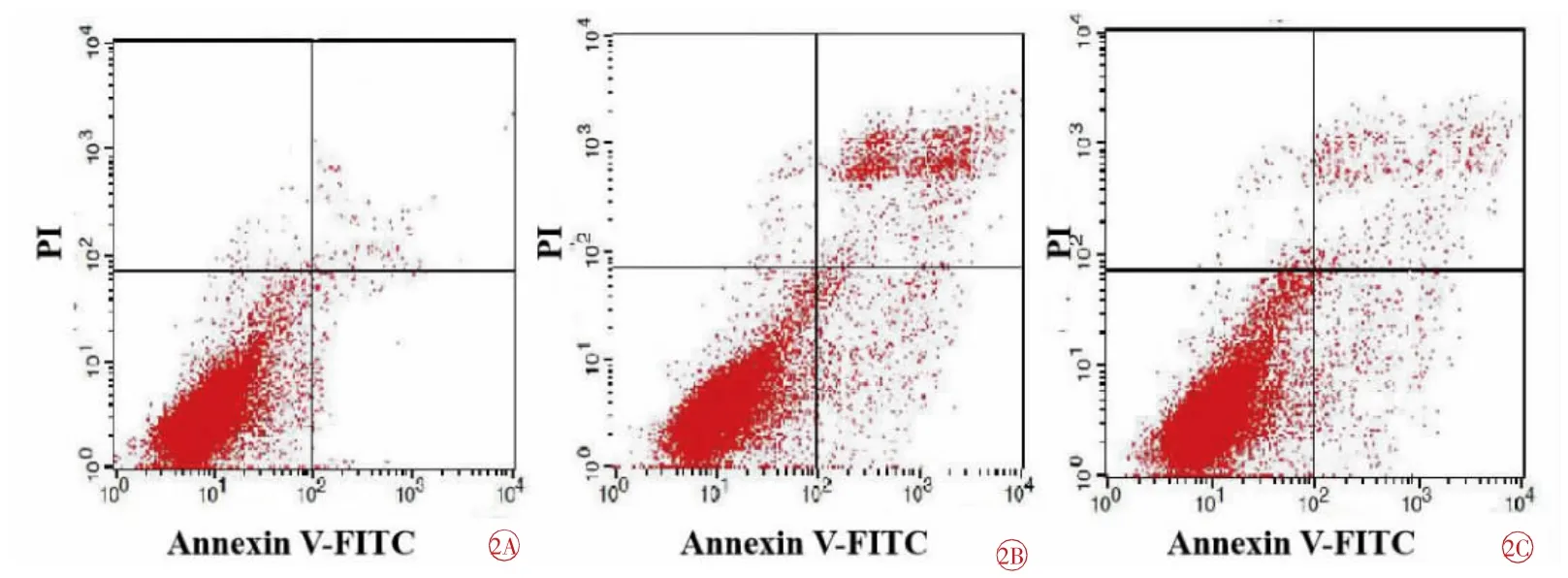
图2 各组细胞凋亡率的比较。2A NC组;2B LPS组;2C LR组
3组细胞MMP比较,差异具有统计学意义(F=57.815,P=0.000)。与NC组比较,LPS组明显降低,LR组降低不显著;与LPS组比较,LR组明显升高(表1、2)。
表1 各组ARPE-19细胞ATP水平和MMP(,n=5)

表1 各组ARPE-19细胞ATP水平和MMP(,n=5)
注:NC对照组;LPS脂多糖组;LR脂多糖+白藜芦醇组;ATP三磷酸腺苷;MMP线粒体膜电压
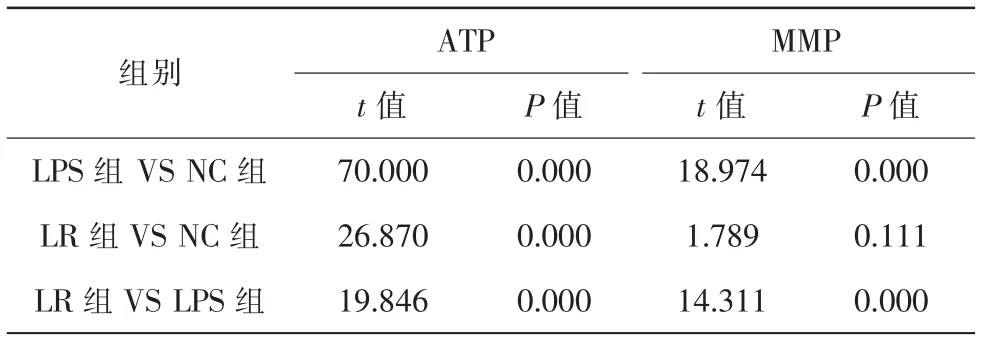
表2 ARPE-19细胞ATP水平和MMP比较统计值
2.4 RES通过AMPK信号通路改善ARPE-19细胞损伤
实验观察了CC对p-AMPK蛋白表达的影响。各组细胞p-AMPK蛋白表达水平比较,差异具有统计学意义(F=19.804,P=0.000)。与NC组比较,LPS组、LR组和LC组升高,LCR组升高不明显。与LPS组比较,LR组升高,LC组和LCR组降低。与LR组比较,LC组和LCR组降低。与LC组比较,LCR组升高不明显(图3,表3、4)。
实验进一步检测了RES和CC对细胞增殖活力的影响(图4B)。各组细胞相对活力比较,差异具有统计学意义(F=31.209,P=0.000)。与NC组比较,LPS组、LR组、LC组和LCR组细胞活力降低。与LPS组比较,LR组升高,LC组降低,LCR组升高不明显。与LR组比较,LC组和LCR组均降低。与LC组比较,LCR组升高(表3、4)。

图3 p-AMPK蛋白条带图
表3 各组ARPE-19细胞p-AMPK表达水平和细胞活力(,n=5)

表3 各组ARPE-19细胞p-AMPK表达水平和细胞活力(,n=5)
注:NC对照组;LPS脂多糖组;LR脂多糖+白藜芦醇组;LC脂多糖+AMPK抑制剂组;LCR脂多糖+白藜芦醇和AMPK抑制组;OD光密度
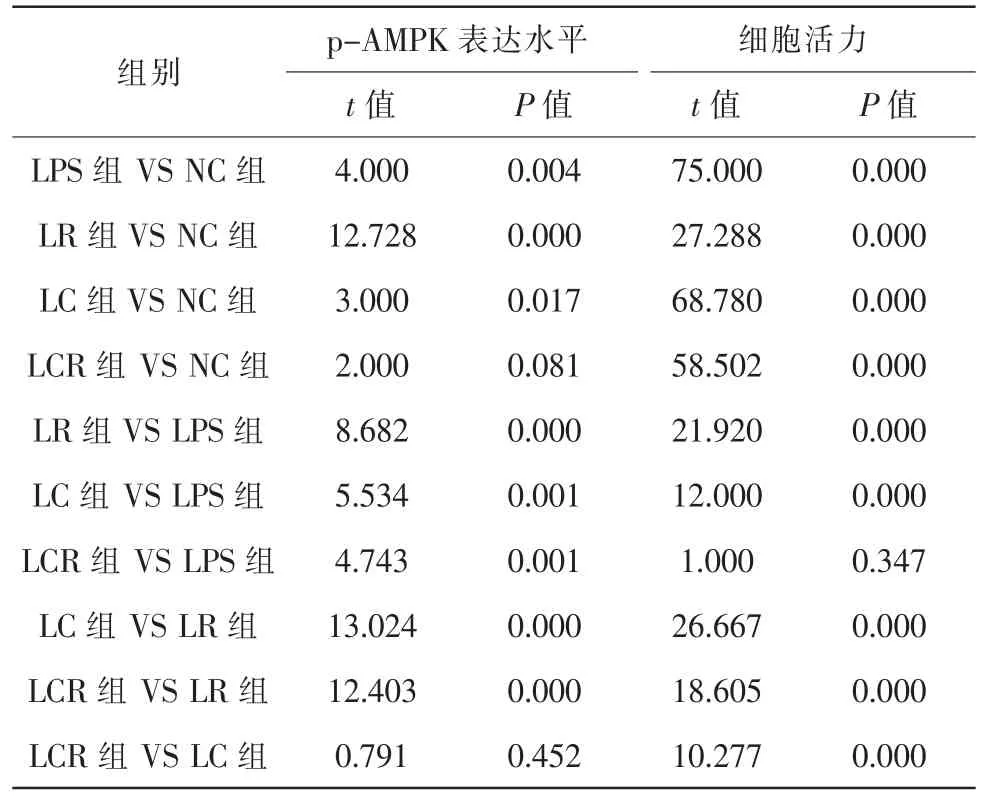
表4 ARPE-19细胞p-AMPK表达水平和细胞活力比较统计值
2.5 RES通过Aldolase激活AMPK信号通路诱导ARPE-19细胞增殖
各组细胞Aldolase蛋白表达水平分别为:NC组(0.09±0.01)、LPS组(0.18±0.02)、LR组(0.41±0.03)。3组之间比较,差异具有统计学意义(F=51.024,P=0.002)。与NC组比较,LPS组和LR组升高(tLPS=9.000,tLR=22.627,均P=0.000)。与LPS组比较,LR组升高(tLR=14.264,P=0.000),差异均有统计学意义(图4)。
3 讨论
视网膜病变的病原学及发病分子机制尚未阐明,既往研究[14]发现,眼部疾病与老化、氧化应激、炎症反应及线粒体损伤等因素密切相关。随着年龄增长,人体细胞线粒体功能也随之减弱,RPE细胞位于脉络膜毛细血管层与光感受器细胞层之间,容易引起其遭受炎症因子刺激,进而导致视网膜病变[15]。本文采用LPS干预ARPE-19细胞诱导其线粒体损伤模型,实验发现细胞ATP水平及MMP均明显降低,另外还发现线粒体自噬相关蛋白PINK1表达水平也在下降,这说明LPS刺激可诱导ARPE-19细胞线粒体损伤,进而引起细胞活力减弱及凋亡率增高。

图4 各组细胞Aldolase表达水平比较。4A Aldolase蛋白条带图;4B Aldolase相对表达水平
RES是一种属于非黄酮类多酚化合物的植物保护素,药理学研究[6-7]表明,其具有显著的抗炎、抗氧化及抗凋亡的能力。另外,早期研究[16]也证实,RES可通过增强细胞线粒体自噬能力而改善疾病的进展。但有关RES对RPE细胞是否具有抗线粒体损伤活性及其作用机制尚不清楚。细胞主要依赖ATP来实现能量的代谢转化,随着细胞内ATP的排出,细胞的自杀机制也将被激活。生理状态下,细胞中产生的ATP主要来源于线粒体中的氧化磷酸化[17]。在细胞生长过程中线粒体功能主要有线粒体融合、裂变和自噬调节,自噬体可对线粒体进行选择性的隔离和降解[18]。本研究证实RES能明显抑制LPS诱导的ARPE-19细胞,增强细胞增殖活力;RES可提升细胞中ATP水平及MMP,促使线粒体自噬能力。
已有研究[19]证实,AMPK信号通路的激活参与了细胞中线粒体自噬过程。RES可以改善线粒体功能异常并且可活化AMPK信号传导诱导细胞的有益自噬[16]。本文实验结果也发现,RES可促进ARPE-19细胞中p-AMPK蛋白表达,而AMPK抑制剂CC可阻断药物对AMPK磷酸化的激活作用并同时减弱了药物的保护作用,提示RES对视网膜上皮细胞损伤的保护作用取决于AMPK的活性。前期已有研究[20-21]报道,RES可通过调节AMPK信号通路保护线粒体功能及细胞自噬能力。Aldolase可以作为细胞能量代谢的监视因子,在感知细胞ATP水平降低的同时可激活AMPK信号系统[22]。本实验发现,RES能诱导ARPE-19细胞中Aldolase的表达。由此说明,RES激活AMPK信号通路和线粒体自噬是通过诱导Aldolase表达来实现的。后续实验将进一步深入探讨RES与Aldolase之间的相互作用,即RES通过何种途径来调节ARPE-19细胞中Aldolase蛋白表达。
总之,本研究发现RES是通过激活Aldolase/AMPK信号传导来促进细胞存活,这可能是RPE细胞对炎症刺激的一种新的适应性反应。
