扶肺煎抑制肺癌增殖和转移的体内外研究
2021-05-13陈观平汪一帆应栩华
陈观平, 汪一帆, 应栩华
(浙江省立同德医院中西医结合肿瘤研究所,浙江杭州 310012)
肺癌的高转移性是造成患者高病死率的主要因素,一旦发生远处转移,严重影响患者的临床疗效及生存时间[1]。肿瘤转移是一个非常复杂的过程[2],深入研究肺癌的临床治疗及其远处转移的防治,使之更好地指导临床应用,对降低肺癌病死率,改善临床预后有重要意义。扶肺煎为我院多年使用的抗肺癌临床具有效验方,前期的研究表明,扶肺煎不仅能改善肺癌患者免疫功能、减轻临床症状,还可促进抑癌基因、肿瘤转移抑制基因的表达[3];扶肺煎可降低C57BL/6小鼠Lewis肺癌移植瘤Bcl-2 基因的表达,提高Bax 基因的表达,起到控制细胞生长及分化、抑制细胞增殖、诱导细胞凋亡的作用[4]。而Bcl-2、Bax为信号转导与转录激活因子(STAT3)下游靶基因[5]。为进一步探讨扶肺煎抑制肺癌细胞增殖、迁移的作用机制,本研究通过体内外实验观察扶肺煎对肺癌细胞STAT3信号传导通路的影响,以期为扶肺煎临床治疗肺癌提供理论依据,现将研究结果报道如下。
1 材料与方法
1.1 细胞及培养 人肺癌细胞株A549、SPC-A1购自中国科学院上海生命科学研究院细胞资源中心。人肺癌细胞株A549、SPC-A1 培养于37 ℃、体积分数5%CO2的细胞培养箱,以含体积分数10%胎牛血清的1640 培养基培养,每2 d 传代1 次,维持细胞密度为80%左右。
1.2 实验动物 雄性健康SPF级3 ~4周龄C57BL/6小鼠,体质量(18±2)g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2015-0001。雄性健康SPF级6 ~7周龄SD大鼠,体质量(180±10)g,购自浙江维通利华实验动物技术有限公司,动物质量合格证号:Abzz0619067637。所有动物均饲养于浙江省中医药研究院SPF级实验动物中心,饲养温度为20~25 ℃,湿度为40%~70%。
1.3 药物及制备 扶肺煎方药组成:生晒参10 g,北沙参12 g,炙黄芪30 g,枸杞子12 g,天葵子12 g,猫爪草20 g,紫花地丁20 g,蜈蚣3 条。上述中药材均购自杭州华东中药饮片有限公司,经浙江中医药研究院浦锦宝教授鉴定为道地药材。于浙江省立同德医院制剂室煎制,方法:称取复方中各药材后,加入10 倍药量的水,煎煮2 次(分别为2、1.5 h),收集、合并2次滤液,减压浓缩至适当体积,最终成2 g/mL的药液,于4 ℃保存备用。
1.4 试剂与仪器 RPMI-1640 培养基(美国Hyclone 公司);胎牛血清(美国Gibco 公司);细胞计数试剂盒8(CCK-8)、放射免疫沉淀分析(RIPA)裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司);兔抗人细胞周期蛋白依赖性激酶4(CDK4)、细胞周期蛋白D1(Cyclin D1)、STAT3、磷酸化STAT3(p-STAT3)单克隆抗体(美国CST 公司);多聚体抗兔免疫球蛋白G(IgG)-辣根过氧化物酶(HRP)(武汉博士德公司,货号:SV0002)。蛋白电泳仪(美国Bio-Rad 公司);CO2培养箱(美国Thermo Fisher 公司);PCR仪(美国ABI 公司);倒置显微镜(日本Olympus 公司);多功能酶标仪(美国MD公司)。
1.5 体外研究
1.5.1 含药血清的制备 按照中药血清药理学及前期研究基础[6-7],将大鼠随机分为空白对照组(15 只)、扶肺煎高剂量组(5只)、扶肺煎低剂量组(5 只)。扶肺煎高剂量组按生药30 g·kg-1·d-1灌胃、扶肺煎低剂量组按生药15 g·kg-1·d-1灌胃,空白对照组灌胃等体积生理盐水,连续灌胃7 d,末次灌胃1 h后无菌条件下取血并分离血清过滤除菌。
1.5.2 细胞分组 分为5 组。空白对照组:10%空白对照血清+RPMI-1640培养基;扶肺煎低剂量组:10%低剂量组含药血清+RPMI-1640 培养基;扶肺煎高剂量组:10%高剂量组含药血清+RPMI-1640培养基;AG490组(阳性对照1):10%空白对照血清+1640 培养基+10 μmol/L AG490;顺铂组(阳性对照2):10%空白对照血清+1640 培养基+1 μmol/L 顺铂。
1.5.3 CCK8 法测定细胞增殖情况 取对数生长期的A549、SPC-A1细胞,接种于96孔板,5×103个/孔,每孔100 μL,培养箱中培养24 h 后弃上清。按“1.5.2”项方法处理,每组设4 个复孔,24、48、72 h 后终止培养。按CCK-8 试剂盒说明书进行操作,应用酶标仪于450 nm 波长处检测各孔光密度(OD)值,计算细胞生长抑制率。细胞生长抑制率(%)= [(OD空白血清- OD含药血清)/(OD空白血清-OD空白)]×100%。
1.5.4 细胞划痕实验观察细胞迁移能力 取处于对数生长期状态良好的A549、SPC-A1细胞,接种于6孔板,待细胞长至80%左右,按“1.5.2”项方法处理。24 h 后,在每孔板中间用1 mL 枪头划痕,使各孔的细胞划痕宽度一致,磷酸盐缓冲液(PBS)漂洗去除细胞碎片。每孔换成含相应血清及药物的培养基2 mL,继续培养24 h,观察细胞迁移情况,并拍照记录。
1.5.5 Transwell 侵袭实验观察细胞侵袭能力 将对数生长期状态的A549、SPC-A1细胞调整密度为5 × 105个/mL,种 于6 孔 板,每 孔2 mL,按“1.5.2”项方法处理。24 h 后消化收集细胞,加入仅含RPMI-1640 的培养基重悬细胞,各组细胞均调整密度为1×106个/mL,分别取100 μL上述细胞悬液加入含Matrigel基质胶的Transwell 24孔板小室上室。下室加入600 μL 含10%胎牛血清培养液,培养箱培养24 h。弃去Transwell 小室中培养液,用棉签轻轻擦掉上层未迁移细胞,PBS洗涤,40 g/L多聚甲醛固定,结晶紫染色后拍照并统计穿过小孔的细胞。
1.5.6 蛋白免疫印迹法观察细胞Cyclin D1、CDK4、STAT3、p-STAT3蛋白的表达 按“1.5.2”项方法处理A549、SPC-A1细胞,48 h后裂解细胞并提取蛋白,BCA 法测定蛋白浓度。十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,将蛋白转至PVDF 膜,经脱脂奶粉封闭,一抗Cyclin D1(1∶1 000 稀释)4 ℃孵育过夜,二抗IgGHRP(1∶5 000 稀释)孵育1 h,电化学发光(ECL)显色,成像,最后应用ImageJ 软件分析电泳条带的灰度值,以GAPDH 为内参计算各组目的蛋白含量。CDK4(1∶1 000)、STAT3(1∶2 000)、p-STAT3(1∶1 000)、甘油醛-3-磷酸脱氢酶(GAPDH)(1∶1 000)等抗体的检测方法同上。
1.6 体内研究
1.6.1 造模、分组与干预方法 取对数生长期的Lewis 肺癌细胞,消化、离心后,调细胞混悬液浓度为1.0×107个/mL。于每只小鼠皮下接种细胞混悬液0.2 mL,建立Lewis 肺癌小鼠模型。24 h 后,随机分为4组,即模型组、扶肺煎低剂量组、扶肺煎高剂量组、顺铂组,每组12 只,分笼饲养。根据成人的临床用药剂量换算成相应小鼠用药剂量,其中,高剂量组相当于成人等效剂量的20 倍给药,低剂量组相当于成人等效剂量的10 倍给药。扶肺煎低、高剂量组,分别给予扶肺煎30、60 g·kg-1灌胃,每日1 次;顺铂组,给予顺铂2 mg/kg 腹腔注射,隔日1 次;模型对照组,给予0.5 mL生理盐水灌胃。连续14 d。
1.6.2 肿瘤转移情况与抑瘤率 末次给药后24 h颈椎脱臼法处死小鼠,取肺,肉眼观察肺转移灶,计算肺部转移结节个数,计算肺转移抑制率,肺转移抑制率(%)=(模型组平均转移结节个数-治疗组平均转移结节个数)/模型组平均转移结节个数× 100%。同时剥瘤并称质量,计算抑瘤率。抑瘤率(%)=(对照组平均瘤质量-治疗组平均瘤质量)/对照组平均瘤质量×100%。
1.6.3 免疫组织化学法检测移植瘤组织Cyclin D1、CDK4、p-STAT3 表达 将剥离的移植瘤固定12 h后,常规石蜡包埋切片。清除内源性过氧化酶后热修复抗原。滴加单抗p-STAT3(1∶200稀释)37 ℃孵育,DAB 显色,苏木精复染后镜检。阳性表达胞浆呈棕黄色颗粒状染色,每张片子随机抽取5个高倍镜视野(×200)采集图像,用Image Pro Plus 6.0软件分析测定每个视野积分光密度(IOD)。Cyclin D1(1∶250)、CDK4(1∶800)检测方法同上。
1.7 统计方法 采用SPSS 17.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,多组间比较采用单因素分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 扶肺煎含药血清对A549、SPC-A1 细胞增殖的影响 表1 结果显示:干预A549 细胞48 h 后,扶肺煎低、高剂量组,AG490组,顺铂组的OD值较空白对照组降低(P <0.05 或P <0.01);干预A549 细胞72 h 后,扶肺煎高剂量组、AG490 组、顺铂组的OD 值较空白对照组降低(P <0.05 或P <0.01)。表2 结果显示:干预SPC-A1 细胞48 h 后,扶肺煎高剂量组、AG490组的OD值较空白对照组降低(P <0.05);干预SPC-A1细胞72 h后,AG490组、顺铂组的OD值较空白对照组降低(P <0.05或P <0.01)。表明扶肺煎可抑制A549、SPC-A1细胞的增殖,抑制A549 细胞的效果优于SPC-A1 细胞,且随扶肺煎含药血清处理时间的延长,干预作用逐渐减弱,48 h作用效果较好。
表1 扶肺煎含药血清对A549细胞增殖的影响Table 1 Effect of Fufei Jian-containing serum on proliferation of A549 cells (±s)
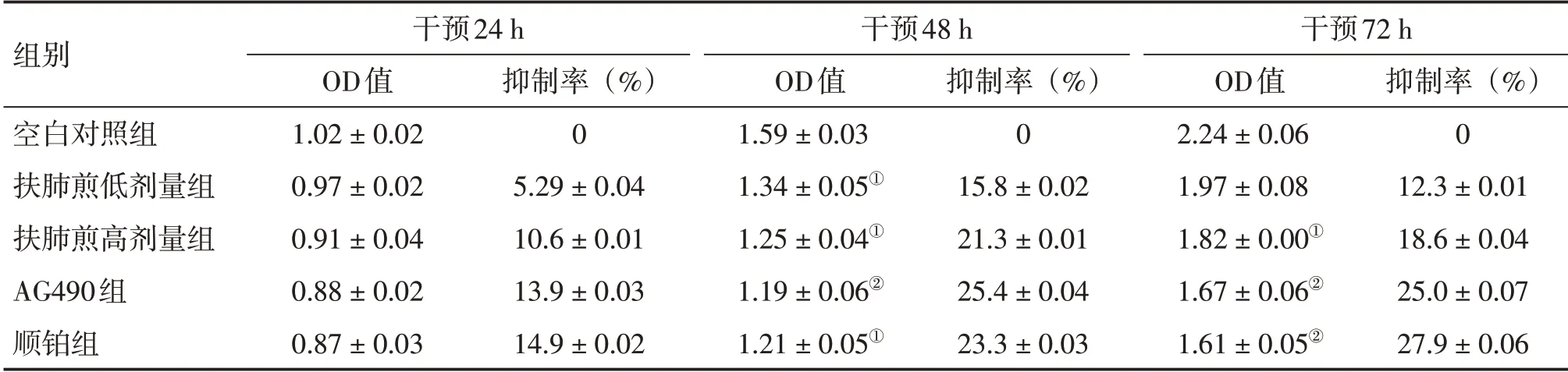
表1 扶肺煎含药血清对A549细胞增殖的影响Table 1 Effect of Fufei Jian-containing serum on proliferation of A549 cells (±s)
①P <0.05,②P <0.01,与空白对照组比较
组别空白对照组扶肺煎低剂量组扶肺煎高剂量组AG490组顺铂组干预24 h OD值1.02±0.02 0.97±0.02 0.91±0.04 0.88±0.02 0.87±0.03抑制率(%)0 5.29±0.04 10.6±0.01 13.9±0.03 14.9±0.02干预48 h OD值1.59±0.03 1.34±0.05①1.25±0.04①1.19±0.06②1.21±0.05①抑制率(%)0 15.8±0.02 21.3±0.01 25.4±0.04 23.3±0.03干预72 h OD值2.24±0.06 1.97±0.08 1.82±0.00①1.67±0.06②1.61±0.05②抑制率(%)0 12.3±0.01 18.6±0.04 25.0±0.07 27.9±0.06
表2 扶肺煎含药血清对SPC-A1细胞增殖的影响Table 2 Effect of Fufei Jian-containing serum on proliferation of SPC-A1 cells (±s)

表2 扶肺煎含药血清对SPC-A1细胞增殖的影响Table 2 Effect of Fufei Jian-containing serum on proliferation of SPC-A1 cells (±s)
①P <0.05,②P <0.01,与空白对照组比较
组别空白对照组扶肺煎低剂量组扶肺煎高剂量组AG490组顺铂组干预24 h OD值0.85±0.03 0.80±0.02 0.73±0.03 0.70±0.01 0.71±0.02抑制率(%)0 5.1±0.03 13.0±0.03 16.9±0.02 15.5±0.03干预48 h OD值1.46±0.04 1.28±0.03 1.14±0.04①1.15±0.06①1.24±0.03抑制率(%)0 12.0±0.02 21.8±0.01 21.0±0.04 15.0±0.03干预72 h OD值2.07±0.06 1.94±0.04 1.84±0.05 1.55±0.04②1.60±0.06①抑制率(%)0images/BZ_154_797_2053_799_2056.png0.06±0.06 11.1±0.01 25.4±0.03 22.7±0.04
2.2 扶肺煎含药血清对A549、SPC-A1 细胞迁移的影响 图1结果显示:扶肺煎高剂量组、AG490组、顺铂组处理A549、SPC-A1细胞划痕24 h后划痕依旧明显,宽度变化不明显,而空白对照组划痕区变窄。A549 细胞,与空白对照组比较,扶肺煎低、高剂量组,AG490 组、顺铂组细胞迁移距离明显缩短,差异均有统计学意义(P <0.01);SPC-A1细胞,与空白对照组比较,扶肺煎高剂量组、AG490 组、顺铂组的细胞迁移距离均明显缩短,差异有统计学意义(P <0.01)。表明扶肺煎均可抑制A549、SPC-A1细胞的迁移。
2.3 扶肺煎含药血清对A549、SPC-A1 细胞侵袭能力的影响 图2 结果显示:A549 细胞,与空白对照组比较,扶肺煎低、高剂量组,AG490 组,顺铂组细胞迁移数量明显减少,差异均有统计学意义(P <0.01);SPC-A1 细胞,与空白对照组比较,扶肺煎高剂量组、AG490 组、顺铂组的细胞迁移数量均明显降低,差异有统计学意义(P <0.01)。表明扶肺煎均可抑制A549、SPC-A1 细胞的侵袭转移。
2.4 扶肺煎含药血清对A549、SPC-A1 细胞Cyclin D1、CDK4 蛋白表达的影响 图3 结果显示:A549 细胞,与空白对照组比较,扶肺煎低、高剂量组,AG490 组,顺铂组的Cyclin D1 蛋白表达水平明显降低,扶肺煎高剂量组及AG490 组的CDK4蛋白表达水平明显降低,差异均有统计学意义(P <0.05或P <0.01);SPC-A1细胞,与空白对照组比较,扶肺煎低、高剂量组,AG490 组、顺铂组的Cyclin D1、CDK4 蛋白表达水平均明显降低,差异有统计学意义(P <0.05 或P <0.01)。表明扶肺煎可能通过抑制Cyclin D1、CDK4 的表达,抑制A549、SPC-A1细胞的侵袭转移。
2.5 扶肺煎含药血清对A549、SPC-A1细胞STAT3、p-STAT3 的影响 图4 结果显示:A549、SPC-A1细胞各组STAT3 表达水平比较,差异均无统计学意义(P >0.05)。A549 细胞,扶肺煎高剂量组、AG490 组、顺铂组的p-STAT3 表达水平较空白对照组明显降低,差异均有统计学意义(P <0.05 或P <0.01);SPC-A1 细胞,扶肺煎高剂量组、AG490 组、顺铂组的p-STAT3 表达水平较空白对照组明显降低,但扶肺煎高剂量组差异无统计学意义(P >0.05)。表明扶肺煎可能通过抑制STAT3磷酸化,减轻A549、SPC-A1 细胞的侵袭转移能力,对A549细胞的抑制作用更强。

图1 扶肺煎含药血清对A549、SPC-A1细胞迁移的影响Figure 1 Effect of Fufei Jian-containing serum on migration of A549 and SPC-A1 cells

图2 扶肺煎含药血清对A549、SPC-A1细胞侵袭的影响Figure 2 Effect of Fufei Jian-containing serum on invasion of A549 and SPC-A1 cells

图3 扶肺煎含药血清对A549、SPC-A1细胞Cyclin D1、CDK4蛋白表达的影响Figure 3 Effect of Fufei Jian-containing serum on protein expression levels of Cyclin D1 and CDK4 in A549 and SPC-A1 cells

图4 扶肺煎含药血清对A549、SPC-A1细胞STAT3、p-STAT3的影响Figure 4 Effect of Fufei Jian-containing serum on the protein expression levels of STAT3 and p-STAT3 in A549 and SPC-A1 cells
2.6 扶肺煎对Lewis荷瘤小鼠移植瘤生长、肺转移情况的影响 图5、表3 结果显示:扶肺煎低、高剂量组及顺铂组Lewis荷瘤小鼠瘤质量较模型组明显减小(P <0.01),抑瘤率分别为46.81%、78.72%、76.60%;扶肺煎高剂量组、顺铂组的肺转移结节数量较模型组明显减少(P <0.01),肺转移抑制率分别为0.82%、28.76%、33.82%。表明扶肺煎可抑制Lewis荷瘤小鼠移植瘤生长与肺转移。
2.7 扶肺煎对Lewis 荷瘤小鼠肺脏病理形态学的影响 图6 结果显示:模型组Lewis 荷瘤小鼠肺泡壁存在损伤、断裂,且细胞浸润增加;肺泡间隙中性粒细胞增多,肺部存在肿瘤转移小结节;转移的肿瘤由长梭形或短梭形细胞形成,呈编织状排列;细胞核椭圆形,色深,核仁不明显,胞浆丰富。扶肺煎高剂量组上述情况相对较好。表明Lewis 荷瘤小鼠存在肺转移,扶肺煎可减轻Lewis荷瘤小鼠的肺转移。
2.8 扶肺煎对Lewis荷瘤小鼠移植瘤组织Cyclin D1、CDK4 蛋白表达的影响 图7 结果显示:与模型组比较,扶肺煎高剂量组及顺铂组移植瘤组织Cyclin D1、CDK4蛋白表达水平均降低(P <0.05或P <0.01),表明扶肺煎可抑制Lewis 荷瘤小鼠移植瘤细胞增殖。

图5 各组Lewis荷瘤小鼠移植瘤大小比较Figure 5 Comparison of the Xenograft tumors size in Lewis tumor-bearing mice of various groups
表3 各组Lewis荷瘤小鼠移植瘤生长、肺转移情况比较Table 3 Comparison of the Xenograft tumors growth and lung metastasis in Lewis tumor-bearing mice of various groups (±s)

表3 各组Lewis荷瘤小鼠移植瘤生长、肺转移情况比较Table 3 Comparison of the Xenograft tumors growth and lung metastasis in Lewis tumor-bearing mice of various groups (±s)
①P <0.01,与模型组比较
组别模型组扶肺煎低剂量组扶肺煎高剂量组顺铂组瘤质量(g)0.47±0.07 0.25±0.05①0.10±0.04①0.11±0.06①抑瘤率(%)—46.81 78.72 76.60肺转移结节(个)6.12±1.06 6.07±0.35 4.36±0.57①4.05±0.76①肺转移抑制率(%)—0.82 28.76 33.82

图6 扶肺煎对Lewis荷瘤小鼠肺脏病理形态学的影响(HE染色,×100)Figure 6 Effect of Fufei Jian on the pathological features of lung tissue in Lewis tumor-bearing mice of various groups(HE staining,×100)
2.9 扶肺煎对Lewis荷瘤小鼠移植瘤组织p-STAT3表达的影响 图8结果显示:与模型组比较,扶肺煎低、高剂量组及顺铂组移植瘤组织p-STAT3 蛋白表达水平均降低(P <0.05 或P <0.01),表明扶肺煎可能通过抑制STAT3 蛋白的活化发挥抑制肿瘤增殖、转移的作用。
3 讨论
扶肺煎为本院效验多年的抗肺癌验方。方中:生晒参益气补正,北沙参养阴生津,并为君药;黄芪助生晒参补气,枸杞子助北沙参养阴,猫爪草祛肺毒,俱为臣药;复以蜈蚣清热,紫花地丁散结,天葵子散瘀,兼具解毒之效,均系佐药。诸药伍用,共收扶正补虚、养阴解毒之功。由于A549 细胞具有较高的增殖、侵袭迁移能力[8],而SPC-A1侵袭迁移能力相对较弱[9],故本研究选择A549、SPC-A1细胞株为研究对象观察扶肺煎对其抑制作用,对扶肺煎抗肿瘤的药理学机制进行评价。本研究结果表明,扶肺煎可抑制A549、SPC-A1 细胞的增殖,抑制A549 细胞的效果优于抑制SPC-A1 细胞的效果,且可抑制2 种细胞的迁移、侵袭,提示扶肺煎可能对A549细胞更为敏感。

图7 各组Lewis小鼠肺癌移植瘤组织Cyclin D1、CDK4蛋白表达比较Figure 7 Effect of Fufei Jian on the protein expression levels of Cyclin D1 and CDK4 in Xenograft tumor tissue from Lewis tumor-bearing mice

图8 扶肺煎对Lewis荷瘤小鼠移植瘤组织p-STAT3表达的影响Figure 8 Effect of Fufei Jian on the protein expression level of p-STAT3 in Xenograft tumor tissue from Lewis tumorbearing mice
Lewis 肺癌模型广泛应用于癌转移机制及抗肿瘤药物的筛选与干预研究,是理想的动物实验模型。本研究结果显示:在Lewis 肺癌移植瘤小鼠中,扶肺煎高剂量组及顺铂组具有较高的抑瘤率及肺转移抑制率;各组小鼠肺部均存在肿瘤细胞转移的现象,其中,模型组肺泡壁存在损伤、断裂,且细胞浸润增加,扶肺煎高剂量组情况相对较好。表明扶肺煎对Lewis肺癌移植瘤具有一定的抑制作用。
肿瘤转移是一个非常复杂的过程。肿瘤细胞会侵入周围的细胞,破坏正常组织的抗癌机制,经过突变、激增等过程之后最终扩散至各个健康组织。有研究表明,在肿瘤转移过程中,Cyclin D1扮演着重要角色[10]。Cyclin D1 蛋白是由原癌基因CCNDl 编码的细胞周期调控蛋白,癌基因STAT3等可诱导癌细胞Cyclin D1 蛋白的表达,与CDK4、CDK6 形成复合物Cyclin D1/CDK4、CDK6,使Rb蛋白磷酸化,驱动细胞从G1 期进入S 期[11]。本研究结果显示,无论体外还是体内实验,扶肺煎均可降低Cyclin D1、CDK4蛋白的表达水平,表明其对肿瘤细胞周期调控蛋白具有较好的抑制效果。
STAT3在恶性肿瘤的发生、发展和浸润、转移中起着重要的调控作用。正常生理情况下,STAT3的表达是一个瞬时过程,一般呈微弱表达[12]。而STAT3 的持续高表达往往引起正常细胞的恶性转化[13],STAT3 磷酸化并被激活后转移到细胞核内,通过SH2 结构域与Cyclin D1 启动子上的STAT3 位点结合而启动Cyclin D1 基因的表达[14],同时也促进抗凋亡基因Bcl-2、Bcl-xL[15-17]等表达,抑制肿瘤细胞凋亡,促进细胞周期进展,使弱转移肿瘤细胞转变为高转移癌细胞,并增加其在体内的癌转移。而AG490 作为STAT3 的抑制剂,可通过抑制STAT3的活化从而抑制肿瘤增殖[18]。本研究结果显示,扶肺煎可下调磷酸化STAT3 的体内外表达水平,效果接近STAT3 的抑制剂AG490。提示扶肺煎在体内可能通过抑制STAT3 的磷酸化水平,从而起到抑制肿瘤细胞增殖及迁移的作用。
综上所述,肺癌是目前人类发病率和死亡率最高的恶性肿瘤,侵袭和转移是肺癌患者死亡的重要原因。STAT3信号通路、细胞周期蛋白表达的变化是非小细胞肺癌研究的一项重要内容。本研究结果表明,扶肺煎能够通过抑制STAT3 蛋白的活化,降低Cyclin D1、CDK4的表达,起到控制肿瘤细胞生长及分化的作用,从而干预肿瘤转移的形成,结合其临床应用价值,值得进一步深入研究。
