三七的研究进展及其质量标志物预测分析
2021-05-10刘耀晨张铁军郭海彪张洪兵韩彦琪王德勤李楚源刘昌孝
刘耀晨,张铁军,郭海彪,许 浚,林 娟,张洪兵,韩彦琪,王德勤,李楚源*,刘昌孝
三七的研究进展及其质量标志物预测分析
刘耀晨1, 2,张铁军2, 3, 4,郭海彪5,许 浚2, 3, 4,林 娟5,张洪兵2, 3,韩彦琪2, 3,王德勤5,李楚源5*,刘昌孝3, 4*
1. 天津医科大学,天津 300070 2. 天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室,天津 300462 3. 天津药物研究院 天津市中药质量标志物重点实验室,天津 300462 4. 天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300462 5. 广州白云山和记黄埔中药有限公司,广东 广州 510515
三七是我国常用的大宗中药材,其中化学成分类型丰富,包括三萜皂苷、黄酮、氨基酸、多糖、挥发油等类成分,传统认为三萜皂苷类成分为其主要药效成分。从化学成分和药理作用等几个方面对三七的研究现状进行综述,在此基础上,根据中药质量标志物(quality marker,Q-Marker)理论,探究人参属药用植物亲缘关系,结合三七生源途径、传统功效、传统药性等研究对三七Q-Marker进行预测分析,预测三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rg2、人参皂苷Rd、三七素可作为Q-Marker的选择,以期为三七的质量控制和新标准的制定提供科学依据。
三七;三七皂苷R1;人参皂苷Rg1;人参皂苷Re;人参皂苷Rb1;人参皂苷Rg2;人参皂苷Rd;三七素;质量标志物
三七为五加科植物三七(Burk.) F. H. Chen的干燥根和根茎,性温,味甘、微苦,归肝、胃经,具有散瘀止血、消肿定痛的功效,主要用于治疗外伤出血、胸腹刺痛、跌扑肿痛等,含量测定以三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1为指标[1]。三七主要分布在中国的云南省,现代药理研究表明其具有止血、活血、抗炎、免疫调节、抗氧化、抗肿瘤、神经保护等作用[2]。随着对三七化学成分、药理作用及临床研究的逐步深入,其有效成分的研究也受到关注。本文对其化学成分和药理作用进行系统总结分析,并基于中药质量标志物(quality marker,Q-Marker)的理论,对三七的Q-Marker进行预测,为其质量控制研究及Q-Marker的选择提供依据。
1 化学成分
1.1 皂苷类成分
皂苷类化合物是三七主要的化学成分和有效成分。三七中皂苷类成分可分为原人参二醇型皂苷(protopanaxadiol)、原人参三醇型皂苷(protopanaxatriol)、侧链变化型皂苷及其他类型皂苷。三七中发现的原人参二醇型皂苷母核结构及化合物信息见图1和表1,原人参三醇型皂苷母核结构及化合物信息见图1和表2,侧链变化型皂苷母核结构及化合物信息见图2和表3,其他类型皂苷母核结构及化合物信息见图3和表4。
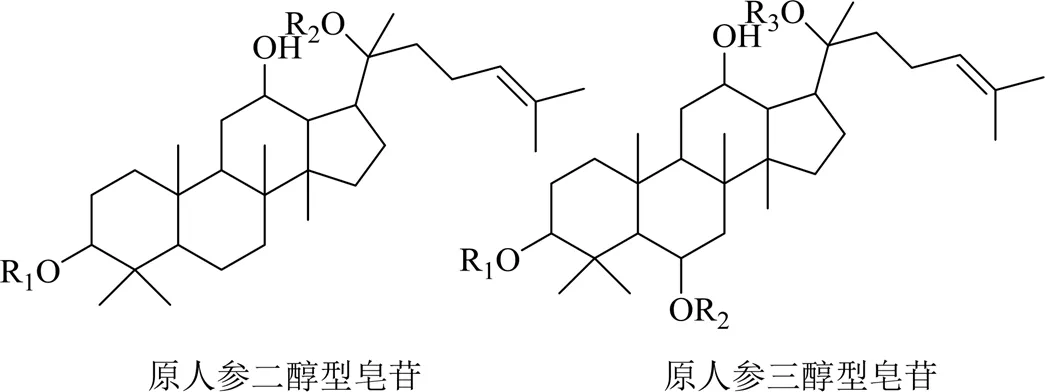
图1 三七中原人参二醇型和原人参三醇型皂苷的母核结构

表1 三七中原人参二醇型皂苷
Glc-β--吡喃型葡萄糖基 Xyl-β--吡喃型木糖基 Ara(p)-α--吡喃型阿拉伯糖基 Mal-丙二酰基,下同
Glc-β--glucopyranosyl Xyl-β--xylopyranosyl Ara(p)-α--arabinopyranosyl Mal-malonyl, same as below

表2 三七中原人参三醇型皂苷
Glc*-α--吡喃型葡萄糖基 Ac-乙酰基 Rha-α--吡喃型鼠李糖基 Bu-丁基,下同
Glc*-α--glucopyranosyl Ac-acetyl Rha-α--rhamnopyranosyl Bu-butyl, same as below
1.2 黄酮类成分
黄酮类化合物为三七主要有效成分之一,并具有多种药理活性。目前从三七中得到的黄酮类成分有槲皮素[25],槲皮素结构见图4。
1.3 氨基酸
三七中的三七素是一种非蛋白的氨基酸成分,是主要止血活性成分[26],三七素结构见图5。
1.4 多糖类成分
三七中的糖类主要含有鼠李糖、木糖、葡萄糖、高聚糖等。Ohtani等[27]从三七中分得一种多糖sanchinan A,其具有活化网状内皮组织系统效应;Gao等[28]从三七分离得到4个多糖类成分,分别为 PF3111、PF3112、PBGA11和PBGA12。近年来,Liu等[29]和Wang等[30]从三七中提取分离出2种具有药理活性的多糖成分,分别为PNPS-0.3、PNPS-0.5M。
1.5 其他成分
上述化合物类型是从三七中分离得到的主要化合物类型。随着对三七化学成分研究的深入,一些特殊成分也被发现,如多羟基吡嗪衍生物和核苷类。另外,三七中还含有人体必需的镁、磷、钙、锰、钠、铁、钴等微量元素。有报道指出,三七中还存在一种具有抗菌活性的蛋白pananotin[31]。三七炔醇类化合物在抗肿瘤、抗氧化等方面具有重要意义。林琦等[32]从三七石油醚部位首次分离得到人参炔醇和人参环氧炔醇。有研究报道,在三七绒根中存在β-谷甾醇[33]。
2 药理作用
三七具有活血与止血双向调节和抗炎作用,现代药理研究发现三七在抗肿瘤、神经保护、降糖等方面同样具有药理活性。三七中的皂苷类成分药理作用广泛,包括活血、抗炎、免疫调节、抗氧化、抗肿瘤、神经保护、降糖等方面。三七素为三七中主要的止血成分。三七黄酮主要具有活血、抗炎作用。
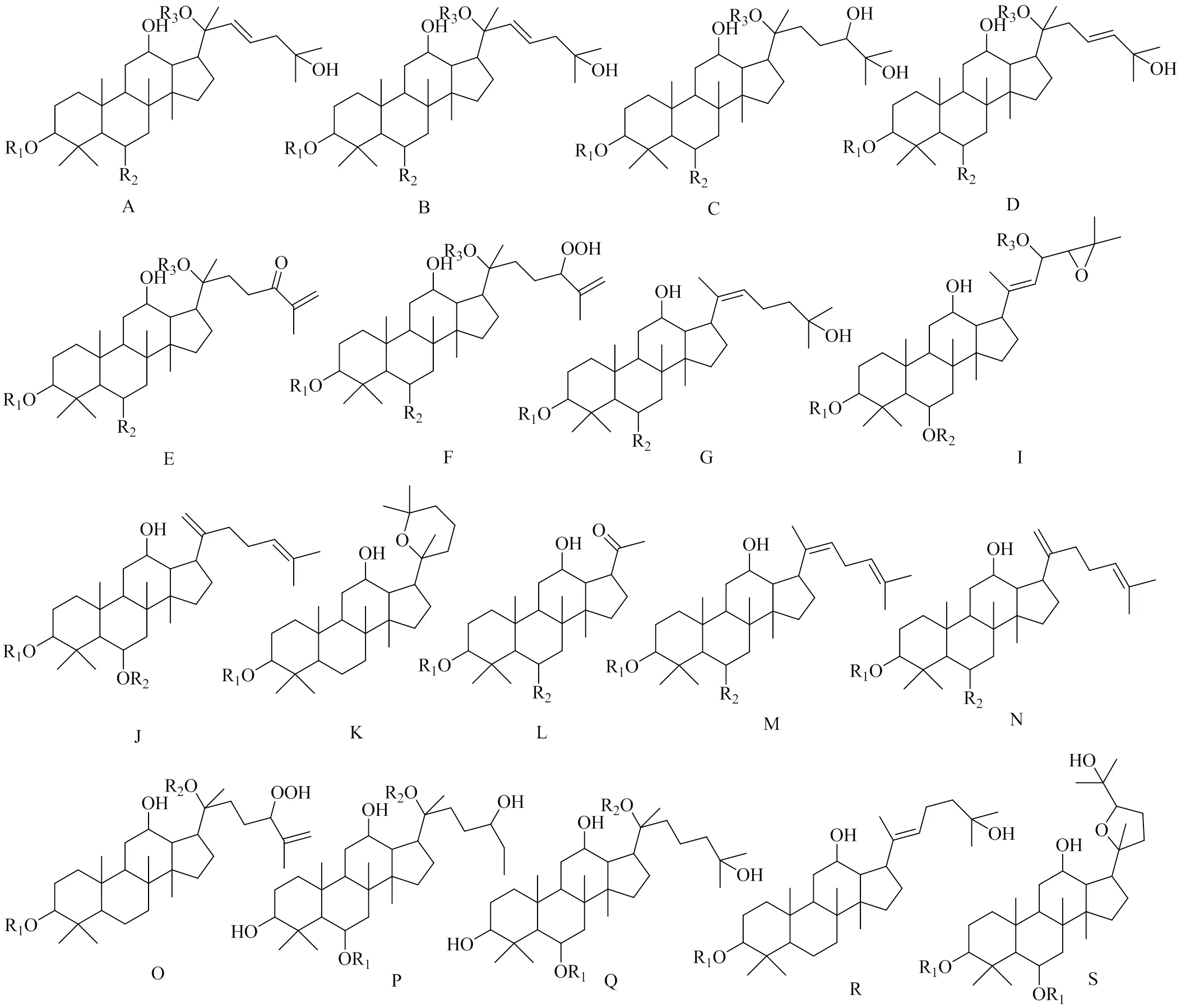
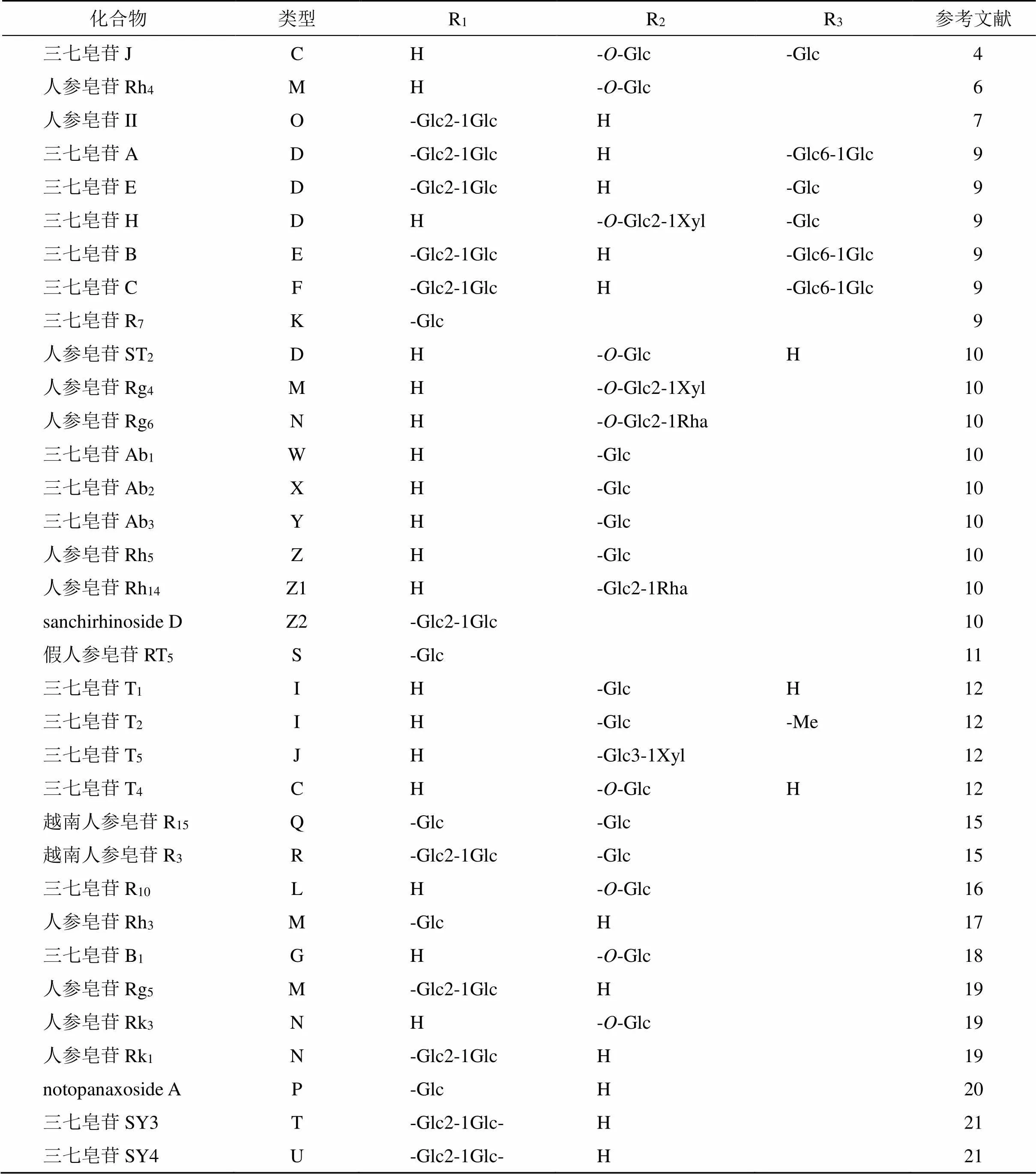
表3 三七中C17侧链变化型皂苷
2.1 活血作用
三七总皂苷(saponins,PNS)可增加过氧化物酶体增殖物激活受体γ蛋白的表达,激活血小板磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)通路,抑制凝血酶诱导的血小板聚集[34]。人参皂苷Rg1可抑制凝血酶诱导的血小板黏附和聚集[35]。人参皂苷Re能增加细胞内的环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平,并能够抑制二磷酸腺苷诱导的血小板聚集[36]。人参皂苷Rg2具有一定的抗血小板聚集活性,有潜在的凝血因子X的抑制活性[37]。

图3 三七中其他类型皂苷母核结构

表4 三七中其他类型皂苷
Ara(f)-α--呋喃型阿拉伯糖基
Ara(f)-α--arabifuranose
图4 槲皮素的结构
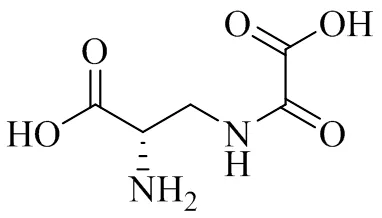
图5 三七素的结构
血管内皮生长因子(vascular endothelial growth factor,VEGF)被认为是形成新生血管的最强因子,人参皂苷Rg1通过PI3K/Akt/mTOR信号通路上调VEGF的表达,促进缺血性脑卒中后的血管生成[38]。三七皂苷R1可上调大鼠缺血心肌VEGF表达,促进血管新生[39]。人参皂苷Rb1可促进VEGF等促血管生成因子的表达,改善血液循环[40]。
此外,三七的活血作用还表现在促进纤溶系统和舒张血管方面。人参皂苷Rg1可增加组织型纤溶酶原激活物的活性,使纤溶系统的活性升高,促进纤维蛋白溶解[41]。三七皂苷R1可上调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达使一氧化氮(NO)的合成增加,提示其舒张血管机制可能与NO有关[42]。人参皂苷Re可增加血管内皮细胞中NO的释放,刺激血管舒张[43]。人参皂苷Rg1通过增加eNOS的磷酸化,激活PI3K/Akt/eNOS途径增加内源性NO的释放[44]。槲皮素对高血压大鼠具有剂量依赖性和内皮依赖性的舒张血管作用,其舒张作用与内皮NO有关[45]。
2.2 止血作用
三七中起止血作用的主要成分为三七素,三七素通过与血小板α-氨基-3-羟基-5-甲基-4-异噁唑丙酸受体结合,调控血小板钙内流和cAMP合成,并增加血栓素A2的释放来增强旁分泌方式下的血小板活化[46];明显提高网状血小板数量,调节血小板生成素和白细胞介素-6(interleukin-6,IL-6)在内的造血因子恢复到正常水平[47]。舒斌等[48]观察注射用三七素止血促凝的作用时发现,其可明显缩短多种动物模型的出血时间,促进血液凝固,并降低模型动物毛细血管通透性,同时通过促进血液凝结和抑制纤溶发挥止血作用。
2.3 抗炎作用
PNS可显著抑制脂多糖诱导的RAW 264.7细胞中炎症因子NO、iNOS的产生,并能下调RAW 264.7细胞磷酸化核因子-κB(nuclear factor-κB,NF-κB)表达水平,能通过调节iNOS-NO-NF-κB信号通路,抑制炎症反应[49]。三七皂苷R1可下调糖尿病肾病大鼠炎症细胞因子水平,通过抑制转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad3信号通路来调节糖尿病肾病大鼠肾脏纤维化[50]。人参皂苷Rb1可降低肠缺血/再灌注模型大鼠机体炎症因子表达,通过激活PI3K/Akt/核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)信号通路减轻再灌注损伤[51]。人参皂苷Rd能通过降低IL-1β、肿瘤坏死因子-β、IL-6、环氧化酶-2和iNOS的表达,抑制IL-1α诱导的软骨细胞炎症反应[52]。人参皂苷Rg1能下调脂多糖诱导的炎症细胞因子的表达,减少Toll样受体4、NF-κB和NOD样受体3的表达,减轻脂多糖诱导的心肌细胞炎症反应和凋亡[53]。槲皮素能够通过调节NF-κB的活性,发挥抗炎作用[54]。
2.4 免疫调节作用
三七在免疫性疾病的治疗上有着良好的应用前景,皂苷类成分是其发挥免疫调节的主要活性成分。研究发现,PNS可上调哮喘小鼠β干扰素的分泌,抑制IL-4的分泌,调节T细胞亚群的分化,使Th1/Th2恢复平衡状态,减轻气道炎症反应[55]。细胞因子在机体免疫中起重要作用,Yang等[56]通过实验观察,发现人参皂苷Rd可增强刀豆蛋白诱导的小鼠脾细胞IL-2、γ干扰素、IL-4和IL-10的表达,对细胞及体液免疫均有诱导作用。
2.5 抗氧化作用
抗氧化是抗氧化自由基的简称,当体内氧自由基生成过多无法清除时,体内的氧化系统与抗氧化水平失衡,导致机体过度氧化而造成组织功能损害。有学者通过药理实验发现,PNS可抑制活性氧的积累,减少H2O2诱导的大鼠星形胶质细胞的死亡[57];人参皂苷Rg2可增强EVC-304细胞的抗氧化作用[58]。
2.6 抗肿瘤作用
三七总皂苷可上调抑制癌细胞转移相关基因的表达,抑制乳腺癌细胞的转移[59]。TGF-β信号传导在乳腺癌发生和转移中起着重要作用,Smad2在将TGF-β信号从细胞表面受体传导至细胞核的过程中起关键性作用,人参皂苷Rd能抑制Smad2的表达,抑制乳腺癌的转移[60]。
2.7 神经保护作用
Zhou等[61]研究表明,PNS通过调节谷氨酸代谢,抑制-甲基--天冬氨酸受体活化,减轻趋化因子CCL2诱导的大鼠记忆障碍。三七单体皂苷对记忆力也有改善作用,β-淀粉样蛋白(amyloid β-protein,Aβ)具有很强的神经毒性作用,与神经元的退行性病变有关,三七皂苷R1可抑制神经元细胞上K+通道,改善神经冲动传导,提高阿尔茨海默病(Alzheimer disease,AD)小鼠的记忆能力[62];淀粉样前体蛋白集中表达于神经元突触,与AD发生有着密切联系,人参皂苷Rg1具有神经保护作用,能抑制β-蛋白酶的合成,减少Aβ的产生,增强记忆力[63]。
2.8 降糖作用
Chen等[64]发现PNS可以显著维持遗传性2型糖尿病KK-Ay小鼠体内葡萄糖稳态,明显降低升糖负荷、胰岛素抵抗指数和血清三酰甘油水平。Yang等[65]研究表明,PNS可降低KK-Ay小鼠空腹血糖,人参皂苷Rb1是PNS中发挥降糖的主要成分。
3 Q-Marker的预测分析
3.1 基于化学成分特有性的Q-Marker预测分析
人参属植物分布于北美洲东部及亚洲东部,在中国有6个种,3个变种,在北美洲有2个种[66]。除三七外,常用药用植物有人参C. A. Mey、西洋参L.、珠子参C. A. Meyer. var.(Burk.) C. Y. Wu et K. M. Frng、竹节参(T. Nees) C. A. Mey.。成分“特有性”的形成与植物亲缘学及其次生代谢产物生物合成途径、地理分布、入药部位等密切相关。
人参属内化学成分类型和存在规律与其种系发生、起源与演化、地理分布等相关。与人参属祖种亲缘关系近的类群含有该属的原始化学成分,分布于属的原始种保存地;与祖种亲缘关系较远的类群含有该属的新生(进化)化学成分,分布于属的进化中心或多样中心[67]。应当注意的是,原始种保存地与进化中心或多样中心可能是一致的[68]。人参属植物始发中心位于中国太行山脉及辽南山地,属东亚-北美间断分布的植物区系,中国横断山脉和中部、云南东南部及其相邻地区为该属的进化中心和多样性中心[69]。人参属植物于第4纪前从始发中心迁移至我国各地及分别通过白令海峡与朝鲜海峡迁移至现北美与日本等地,后由于冰河时期环境剧变,导致大部分地区人参属植物灭绝,仅现存人参属植物生存区存活,其中迁至我国西南地区的类群保持祖先原有倍性,并经过不断地选择和进化,形成现在多个物种,如三七、珠子参、竹节参(中国)等,三七为3者中最早分化产生的物种;迁至长白山山脉、西伯利亚地区等地的类群由于纬度较高,为适应环境的变化,导致倍性加倍,并由于地域间隔,各自形成现有物种,如人参、西洋参等[70-73]。三七与人参为生长在天然避难所的孑遗物种,且三七可能比人参更加古老。结合地下部分形态特征,人参属划分为两大类群:第一类群被认为是古老类群,典型植物有人参、西洋参、三七;第二类群被认为是进化的类群,典型植物有竹节参、珠子参等[74]。
人参属古老类群的特征性成分组包括:①氨基酸-三七素;②以达玛烷型四环三萜皂苷为主的皂苷成分[66]。三七不含齐墩果烷型五环三萜皂苷,这与人参、西洋参有所区别,且三七含有特有皂苷类成分三七皂苷R1等,共有成分(人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1)比例存在明显差异[75],人参皂苷Rg1、Re与Rb1在人参中的比例约为1.7︰1︰1.5,在西洋参中的比例约为0.2︰1︰1.2,在三七中的比例约为8︰1︰7。三七素在三七中的含量最多,人参次之,西洋参最低[76]。
PNS的主要成分为人参皂苷Rb1、人参皂苷Rg1、三七皂苷R1等达玛烷型四环三萜皂苷。目前,对植物达玛烷型四环三萜皂苷的生物合成途径已有初步的认识,研究认为植物达玛烷型四环三萜皂苷的合成主要通过乙酸/甲羟戊酸途径[77],见图6。一般可分为3个阶段:①合成异戊烯基焦磷酸(isopentenyldiphosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallylpyrophosphate,DMAPP);②由异戊烯基转移酶和萜类环化酶催化IPP和DMAPP形成2,3-氧化鲨烯;③2,3-氧化鲨烯依次经过环化、羟基化、糖基化修饰后最终形成三萜类皂苷,但糖基化步骤仍有待鉴定。目前已鉴定出三七中8种参与皂苷类成分(三七皂苷R1、人参皂苷Rg1、Rd、Rb1、F1、Rh2、CK、Rg3)生物合成途径的糖基转移酶(3-29、3-31、3-32、3-32-i5等)[78]。三七素主要分布于山黧豆属、人参属等植物中,先前研究表明,山黧豆L.中三七素由β-异唑啉-5-酮丙氨酸合成。而在三七中未检测到β-异唑啉-5-酮丙氨酸的前体物质异唑-5-酮,表明三七中三七素生物合成可能有别于山黧豆[79]。三七中潜在的三七素合成路径见图7。可以看出,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1及三七素处于生源途径的下游位置,特有性较强。
药用植物次生代谢产物生物合成具有组织和器官的特异性。三七药材为其原植物的根和根茎,其中主根为临床主要药用部位。此外,三七药用部位还包括侧根、须根部分。另外,民间也有使用三七叶和三七花的情况。三七地上部位以原人参二醇型皂苷为主,而地下部位以原人参三醇型皂苷为主,且三七皂苷R1为特征性成分[80-81]。
通过成分特有性分析,将三七素、三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1作为三七Q-Marker的选择对象。
3.2 基于化学成分与有效性相关证据的Q-Marker预测分析
3.2.1 化学成分与传统功效的相关性 传统功效(功能主治)是中药有效性的概括,也是临床用药的依据。Q-Marker作为评价和控制中药有效性的主要指标,须与有效性相结合。三七具有散瘀止血、消肿止痛的功效。三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rg2、人参皂苷Rd等皂苷类成分具有扩张血管、抑制血小板凝集、延长凝血时间、抗炎等作用。三七素是三七发挥止血作用的主要活性成分。槲皮素具有活血、抗炎作用。因此,三七中的三七素、槲皮素、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rg2、人参皂苷Rd可作为Q-Marker的主要选择。
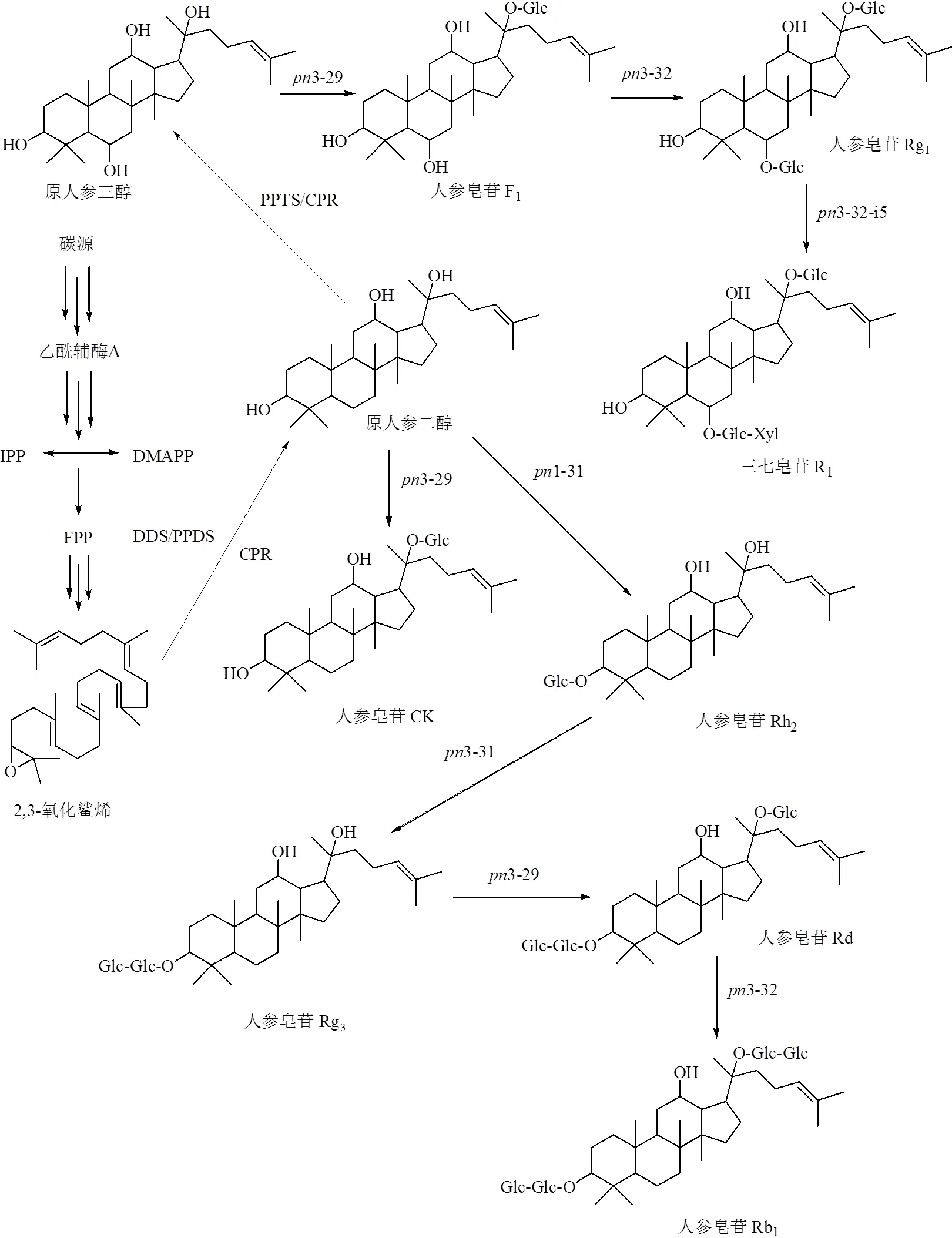
FPP-法呢基二磷酸酯 CPR-细胞色素P450还原酶 DDS-达玛烯二醇合成酶 PPDS-原人参二醇合成酶 PPTS-原人参三醇合成酶
3.2.2 化学成分与传统药性的相关性 药性是中药的基本属性和有效性的核心内容之一,也应作为Q-Marker确定的依据之一。《中国药典》2020年版收载三七性味甘、微苦,温;归肝、胃经。甘“能补、能缓、能和”,苦“能泄、能燥、能坚”。常学辉等[82]认为甘味药多含有苷类、氨基酸等成分,这与三七中皂苷类、氨基酸类成分对应。严永清等[83]通过研究460种常用苦味中药中的化学成分,发现苦味药中多含生物碱,其次为萜类、苷类,这与三七中皂苷类成分对应。王小雪等[84]对归肝经中药中的化学成分分析发现,黄酮类、有机酸类、挥发油、萜类、苷类、生物碱类、糖类是归肝经中药的主要成分。根据以上分析,三七中的皂苷、氨基酸、黄酮类成分应是其“性味”的主要物质基础,也应是Q-Marker的主要选择。
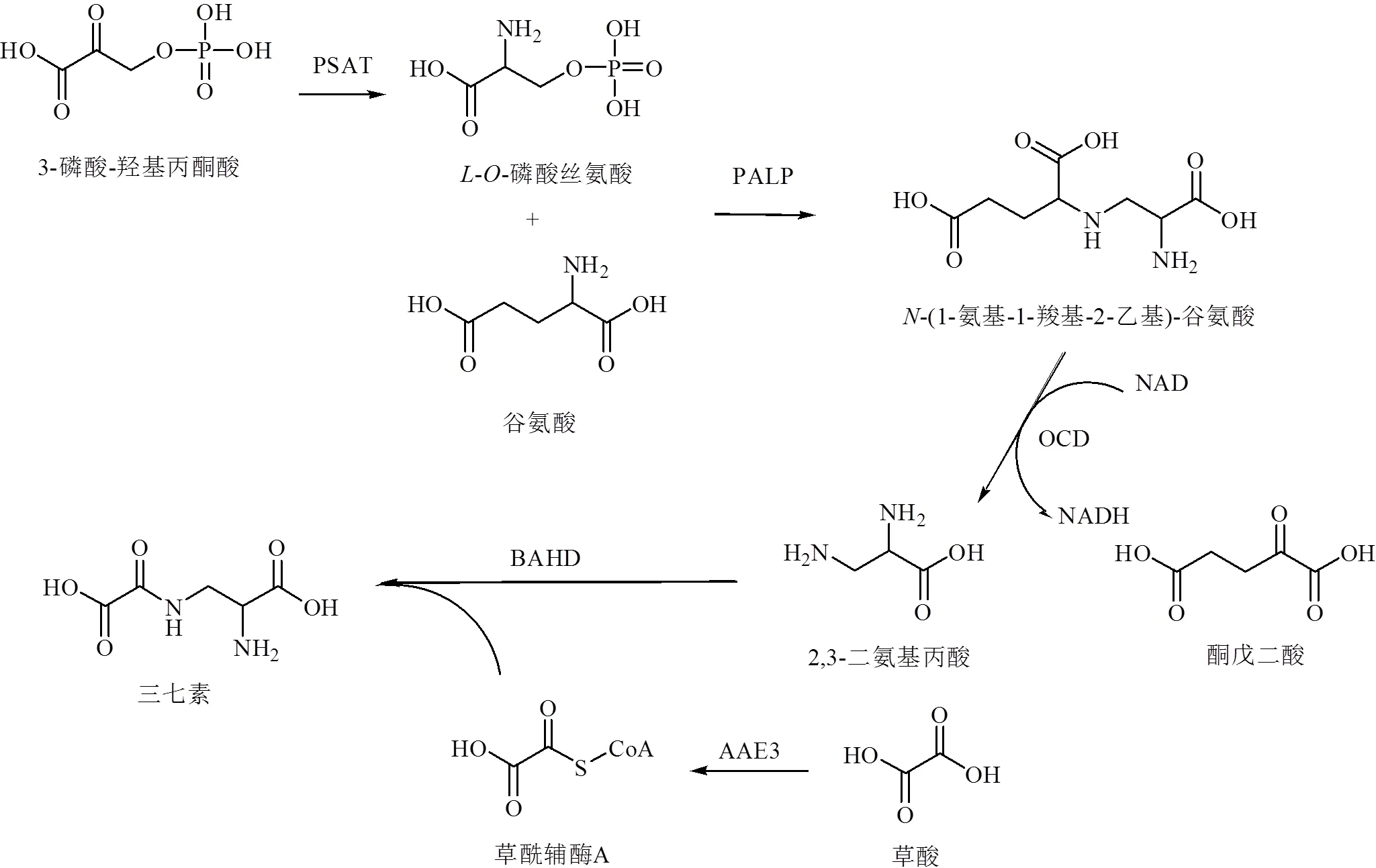
PSAT-3-磷酸丝氨酸氨基转移酶 PALP-II类PLP依赖性酶 OCD-鸟氨酸环脱氨酶 AAE3-酰基活化酶3 BAHD-BAHD酰基转移酶家族
3.3 基于化学成分可测性的Q-Marker预测分析
化学成分的可测性也是Q-Marker确定的重要依据。《中国药典》2020年版规定三七中人参皂苷Rg1、人参皂苷Rb1和三七皂苷R1的测定方法及限度要求[1]。郑丽华等[85]采用高效液相色谱法对三七总皂苷中5种成分(三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd)进行了同时测定。崔秀明等[86]采用HPLC分析不同产地、不同规格、不同采收期三七及其不同部位中的三七素含量。综上所述,三七中的皂苷、三七素均可通过一定的分析方法进行定量检测。以上成分与其有效性密切相关,是其可能的主要药效物质基础,可作为其Q-Marker。宜根据不同化学成分的差异,建立专属性测定方法,为质量评价标准的建立提供科学依据。
4 结语
三七为历代本草著作和各版《中国药典》所收载,具有广泛的药理活性,近年来对三七的研究取得了较大进展,三七多方面的药用价值使其开发利用前景广阔。三七是我国常用的大宗中药材,市场需求量日益增大,市场上三七掺假的情况时有发生。因此,建立科学、合理的质量评价方法,对三七的质量进行全面、准确地评价并指导三七从产地、采收、加工、贮藏的合理利用,对于三七产业的健康发展具有重要的现实意义。
中药质量反映和表征中药有效性和安全性,是中医临床用药和中成药有效性控制的重要依据。本文从化学成分、药理作用2个方面对三七的研究现状进行了总结,在对化学成分、药理作用综述的基础上,以中药Q-Marker的理论为指导,根据人参属植物亲缘学关系及次生代谢产物生源途径,结合有效成分、与药性相关成分、可测成分对三七Q-Marker的筛选和确定进行了文献分析,为其Q-Marker的选择提供了依据,其中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rg2、人参皂苷Rd、三七素等成分可考虑作为三七的候选Q-Marker。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 11.
[2] 庞丹清, 陈勇, 刘玟君, 等. 三七药理作用研究进展 [J]. 大众科技, 2018, 20(9): 49-51.
[3] Qiu L, Jiao Y, Huang G K,. New dammarane-type saponins from the roots of[J]., 2014, 97(1): 102-111.
[4] Yoshikawa M, Morikawa T, Yashiro K,. Bioactive saponins and glycosides. XIX. notoginseng (3): Immunological adjuvant activity of notoginsenosides and related saponins: Structures of notoginsenosides-L, -M, and -N from the roots of(Burk.) F. H. Chen [J]., 2001, 49(11): 1452-1456.
[5] Liu J H, Wang X, Cai S Q,. Analysis of the constituents in the Chinese drug notoginseng by liquid chromatography–electrospray mass spectrometry [J]., 2004, 13(4): 225-237.
[6] 曾江, 崔秀明, 周家明, 等. 三七根茎的化学成分研究 [J]. 中药材, 2007, 30(11): 1388-1391.
[7] 宋建平, 曾江, 崔秀明, 等. 三七根茎的化学成分研究(Ⅱ) [J]. 云南大学学报: 自然科学版, 2007, 29(3): 287-290.
[8] Luo S L, Dang L Z, Li J F,. Biotransformation of saponins by endophytes isolated from[J]., 2013, 10(11): 2021-2031.
[9] 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展 [J]. 中草药, 2015, 46(9): 1381-1392.
[10] Li Q, Yuan M, Li X,. New dammarane-type triterpenoid saponins fromsaponins [J]., 2020, 44(5): 673-679.
[11] Lifeng H, Kaunda J, Lili L,. Saponins from roots of[J]., 2014, 6(2): 159-163.
[12] Teng R W, Li H Z, Wang D Z,. Hydrolytic reaction of plant extracts to generate molecular diversity: New dammarane glycosides from the mild acid hydrolysate of root saponins of[J]., 2004, 87(5): 1270-1278.
[13] Sun H X, Yang Z G, Ye Y P. Structure and biological activity of protopanaxatriol-type saponins from the roots of[J]., 2006, 6(1): 14-25.
[14] Cui X M, Jiang Z Y, Zeng J,. Two new dammarane triterpene glycosides from the rhizomes of[J]., 2008, 10(9/10): 845-849.
[15] 刘利民, 张晓琦, 汪豪, 等. 三七主根的微量皂苷类成分研究 [J]. 中国药科大学学报, 2011, 42(2): 115-118.
[16] Li H Z, Teng R W, Yang C R,. A novel hexanordammarane glycoside from the roots of[J]., 2001(1):59-62.
[17] Zhang Y C, Liu C M, Qi Y J,. Application of accelerated solvent extraction coupled with counter-current chromatography to extraction and online isolation of saponins with a broad range of polarity from[J]., 2013, 106: 82-89.
[18] 张静静, 刘桂芹, 王庆鹏, 等. 植物三七中皂苷类化学成分的研究进展 [J]. 聊城大学学报: 自然科学版, 2018, 31(2): 43-52,59.
[19] Wang D, Liao P Y, Zhu H T,. The processing ofand the transformation of its saponin components [J]., 2012, 132(4): 1808-1813.
[20] Komakine N, Okasaka M, Takaishi Y,. New dammarane-type saponin from roots of[J]., 2006, 60(2): 135-137.
[21] Yang C K, Xiong J, Zhang L,. Two new dammarane-type triterpenoids from the steamed roots of[J]., 2020, doi: 10.1080/10286020.2020. 1825391
[22] 倪开岭, 韩立峰, 赵楠, 等. 三七根茎中的1个新达玛烷型三萜皂苷 [J]. 中草药, 2019, 50(10): 2273-2278.
[23] Wan J B, Zhang Q W, Hong S J,. 5, 6-Didehydroginsenosides from the roots of[J]., 2010, 15(11): 8169-8176.
[24] Yuan C, Xu F X, Huang X J,. A novel 12, 23-epoxy dammarane saponin from[J]., 2015, 13(4): 303-306.
[25] 黄周艳, 刘玟君, 陈勇, 等. 三七黄酮研究进展 [J]. 辽宁中医药大学学报, 2020, 22(1): 81-84.
[26] Kosuge T, Yokota M, Ochiai A. Studies on antihemorrhagic principles in the crude drugs for hemostatics. II. On antihemorrhagic principle in Sanchi Ginseng Radix (author's transl) [J]., 1981, 101(7): 629-632.
[27] Ohtani K, Mizutani K, Hatono S,. Sanchinan-A, a reticuloendothelial system activating Arabinogalactan from Sanchi-ginseng (roots of) [J]., 1987, 53(2): 166-169.
[28] Gao H, Wang F Z, Lien E J,. Immunostimulating polysaccharides from[J]., 1996, 13(8): 1196-1200.
[29] Liu S N, Yang Y, Qu Y,. Structural characterization of a novel polysaccharide fromresidue and its immunomodulatory activity on bone marrow dendritic cells [J]., 2020, 161: 797-809.
[30] Wang C X, Zheng L Y, Liu S N,. A novel acidic polysaccharide from the residue ofand its hepatoprotective effect on alcoholic liver damage in mice [J]., 2020, 149: 1084-1097.
[31] Lam S K, Ng T B. Isolation of a small chitinase-like antifungal protein from(Sanchi ginseng) roots [J]., 2001, 33(3): 287-292.
[32] 林琦, 赵霞, 刘鹏, 等. 三七脂溶性化学成分的研究 [J]. 中草药, 2002, 33(6): 490-492.
[33] 魏均娴, 王菊芬, 张良玉, 等. 三七的化学研究: I. 三七绒根的成份研究 [J]. 药学学报, 1980, 15(6): 359-364.
[34] Shen Q, Li J, Zhang C X,.saponins reduce high-risk factors for thrombosis through peroxisome proliferator-activated receptor -γ pathway [J]., 2017, 96: 1163-1169.
[35] 张立海, 慈慧, 管涛. 三七止血与活血化瘀双向调节作用的临床应用 [J]. 首都医药, 2014, 21(18): 65-66.
[36] 刘晓春, 张瑞英. 人参皂苷Re抗血小板聚集及作用机制研究 [J]. 山西医药杂志, 2015, 44(14): 1610-1612.
[37] Li C T, Wang H B, Xu B J. A comparative study on anticoagulant activities of three Chinese herbal medicines from the genusand anticoagulant activities of ginsenosides Rg1and Rg2[J]., 2013, 51(8): 1077-1080.
[38] Chen J M, Zhang X J, Liu X X,. Ginsenoside Rg1 promotes cerebral angiogenesis via the PI3K/Akt/mTOR signaling pathway in ischemic mice [J]., 2019, 856: 172418.
[39] 方芳. 三七皂苷R1对AngⅡ诱导动脉粥样硬化的影响及机制研究 [D]. 武汉: 湖北中医药大学, 2019.
[40] 张潇, 张金枝, 刘真真, 等. 人参皂苷Rb1对脑梗死大鼠血管新生的作用及机制研究 [J]. 解放军医药杂志, 2019, 31(4): 10-15.
[41] 赵玉珑. 不同来源三七的“谱—效”关系及其抗凝血有效成分的研究 [D]. 杨凌: 西北农林科技大学, 2013.
[42] Wang Y Y, Ren Y, Xing L L,. Endothelium-dependent vasodilation effects ofand its main components are mediated by nitric oxide and cyclooxygenase pathways [J]., 2016, 12(6): 3998-4006.
[43] Huang Y C, Chen C T, Chen S C,. A natural compound (ginsenoside Re) isolated fromas a novel angiogenic agent for tissue regeneration [J]., 2005, 22(4): 636-646.
[44] Leung K W, Cheng Y K, Mak N K,. Signaling pathway of ginsenoside-Rg1 leading to nitric oxide production in endothelial cells [J]., 2006, 580(13): 3211-3216.
[45] 刘慧芳, 欧阳迎春, 刘应才, 等. 槲皮素对高血压大鼠主动脉环的舒张作用及机制 [J]. 四川医学, 2008, 29(11): 1457-1459.
[46] Huang L F, Shi H L, Gao B,. Decichine enhances hemostasis of activated platelets via AMPA receptors [J]., 2014, 133(5): 848-854.
[47] Ding S L, Wang M, Fang S,. D-dencichine regulates thrombopoiesis by promoting megakaryocyte adhesion, migration and proplatelet formation [J]., 2018, 9: 297.
[48] 舒斌, 林娜, 丁亚军. 注射用三七素对动物实验性损伤的止血作用 [J]. 云南中医学院学报, 2018, 41(3): 12-16.
[49] 冯晓异, 赵微, 何朋伦, 等. 三七总皂苷调节iNOS-NO-NF-κB信号通路抑制LPS诱导的RAW246.7细胞炎症研究 [J]. 药物评价研究, 2020, 43(4): 670-675.
[50] 高利超, 徐兵, 刘永安, 等. 三七皂苷R1抑制TGF-β1/Smad3信号传导对糖尿病肾病大鼠肾脏纤维化和炎症细胞因子的调节作用研究 [J]. 中国免疫学杂志, 2020, 36(10): 1188-1193.
[51] Chen S, Li X, Wang Y,. Ginsenoside Rb1 attenuates intestinal ischemia/reperfusion‑induced inflammation and oxidative stress via activation of the PI3K/Akt/Nrf2 signaling pathway [J]., 2019, 19(5): 3633-3641.
[52] Zhang W J, Liu Y, Wei J S,. Ginsenoside Rd inhibits IL-1β-induced inflammation and degradation of intervertebral disc chondrocytes by increasing IL1RAP ubiquitination [J]., 2019, 52(9): e8525.
[53] Luo M, Yan D S, Sun Q S,. Ginsenoside Rg1 attenuates cardiomyocyte apoptosis and inflammation via the TLR4/NF-kB/NLRP3 pathway [J]., 2020, 121(4): 2994-3004.
[54] Si TL, Liu Q, Ren YF,. Enhanced anti-inflammatory effects of DHA and quercetin in lipopolysaccharide induced RAW 264. 7 macrophages by inhibiting NF-κB and MAPK activation [J]., 2016, 14(1): 499-508.
[55] 赵文娟. 三七总皂苷调节哮喘小鼠气道炎症及Th亚群相关细胞因子的实验研究 [D]. 昆明: 云南大学, 2012.
[56] Yang Z G, Chen A, Sun H X,. Ginsenoside Rd elicits Th1 and Th2 immune responses to ovalbumin in mice [J]., 2007, 25(1): 161-169.
[57] Zhou N N, Tang Y, Keep R F,. Antioxidative effects ofsaponins in brain cells [J]., 2014, 21(10): 1189-1195.
[58] Xin X J, Zhong J J, Wei D Z,. Protection effect of 20()-ginsenoside Rg2extracted from culturedcells on hydrogen peroxide-induced cytotoxity of human umbilical cord vein endothelial cells[J]., 2005, 40(10): 3202-3205.
[59] Kim B, Kim E Y, Lee E J,.inhibits tumor growth through activating macrophage to M1 polarization [J]., 2018, 46(6): 1369-1385.
[60] Wang P, Du X, Xiong M,. Ginsenoside Rd attenuates breast cancer metastasis implicating derepressing microRNA-18a-regulated Smad2 expression [J]., 2016, 6: 33709.
[61] Zhou Y J, Chen J M, Sapkota K,.saponins attenuate CCL2-induced cognitive deficits in rats via anti-inflammation and anti-apoptosis effects that involve suppressing over-activation of NMDA receptors [J]., 2020, 127: 110139.
[62] Yan S, Li Z, Li H,. Notoginsenoside R1 increases neuronal excitability and ameliorates synaptic and memory dysfunction following amyloid elevation [J]., 2014, 4: 6352.
[63] Liu S Z, Cheng W, Shao J W,. Notoginseng saponin Rg1prevents cognitive impairment through modulating APP processing in Aβ1-42-injected rats [J]., 2019, 39(2): 196-203.
[64] Chen Z H, Li J, Liu J,. Saponins isolated from the root ofshowed significant anti-diabetic effects in KK-Ay mice [J]., 2008, 36(5): 939-951.
[65] Yang C Y, Wang J, Zhao Y,. Anti-diabetic effects ofsaponins and its major anti-hyperglycemic components [J]., 2010, 130(2): 231-236.
[66] 鲁歧, 富力, 李向高. 人参属植物分类学的研究进展 [J]. 吉林农业大学学报, 1992, 14(4): 107-111.
[67] 张铁军, 白钢, 刘昌孝. 中药质量标志物的概念、核心理论与研究方法 [J]. 药学学报, 2019, 54(2): 187-196.
[68] 王荷生. 植物区系地理 [M]. 北京: 科学出版社, 1992: 23.
[69] 鲁歧, 富力, 李向高. 人参属植物的生物学演变 [J]. 人参研究, 1992, 4(4): 1-5.
[70] Zuo Y J, Wen J, Zhou S L. Intercontinental and intracontinental biogeography of the eastern Asian - Eastern North American disjunct(the ginseng enus, Araliaceae), emphasizing its diversification processes in eastern Asia [J]., 2017, 117: 60-74.
[71] 梁韶, 宋娟, 雷秀娟, 等. 四种人参属药用植物的核型分析 [J]. 人参研究, 2017, 29(2): 6-10.
[72] 刘常坤. 人参属系统发育基因组学及超级条形码研究 [D]. 昆明: 云南大学, 2018.
[73] 史凤雪. 人参属系统发育与多倍化研究 [D]. 长春: 东北师范大学, 2016.
[74] 周荣汉, 段金廒. 植物化学分类学 [M]. 上海: 上海科学技术出版, 2005: 895-910.
[75] 刘永利, 雷蓉, 王晓蕾, 等. 基于中药质量标志物的人参、西洋参、三七及相关中成药质量控制方法研究 [J]. 中国药学杂志, 2019, 54(17): 1402-1410.
[76] 郑毅男, 李向高, 师绯, 等. 人参属植物止血成分的比较分析 [J]. 人参研究, 1991, 3(1): 46-47.
[77] Jung J D, Park H W, Hahn Y,. Discovery of genes for ginsenoside biosynthesis by analysis of ginseng expressed sequence tags [J]., 2003, 22(3): 224-230.
[78] Wang D, Wang J, Shi Y,. Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products ofusing a synthetic biology platform [J]., 2020, 61: 131-140.
[79] Yang Z J, Liu G Z, Zhang G H,. The chromosome-scale high-quality genome assembly ofprovides insight into dencichine biosynthesis [J]., 2021, doi: 10.1111/pbi.13558.
[80] 朱洁, 张洪彬. HPLC-ELSD检测技术测定三七不同部位中皂甙的含量 [J]. 昆明医学院学报, 2004, 25(S1): 31-34.
[81] 张雯洁, 张贇华, 李忠琼. 三七不同部位皂苷类成分的HPLC指纹特征研究 [J]. 中药材, 2003, 26(3): 181-182.
[82] 常学辉, 张华军. 论中药四气五味的科学性 [J]. 内蒙古中医药, 2000, 19(S1): 72.
[83] 严永清, 吴建新. 药物的苦味与归经、作用及化学成分的关系 [J]. 现代应用药学, 1987, 4(5): 12-15.
[84] 王小雪, 卢杉, 郑思悦, 等. 归经中药化学成分、药理作用及临床应用的实证分析 [J]. 中华中医药杂志, 2018, 33(11): 5193-5197.
[85] 郑丽华, 卢昌均, 周志昆, 等. HPLC测定三七总皂苷中5种皂苷的含量及稳定性考察 [J]. 中医药临床杂志, 2012, 24(1): 73-75.
[86] 崔秀明, 徐珞珊, 王强, 等. 三七中三七素的含量测定 [J]. 中国药学杂志, 2005, 40(13): 1017-1019.
Research progress onetand predictive analysis on its Q-Marker
LIU Yao-chen1, 2, ZHANG Tie-jun2, 3, 4, GUO Hai-biao5,XU Jun2, 3, 4, LIN Juan5,ZHANG Hong-bing2, 3, HAN Yan-qi2, 3, WANG De-qin5,LI Chu-yuan5, LIU Chang-xiao3, 4
1. Tianjin Medical University, Tianjin 300070, China 2. National & Local United Engineering Laboratory of Modern Preparation and Quality Control Technology of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3. Tianjin Key Laboratory of Quality Marker of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 4. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 5. Guangzhou Baiyunshan Hutchison Whampoa Chinese Medicine Co., Ltd., Guangzhou 510515, China
Sanqi (et) is a commonly used traditional Chinese medicinal material that enjoys abundant chemical constituents including triterpene saponins, flavonoids, amino acids, polysaccharides, volatile oils, and so on. Traditionally, triterpene saponins are regarded as its main pharmacodynamic components. The current research status ofetwill be summarized in the aspects of chemical composition and pharmacological effects. On this basis, the prediction and analysis of the Q-Marker ofetwill be performed through researches on the genetic relations ofaccording to the quality marker (Q-Marker) theory of TCM combined with biosynthetic pathways, traditional efficacy and medicinal properties. It was predicted that notoginsenoside R1, ginsenoside Rg1, ginsenoside Re, ginsenoside Rb1, ginsenoside Rg2, ginsenoside Rd, and ginsenoside could be selected as Q-marker, which is expected to provide the scientific basis for qualitative and quantitative analysis of the effective components ofetandthe development of a new standard.
et;notoginsenoside R1; ginsenoside Rg1; ginsenoside Re; ginsenoside Rb1; ginsenoside Rg2; ginsenoside Rd; dencichine; quality marker
R282.71
A
0253 - 2670(2021)09 - 2733 - 13
10.7501/j.issn.0253-2670.2021.09.023
2021-02-08
国家自然科学基金重点项目(81830111);广东省重点领域研发计划(2020B1111110002);中医药国际合作专项(0610-2040NF020928)
刘耀晨(1995—),男,硕士研究生,从事中药质量标志物的研究。Tel: 17634114592 E-mail: 644632544@qq.com
李楚源,高级工程师(教授级)。Tel: (020)66282326 E-mail: lichuyuan@813zy.com
刘昌孝,中国工程院院士。Tel: (022)23006860 E-mail: liuchangxiao@163.com
[责任编辑 潘明佳]
