RCl 2(R:Hg2+、Pd 2+、Cu 2+、Cd 2+、Mg 2+、Pt 2+)催化二氯乙烷裂解反应机理
2021-05-10秦巧俏徐东辉李来才
秦巧俏, 徐东辉, 张 爽, 陈 晓, 王 薇, 李来才
(四川师范大学 化学与材料科学学院,四川 成都610066)
聚氯乙烯是一种全球广泛应用的通用型合成树脂材料.近年来,聚氯乙烯的产量逐渐上升.氯乙烯又叫做乙烯基氯,能够和空气反应生成容易爆炸的气体混合物,具有抗稳定性好、熔点低、延展性好等优点,是工业上生产聚氯乙烯的重要单体[1].氯乙烯单体的工业生产过程一直是科学研究的热点,目前工业上制备氯乙烯主要有乙烷氧氯化法[2-3]、乙烯氧氯化法[4]、乙炔氢氯化法[5-8]、高温裂解二氯乙烷法[9].以氯化汞为催化剂的乙炔氯化氢法,汞的潜在毒性较大,汞触媒由于汞污染严重,联合国也对聚氯乙烯行业提出了减汞化、无汞化的要求,因此研究二氯乙烷裂解制备氯乙烯技术具有十分重要的意义.高温裂解二氯乙烷法是以1,2-二氯乙烷为原料,在高温下生成氯乙烯,该方法制备氯乙烯是在500℃左右的温度下进行.同时,高温裂解二氯乙烷的反应为吸热反应,随着温度的升高,氯乙烯的生成率逐渐增大.但由于温度过高,氯乙烯也能裂解产生其他物质,从而影响氯乙烯的选择性.因此,降低工艺温度的自然方法是使用有效的催化剂.Baran等[10]用硝酸铵溶液中浸渍过的无模板剂四乙铵经一定程序煅烧得到Red-CHAIBEA催化剂.该催化剂在低温下(502~523 K)对裂解二氯乙烷有活性,氯乙烯的选择性接近100%.Juszczyk等[11]将含有镍铜或镍金双组分金属负载到三氧化二铝的催化剂裂解1,2-二氯乙烷脱氯化氢制备氯乙烯.Testova等[12]研究了1,2-二氯乙烷用氯化钌催化剂上的脱氯化氢制备氯乙烯.
本文研究了二价金属催化剂HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2对催化二氯乙烷裂解生成氯乙烯的反应机理,通过研究二氯乙烷裂解生成氯乙烯的反应机理,比较了不同路径的速控步骤的活化能大小,分析了每种催化剂活性与其微观特性关系,讨论了反应活化能与催化剂能隙关系.本文研究此系列催化剂催化二氯乙烷裂解生成氯乙烯的反应机理,希望能为氯乙烯工业生产绿色环保催化剂的优化提供理论信息.
1 计算方法
本研究计算采用Materials Studio软件中的Dmol 3程序包[13]完成.实验参数主要有广义梯度近似的GGA-PBE[14]描述相关函数,核电子是使用Bergner[15]发明的ECP进行描述,用可极化的DNP[16]基组对原子轨道基组进行描述,截断半径的大小定为0.370 nm.自洽迭代收敛的能量标准设为2.6×10-3kJ/mol.各能量的收敛标准定为2.6×10-2kJ/mol.采用LST/QST[17]方法找寻反应中的过渡态,并通过频率分析和以NEB[18]为基础的最小能量路径(MEP)验证所得到的过渡态的结构.
2 计算结果与讨论
首先分别研究RCl2(R:Hg2+、Pd2+、Cu2+、Cd2+、Mg2+、Pt2+)催化二氯乙烷裂解生成氯乙烯的反应机理.路径1-3的反应流程分别见图1-3.路径1、路径2以及路径3均为对催化剂催化二氯乙烷裂解生成氯乙烯机理的设计.
2.1 催化路径1在路径1中,二氯金属催化剂中的Cl原子和二氯乙烷中的H原子结合生成氯化氢,生成中间体M2;中间体M2脱去氯化氢生成氯乙烷基金属,即中间体M3,中间体M3中R原子逐渐靠近Cl原子,经过过渡态TS2生成中间体M4,最后二氯金属催化剂脱离氯乙烯的表面生成产物P.
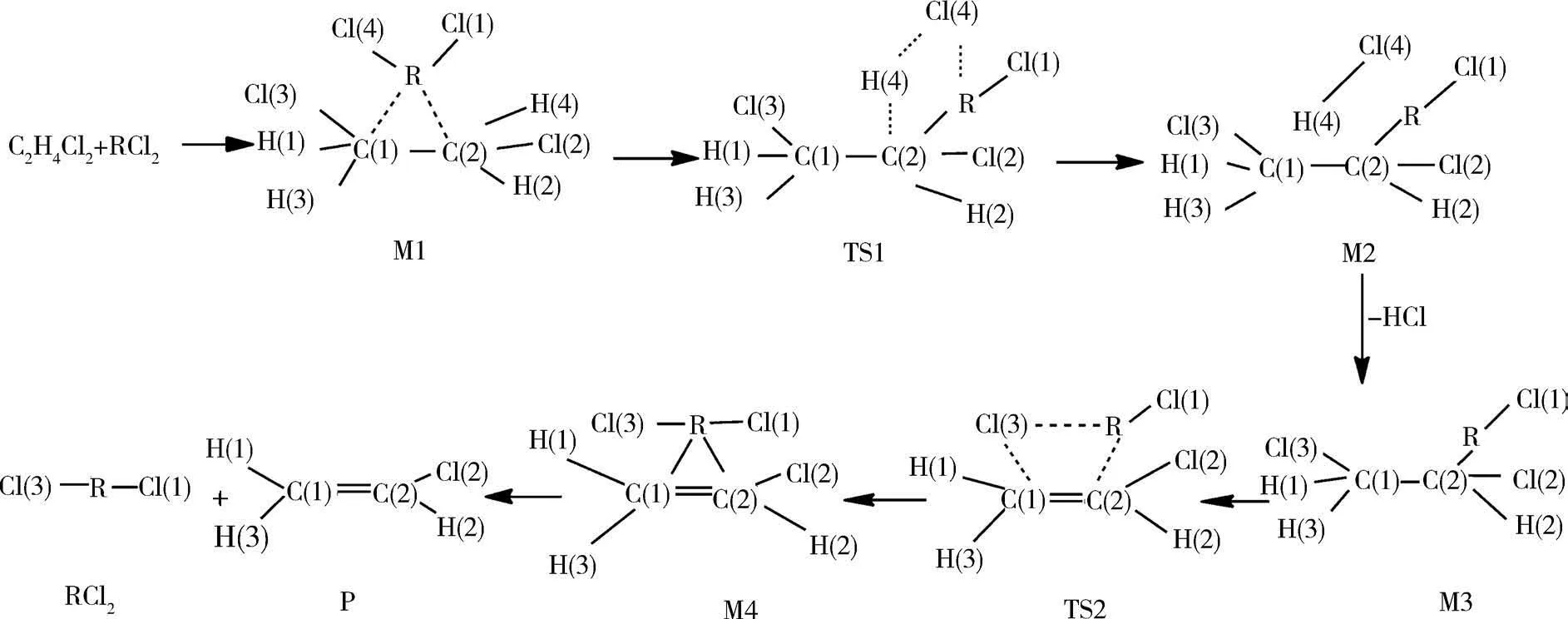
图1 路径1中的反应流程图(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg2+、Pt 2+)Fig.1 Reaction flow chart in path 1(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg2+、Pt 2+)
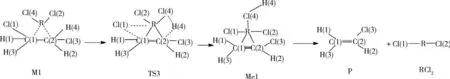
图2 路径2中的反应流程图(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg 2+、Pt 2+)Fig.2 Reaction flow chart in path 2(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg2+、Pt 2+)
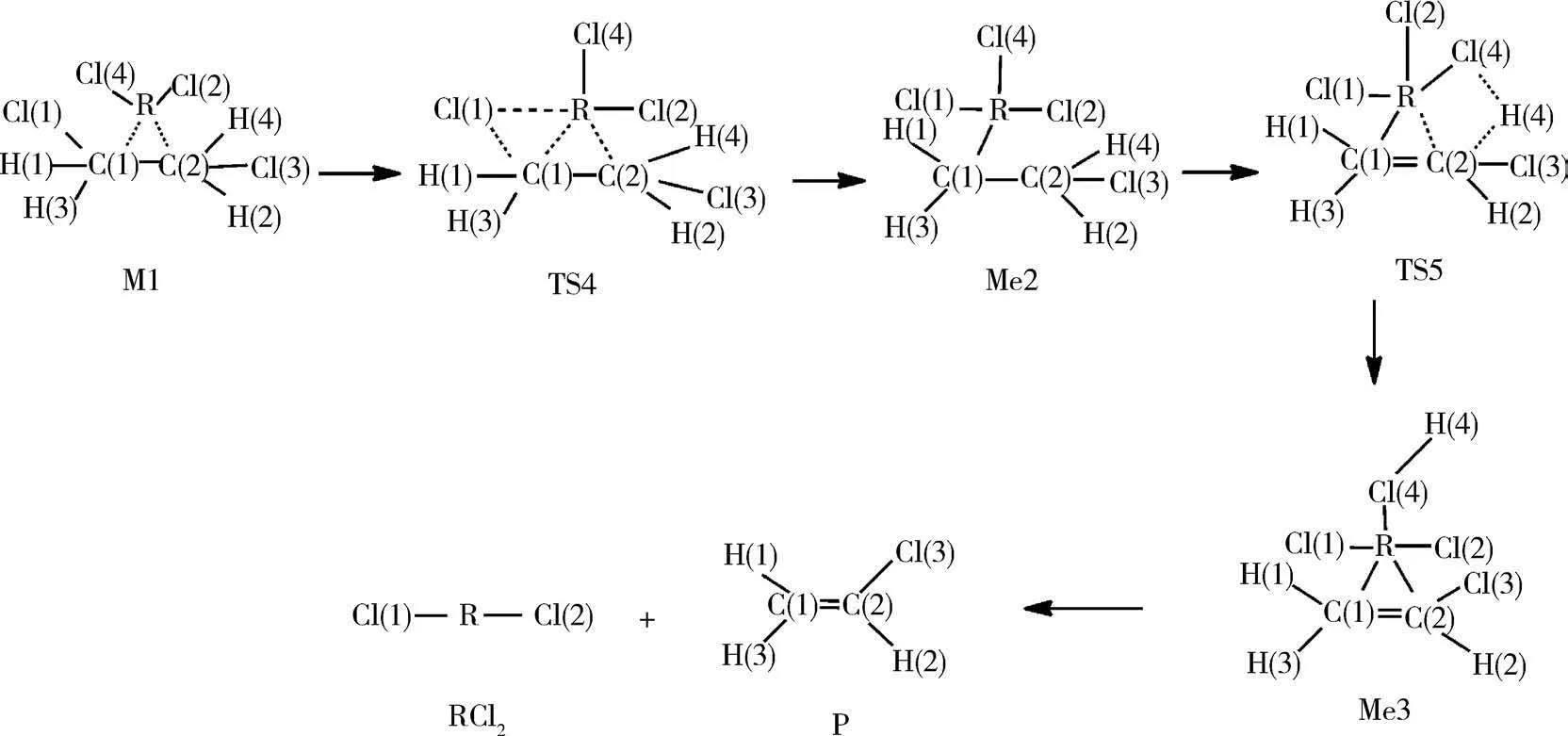
图3 路径3中的反应流程图(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg2+、Pt 2+)Fig.3 Reaction flow chart in path 3(R:Hg 2+、Pd 2+、Cu 2+、Cd 2+、Mg2+、Pt 2+)
表1列出了系列催化剂反应过程中分子几何结构参数.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,其中的Cl原子逐渐脱离二氯金属催化剂,H原子也逐渐脱离二氯乙烷.
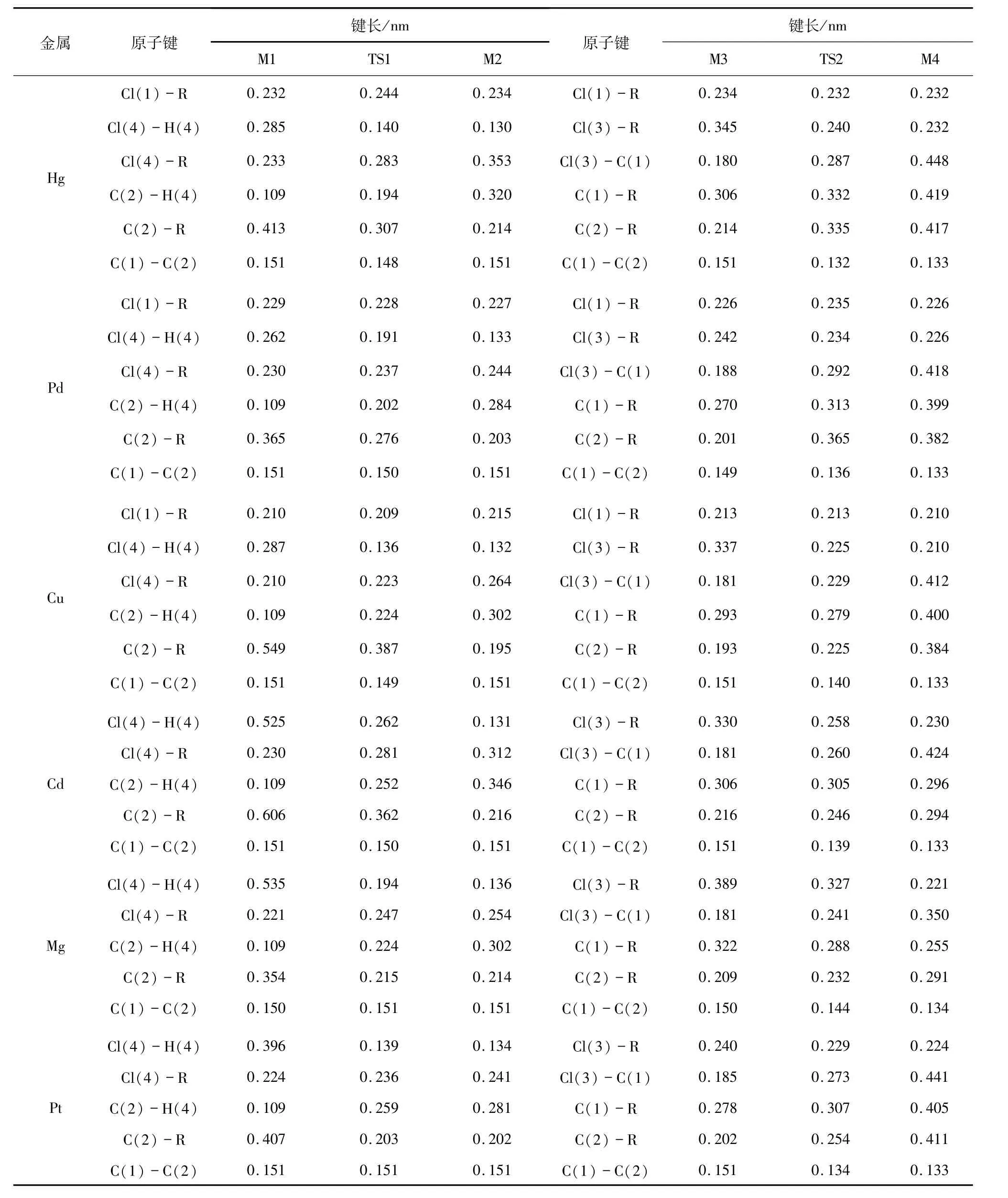
表1 路径1中各物质的键长变化表Tab.1 The bond length of each substance in path 1
通过频率分析,过渡态TS1只有一个负的频率,分别为478、1054、389、665、711、595 i/cm,根据过渡态理论判据,过渡态TS1是真实的.其中Cl(4)原子逐渐靠近H(4)原子,并逐渐与R原子远离.H(4)原子逐渐与C(2)原子远离.由表1可知,TS1中Cl(4)-H(4)的键长均缩短,有成键趋势,而Cl(4)-R和C(2)-H(4)的键长均伸长.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,经过渡态TS1反应的能垒分别为295.8、346.0、265.3、561.9、483.7、66.5 kJ/mol.M1经过过渡态TS1形成中间体M2的过程具有一定的反应能ΔE,分别是
88.7、77.0、149.0、127.6、196.2、51.5 kJ/mol.
其次,研究氯烷基生成氯乙烯的反应过程.表1给出了关键几何结构参数.中间体M3经过过渡态TS2生成中间体M4,过程中R原子逐渐靠近Cl原子,如图1所示.当催化剂为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,通过频率分析,过渡态TS2只有一个负的频率,分别为41、78、267、308、252、211 i/cm,根据过渡态理论判据所得过渡态TS2是真实的,其中Cl(3)原子逐渐靠近R原子,并逐渐与C(1)原子远离.由表1可知,TS2中Cl(3)-R的键长均缩短,Cl(3)-C(1)的键长均伸长.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,经过渡态TS2反应的能垒分别为51.0、31.8、41.0、110.5、81.2、59.8 kJ/mol.催化剂对氯乙烷基金属中氯元素的夺取过程具有一定的反应能ΔE,分别是60.4、0.8、91.2、55.6、150.2、0.4 kJ/mol.
2.2 催化路径2在路径2中,二氯乙烷中Cl原子和H原子逐渐远离二氯乙烷,靠近金属催化剂RCl2,通过过渡态TS3形成中间体Me1.其次中间体Me1的C-R键断裂生成氯乙烯(即产物P).
此过程是一步催化完成,表2列出了系列催化剂催化反应过程分子的几何结构参数.
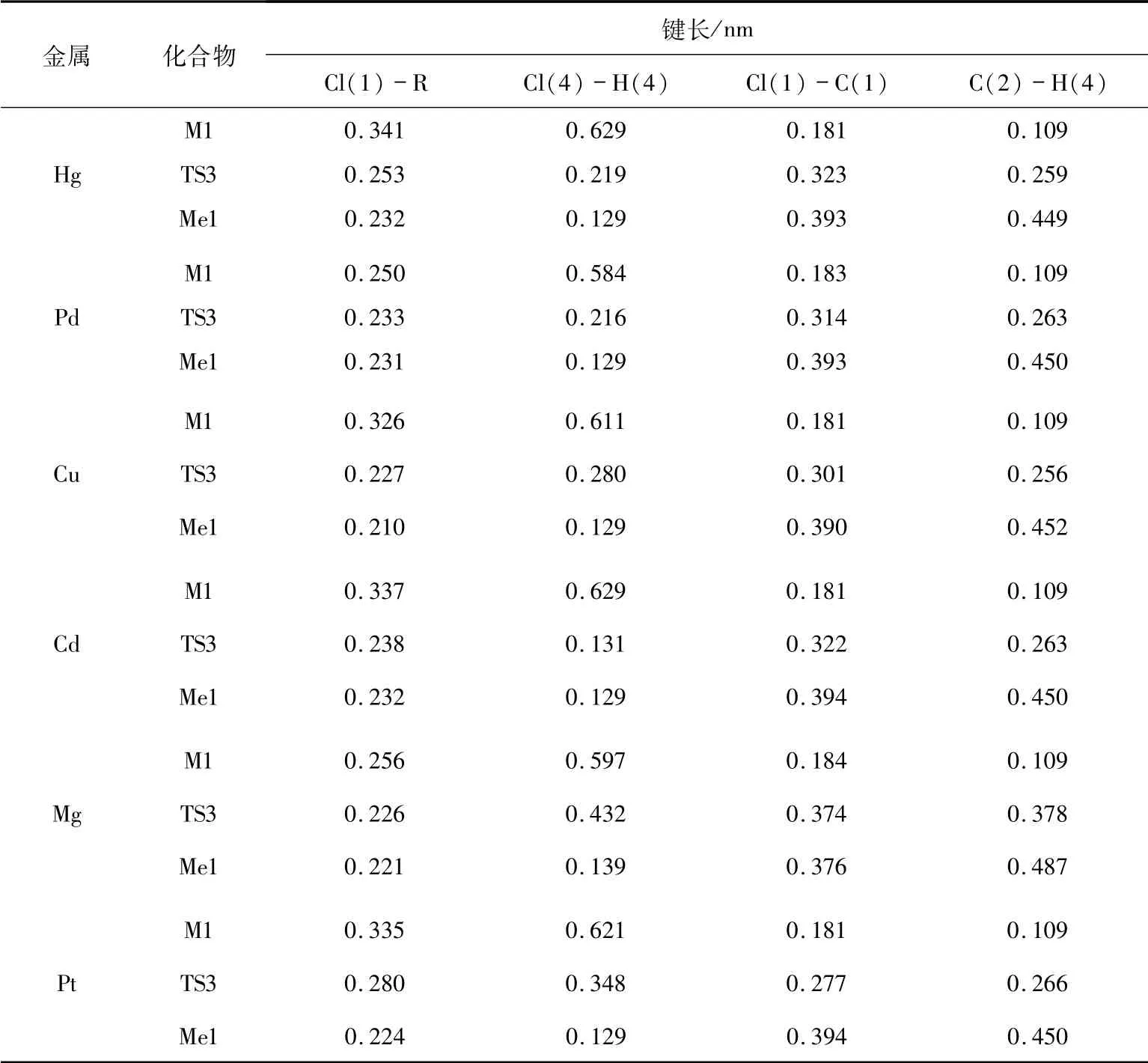
表2 路径2中各物质的键长变化表Tab.2 The bond length of each substance in path 2
当催化剂为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,通过频率分析,过渡态TS3只有一个虚频,分别为150、470、738、126、285、125 i/cm.由表2可知,在TS3中Cl(4)-H(4)的键长均缩短,而Cl(1)-C(1)和C(2)-H(4)的键长均伸长.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,经过渡态TS3反应的能垒分别为345.6、172.8、366.9、83.3、124.3、90.0 kJ/mol.催化剂对C2H4Cl2中氯元素以及氢元素的夺取过程具有一定的能量,分别是70.3、87.9、65.7、11.8、39.7、71.1 kJ/mol.
2.3 催化路径3 在路径3中,M1中Cl原子逐渐远离二氯乙烷,R原子逐渐靠近碳原子,经过过渡态TS4形成中间体Me2.中间体Me2中H原子逐渐远离二氯乙烷,靠近Cl原子,通过过渡态TS5形成中间体Me3.最后在中间体Me3中,R原子逐渐远离碳碳双键,生成产物氯乙烯.催化剂对C2H4Cl2中氯元素的夺取过程如图3所示.
表3也给出了关键几何结构参数.当催化剂为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,通过频率分析,过渡态TS4只有一个负的频率,分别为323、192、181、139、218、214 i/cm.由表3可知,TS4中Cl(1)-R的键长均缩短,而Cl(1)-C(1)的键长均伸长.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,经过渡态TS4反应的能垒分别 为261.5、162.8、491.2、168.2、148.5、129.3 kJ/mol.催化剂对C2H4Cl2中氯元素的夺取过程需要一定的反应能量ΔE,分别是234.7、144.8、64.9、61.9、57.3、123.8 kJ/mol.
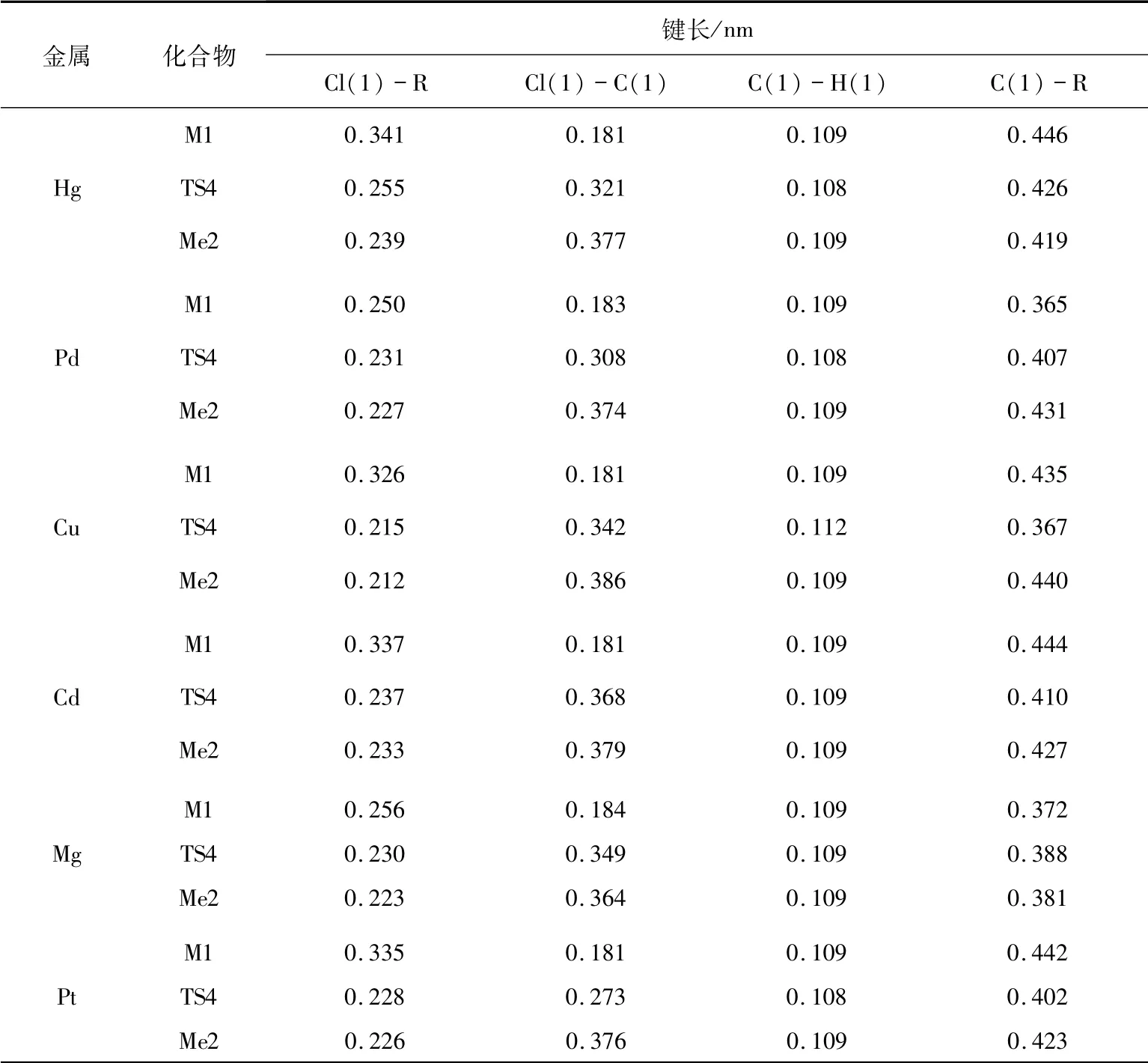
表3 路径3中各物质的键长变化表Tab.3 The bond length of each substance in path 3
最后,研究催化剂中氯元素对二氯乙烷中氢元素的夺取过程.表4给出了关键几何结构参数.二价金属催化剂HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2中的氯原子和二氯乙烷中的氢原子通过过渡态TS5形成中间体Me3,中间体Me3中H原子逐渐远离二氯乙烷,靠近Cl原子.其中H(4)原子逐渐靠近Cl(4)原子,逐渐与C(2)原子远离.当催化剂为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,通过频率分析,过渡态TS5只有一个负的频率,分别为564、88、125、106、323、158 i/cm.由表4可知,TS5中Cl(4)-H(4)的键长均缩短,而Cl(4)-R和C(2)-H(4)的键长均伸长.当催化剂分别为HgCl2、PdCl2、CuCl2、CdCl2、MgCl2、PtCl2时,经过渡态TS5反应的能垒分别为:18.8、228.4、7.1、8.8、15.1、60.7 kJ/mol.催化剂中氯元素对二氯乙烷中氢元素的夺取过程具有一定的反应能,分别是164.0、56.9、0.8、50.2、17.6、53.1 kJ/mol.
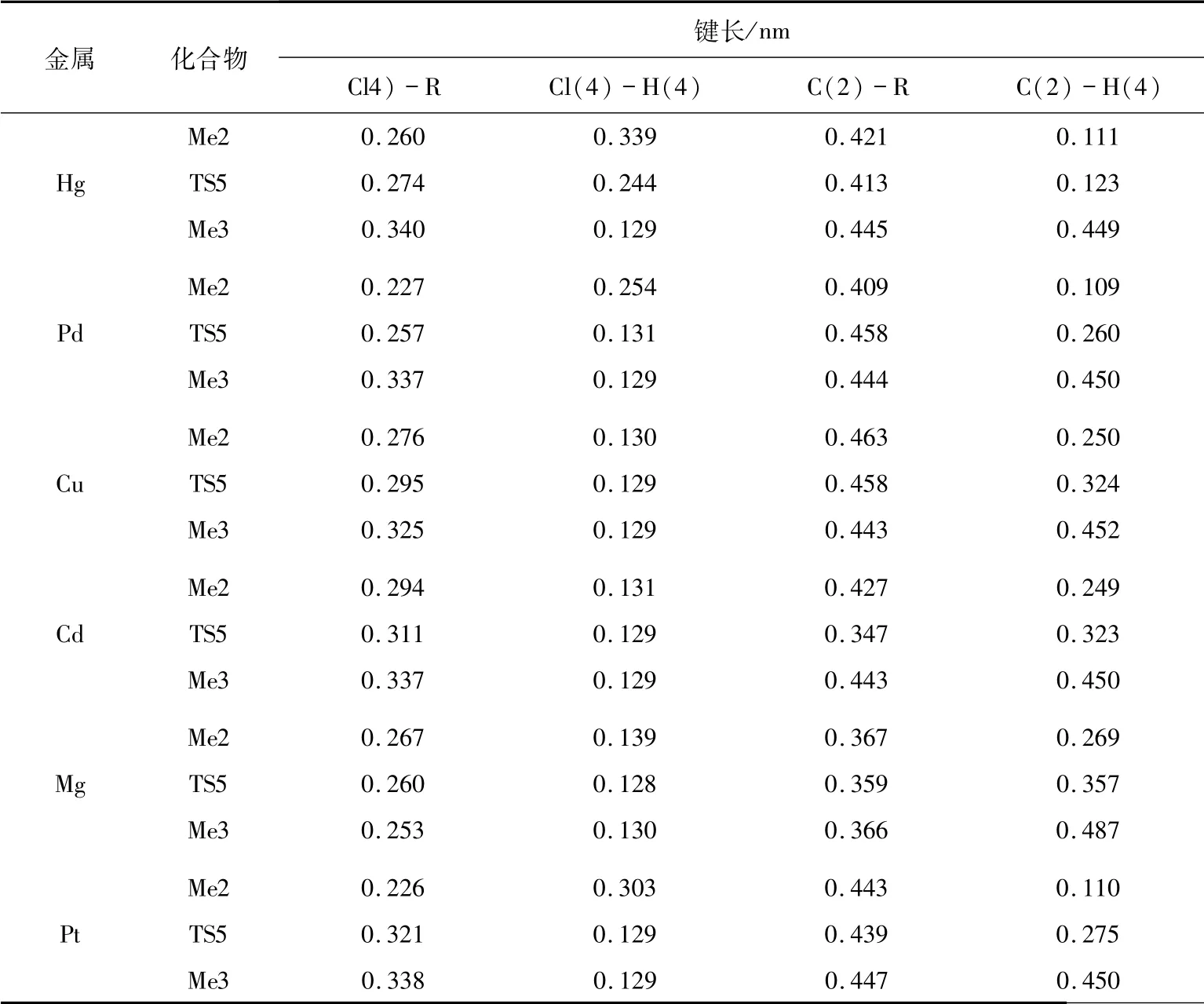
表4 路径3中各物质的键长变化表Tab.4 The bond length of each substance in path 3
2.4 能量分析表5列出了3条不同催化反应路径各步反应活化能,图4为3条不同催化反应路径的各步反应能级示意图.对于催化剂催化二氯乙烷裂解反应生成氯乙烯的反应路径1而言,反应的速控步骤是M1→TS1.在反应路径2中的反应速控步骤是Me1→TS3.在反应路径3中的对催化剂HgCl2、CuCl2、CdCl2、MgCl2、PtCl2反应速控步骤是Me2→TS4,但对于催化剂PdCl2反应的速控步骤是Me3→TS5.
对于HgCl2催化剂,各路径中速控步骤的反应活化能分别为295.8、345.6、261.5 kJ/mol,相对而言,路径3较易进行;对于PdCl2催化剂,各路径中速控步骤的反应活化能分别为346.0、172.8、228.4 kJ/mol,相对而言,路径2较易进行;对于CuCl2催化剂,各路径中速控步骤的反应活化能分别为265.3、366.9、491.2 kJ/mol,相对而言,路径1较易进行.对于HgCl2、PdCl2、CuCl2催化剂,3条不同催化反应路径的速控步骤反应所需的能垒均大于167.3 kJ/mol,故这3种催化剂的催化效果不好,反应均不易发生.比较CdCl2催化二氯乙烷裂解反应生成氯乙烯3条反应路径控制步骤反应活化能大小,反应沿路径2进行所需活化能最低83.3 kJ/mol,其余2个反应路径的速控步骤反应活化能为561.9、168.2 kJ/mol,路径2所需的活化能最低,所以CdCl2催化二氯乙烷裂解反应生成氯乙烯是一步加成完成的(沿反应路径2进行).对于MgCl2催化剂,各路径中速控步骤的反应活化能分别为483.7、124.3、148.5 kJ/mol,反应路径2的能垒更低,所以该催化剂的最优反应路径为路径2,MgCl2催化二氯乙烷裂解反应生成氯乙烯是一步反应完成.对于PtCl2催化剂,各路径中速控步骤的反应活化能分别为66.5、90.0、129.3 kJ/mol,反应路径1的活化能最低,该催化剂的最优反应路径为路径1,速控步骤为M1→TS1.综合比较RCl2系列催化剂作用下,二氯乙烷裂解反应生成氯乙烯3条反应路径控制步骤反应活化能,反应控制步骤需活化能大小顺序:PtCl2<CdCl2<MgCl2<PdCl2<HgCl2<CuCl2,活化能越小,催化剂活性越强.

表5 各步骤的活化能Tab.5 The activation energy of each step
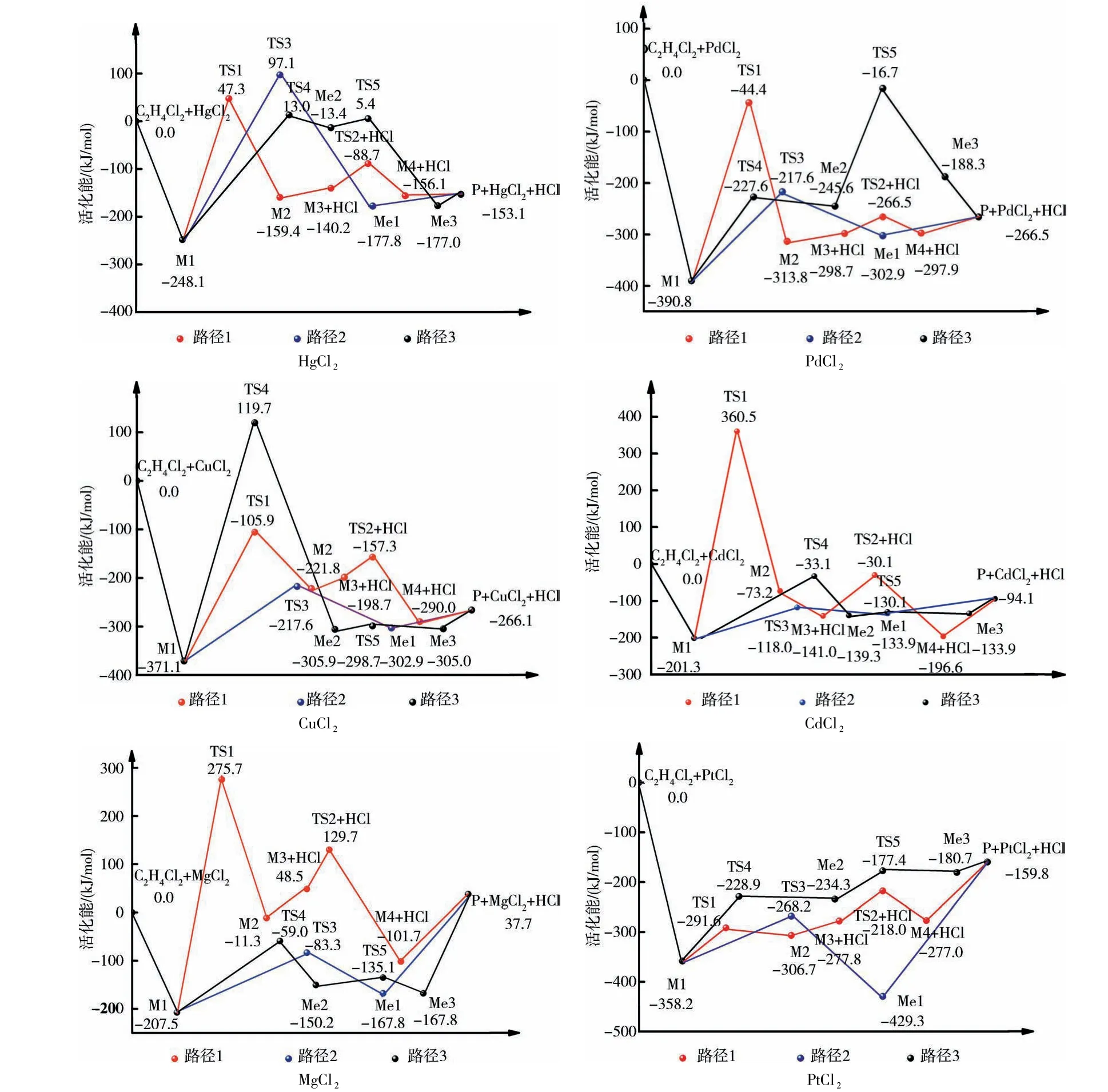
图4 各步骤的反应能级图Fig.4 The diagram of relative energies along the channels
表6为二氯乙烷和氯乙烯在催化剂RCl2上的吸附能.其中,当催化剂为CdCl2时,产物氯乙烯在催化剂CdCl2上的吸附能相较于反应物二氯乙烷在催化剂CdCl2上的吸附能增大,产物不易从催化剂表面脱附,导致反应的活性位点减少,不利于反应进行.由于实验温度设置为常温,表明在低温下,催化剂的脱吸附性能比较好.预测在低温时,对于二氯乙烷裂解生成氯乙烯的反应,CdCl2可以加入脱吸附剂增强催化剂的催化性能.
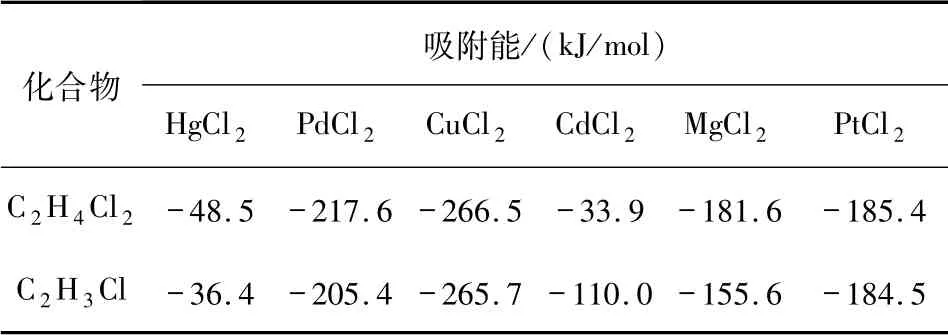
表6 二氯乙烷和氯乙烯在催化剂RCl 2上的吸附能Tab.6 The adsorption energies of dichloroethane and vinyl chloride on catalyst RCl 2
3 结论
本文采用密度泛函的计算方法研究了不同二价金属催化剂RCl2(R:Hg2+、Pd2+、Cu2+、Cd2+、Mg2+、Pt2+)催化二氯乙烷裂解反应生成氯乙烯的微观反应机理.系列催化剂RCl2(R:Hg2+、Pd2+、Cu2+、Cd2+、Mg2+、Pt2+)催化二氯乙烷裂解反应生成氯乙烯存在3条不同的反应路径.通过比较每条反应路径速控步骤活化能大小,确定每种催化剂的最优反应通道.综合比较每种催化剂的最优反应通道速控步骤活化能大小,得到了系列催化剂的催化性能,对二氯乙烷裂解反应生成氯乙烯反应而言,催化剂性能强弱关系为:PtCl2>CdCl2>MgCl2>PdCl2>HgCl2>CuCl2.同时讨论了在二氯乙烷裂解催化反应生成氯乙烯反应过程中,催化剂失活和催化剂中毒特征,希望能为该反应催化剂的优化使用提供理论依据.
