复凝聚法制备玉米多肽微胶囊及释放特性研究
2021-05-08陈静张汆陈志宏何晓伟刘洋
陈静, 张汆, 陈志宏, 何晓伟, 刘洋
复凝聚法制备玉米多肽微胶囊及释放特性研究
陈静1, 张汆2, 陈志宏2, 何晓伟2, 刘洋2
(1. 滁州职业技术学院 食品与环境工程学院, 安徽 滁州, 239000; 2. 滁州学院 生物与食品工程学院, 安徽 滁州, 239000)
采用复凝聚法制备玉米多肽微胶囊, 分析了壁材浓度、明胶和羧甲基纤维素钠(CMC)比例、壁芯比3个因素对微胶囊包埋率的影响。在单因素和正交试验基础上, 依据响应面分析法确定了微胶囊最佳制备工艺, 并分析其在体外模拟胃肠液环境中的释放特性。微胶囊最优制备工艺: 壁材浓度1.2%, 明胶︰CMC为 7.59︰1, 壁芯比为5.97︰1, 在该条件下制备的微胶囊产品在体外模拟胃肠液消化环境中表现出一定的缓释效果。
复凝聚法; 玉米多肽; 微胶囊; 工艺优化; 释放特性
玉米蛋白粉是玉米用于加工淀粉或糖浆等产品时产生的主要副产物, 蛋白质含量丰富, 可达40%~ 60%左右, 主要为醇溶蛋白, 其结构中含较多疏水氨基酸难溶于水, 且口感较差, 很难在食品加工领域内广泛应用[1–2]。通过酶法对蛋白进行改性, 不仅可以明显提高玉米蛋白溶解性, 改善其加工性能, 还可以制备生物活性肽开发功能食品[3–5]。但是天然蛋白质分子内的疏水性基团经酶解以后被暴露出来, 可与味蕾接触, 会产生苦味, 因此若将玉米酶解产物多肽更好的在食品工业中应用, 必须对产品进行脱苦。微胶囊法是常用的食品脱苦方法, 该技术不仅可以掩盖食品中的不良风味, 提高芯材稳定性, 还可以起到缓释的效果[6–8]。
许多研究表明, 通过制备多肽微胶囊不仅可以提高产品稳定性, 在胃肠道内表现出较为明显的缓释效果, 且能够减少苦味, 改善产品品质。袁靖琳等[9]研究发现采用锐孔法制备的水牛乳活性肽微胶囊产品耐酸, 且具有很好的模拟肠道环境中的缓释效果。袁强等[10]以包埋率为筛选指标, 采用β-环糊精对菜籽多肽进行包埋, 并对微胶囊制备条件进行了优化, 发现优化条件下制备的微胶囊产品储藏稳定性增强。赵静[11]等选择锐孔凝固浴法来研制林蛙胶原蛋白肽微胶囊, 研究发现制备的微胶囊产品在模拟胃液内释放较少, 在模拟肠液内释放量增加较缓慢。复凝聚法制备微胶囊具备反应条件较为温和、成本较低、制备效率高等优点, 在制备微胶囊产品中应用较多[12–14]。DA SILVA等[14]采用复凝聚法制备出嗜酸乳杆菌微胶囊, 有很好的包埋效果, 且储藏稳定性较好。张路[15]研究发现采用锐孔法及复凝聚法制备了玉米多肽微胶囊, 2种方法都可以起到减少玉米肽苦味的作用。
目前对于玉米多肽微胶囊的研究相对较少, 缺乏较为系统的研究。本文主要采用酶法对玉米蛋白粉进行酶解制备玉米多肽, 采用复凝聚法制备玉米多肽微胶囊, 通过单因素和响应面法优化制备工艺确定最佳制备条件, 并在此基础上分析了玉米多肽微胶囊产品在体外模拟胃肠液中的释放特性, 可以为玉米深加工产品的研发提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
试验原料: 玉米粗蛋白, 为玉米淀粉加工副产物, 蛋白质含量56.28%。
主要试剂: 四肽标准品(甘氨酰-甘氨酰-酪氨酰-精氨酸, Gly-Gly-Tyr-Arg), 纯度≥98%(合肥博美生物); 中性蛋白酶(酶活2万u/g)(广西南宁庞博生物); 碱性蛋白酶(酶活2万 u/g)(锐阳生物); 胃蛋白酶(1︰10 000)、胰蛋白酶(1︰250)(上海拜利生物); 羧甲基纤维素钠(CMC), 明胶, 食品级(山东优索化工); 甲醛(西陇科学股份有限公司); 盐酸(上海博河精细化学品); 氢氧化钠、硫酸铜、氢氧化钠, 乙酸(天津市科密欧化学试剂), 均为分析纯。
1.1.2 主要仪器设备
FA2204B电子天平(上海越平科学仪器); HHS-11-4电热恒温水浴锅(上海博讯实业); LGJ-10真空冷冻干燥机(北京四环科学仪器); DF-101D恒温磁力搅拌器、R-10旋转蒸发仪(巩义予华仪器); L550台式低速离心机(湖南湘仪仪器); T6可见分光光度计(上海仪电分析仪器)。
1.2 实验方法
1.2.1 玉米多肽的制备
准确称取5 g玉米蛋白于250 mL烧杯内, 加100 mL蒸馏水, 搅拌均匀, 再加入中性蛋白酶(70 mg/g)和碱性蛋白酶(80 mg/g), 50 ℃匀速搅拌酶解4 h, 之后灭酶(100 ℃, 10 min), 离心后收集上清液, 采用旋转蒸发仪对样品进行蒸发浓缩后再真空冷冻干燥, 得玉米多肽粉末[16]。
1.2.2 样品中多肽含量的测定
准确配制浓度为4 mg/mL的多肽标准溶液, 分别吸取0、0.5、1、1.5、2.0、2.5、3.0 mL标准溶液于7支10 mL比色管内, 补加蒸馏水至6 mL, 加入双缩脲试剂4 mL, 之后继续补加蒸馏水至比色管刻度, 将待测样品充分混匀以后在室温条件下放置30 min, 在540 nm下测定各样品吸光值, 以各样品中多肽浓度为横坐标, 以各样品溶液吸光度为纵坐标, 制作多肽标准曲线。
取待测样品溶液1 mL至另一10 mL比色管内, 按上述同样方法测定样品吸光度, 代入标注曲线得出样品中多肽含量[17–18]。
1.2.3 复凝聚法制备玉米多肽微胶囊
分别称量一定量的明胶以及CMC, 加入蒸馏水50 mL,采用恒温磁力搅拌器在50 ℃加热条件下匀速搅拌至完全溶解, 准确称取定量的玉米肽粉末, 继续在搅拌条件下恒温反应2 h, 之后用10%冰醋酸调节pH = 4, 恒温反应30 min后取出, 加30 mL蒸馏水, 再将样品溶液用冷水冷却到10 ℃以下, 接着添加37%甲醛溶液将样品溶液固化15 min, 采用10% NaOH溶液将其pH调节为8, 继续反应20 min后, 将微胶囊过滤, 收集滤液, 沉淀真空冷冻干燥即可得玉米多肽微胶囊[19–20]。
1.2.4 微胶囊包埋率的测定
将微胶囊制备时的滤液和用蒸馏水反复冲洗制备好的玉米多肽微胶囊的溶液合并后离心(5 000 r/min, 10 min), 将上清液进行过滤以后再准确定容。按照1.2.2方法测定溶液中的多肽含量, 即为玉米多肽微胶囊表面多肽的含量。多肽包埋率的计算公式如下[21–22]: 多肽包埋率(%) = (1-0/) × 100。式中:0为微胶囊表面多肽的含量, g;为玉米肽内所含多肽的总量, g。
1.2.5 复凝聚法制备玉米多肽微胶囊单因素试验条件优化
(1) 壁材浓度的选择。固定壁材比例(明胶︰CMC)7︰1,壁芯比8︰1, 反应温度为50 ℃, 反应时间2 h, 以包埋率为筛选指标, 分析壁材浓度分别在0.4%、0.8%、1%、1.2%、1.5%、1.8%时对微胶囊制备效果的影响, 筛选较好的壁材浓度。
(2) 明胶与CMC配比的选择。固定壁材浓度为1%, 壁芯比为8︰1, 反应温度设定为50 ℃, 反应时间2 h, 以包埋率为筛选指标, 分析明胶: CMC分别在6︰1、7︰1、8︰1、9︰1、10︰1时对微胶囊产品的制备效果的影响, 筛选较好的明胶与CMC配比。
(3) 壁芯比的选择。固定壁材浓度为1%, 明胶: CMC为7︰1, 反应温度为50 ℃, 反应时间2 h, 以包埋率为筛选指标, 分析壁芯比分别在4︰1、5︰1、6︰1、7︰1、8︰1时对微胶囊产品的制备效果的影响, 筛选较好的壁芯比条件[23]。
1.2.6 响应面法优化玉米多肽微胶囊制备试验条件
根据上述单因素试验的结果, 采用响应面法进行试验设计, 依据BOX-Behnken中心组和的试验设计原理, 以玉米多肽微胶囊包埋率作为响应值, 对影响玉米多肽微胶囊制备的3个主要因素(壁材浓度)、(明胶︰CMC)和(壁芯比)进行响应面分析试验设计, 确定最佳的微胶囊制备条件[24–25]。其三因素三水平试验因素水平表见表1。

表1 各因素水平表
1.2.7 玉米多肽微胶囊在模拟胃肠液内缓释效果分析
准确称取4 g玉米多肽微胶囊加入到100 mL模拟胃液内, 充分混合均匀, 在37 ℃水浴条件下匀速搅拌(100 r/min)下消化, 每隔半小时取样2 mL, 离心(4 000 r/min, 5 min)后取上清液1 mL按照1.2.2的方法测定消化液中多肽物质的含量, 计算微胶囊内多肽累计释放率, 每次取样后再补充空白人工胃液至100 mL。将在模拟胃液内保温消化3 h后的玉米多肽微胶囊溶液, 离心分离(4 000 r/min, 5 min), 沉淀水洗后加入到模拟肠液中(100 mL), 37 ℃保温并匀速搅拌(100 r/min)继续消化, 每隔15 min取样2 mL, 离心(4 000 r/min, 5 min)后按照1.2.2的方法测定消化液中多肽物质的含量, 计算微胶囊内多肽累计释放率, 每次取样后再补充空白人工肠液至100 mL[26]。玉米微胶囊在胃肠液内消化时多肽累计释放量计算公式为: 累计释放量(%) =2/1× 100。式中:2为玉米多肽微胶囊在胃肠液中所释放出的多肽总量, g;1为玉米多肽微胶囊内所含的多肽总量, g。
模拟胃液(SGF)配制方法: 准确称量NaCL 0.2 g, 加90 mL蒸馏水完全溶解, 接着用1.0 mol/L HCL将溶液pH值调至1.2, 加胃蛋白酶0.32 g, 蒸馏水定容到100 mL,即得SGF溶液。
模拟肠液(SIF)配制方法: 准确称量 0.68 g K2HPO4, 加90 mL 蒸馏水完全溶解, 接着用0.1 mol/L NaOH将pH 调节为7.5, 加胰蛋白酶1.0 g, 蒸馏水定容到100 mL, 即得SIF溶液[21, 26]。
1.3 数据处理
所有的试验条件均需平行测定3次, 之后取平均值, 结果以平均值±标准差的形式来表示, 通过Design Expert7.0数据分析软件对所得试验结果进行相应的处理。
2 结果与分析
2.1 多肽标准曲线的制作
采用双缩脲法测定标准溶液及各样品溶液中多肽含量, 以多肽标准溶液的浓度为横坐标, 以样品吸光度为纵坐标, 制作多肽标准曲线(图1)。由图1可知, 标准曲线方程为= 0.260 5+ 0.002 6,² = 0.997 3, 表明该方程相关性良好。将各样品溶液测定的吸光度代入标准曲线中, 即可求出各样品中多肽的含量。

图1 多肽标准曲线
2.2 复凝聚法制备玉米多肽微胶囊单因素试验结果及分析
2.2.1 不同壁材浓度对玉米多肽微胶囊制备效果的影响
不同壁材浓度对玉米多肽微胶囊包埋率的影响见图2。由图2可知, 当壁材浓度在0.4%~1.8%之间时, 玉米多肽微胶囊的包埋率出现了先上升后下降的趋势, 并在壁材浓度为1%时包埋率最高, 为48.38%。当壁材浓度在0.4%~1%之间时, 随着壁材浓度的提高, 包埋率逐渐上升, 可能是由于壁材浓度低时, 溶液中壁材的量不足, 难以起到较好的包埋效果, 因此适当增加壁材浓度可提高包埋率。但当壁材浓度过高时, 大于1%时, 包埋率出现缓慢下降的趋势, 主要是由于壁材浓度过高的时候容易造成微胶囊软塌而致其破裂, 包埋率出现下降。因此, 壁材浓度的选择为1%。

图2 不同壁材浓度对玉米多肽微胶囊包埋率的影响
2.2.2 不同明胶︰CMC对玉米多肽微胶囊制备效果的影响
不同明胶与CMC比例对玉米多肽微胶囊包埋率的影响见图3。由图3可知, 明胶与CMC比例对玉米多肽微胶囊的包埋率有明显的影响。当明胶︰CMC在6︰1~7︰1之间时, 随着明胶量比例的提高, 包埋率有较大程度的增加, 主要是由于明胶含量的提高有助于复凝聚产物的形成, 包埋效果较好。而当明胶︰CMC大于7︰1时, 包埋率呈现逐渐下降的趋势, 可能是因为随着明胶含量过高时, CMC相对量较少, 无法提供充足的结合位点, 影响复凝聚效果。在明胶︰CMC为7︰1时包埋率最高, 明胶与CMC比例恰当, 此时包埋率为58.62%。因此, 选择明胶︰CMC为7︰1。

图3 不同明胶与CMC比例对玉米多肽微胶囊包埋率的影响
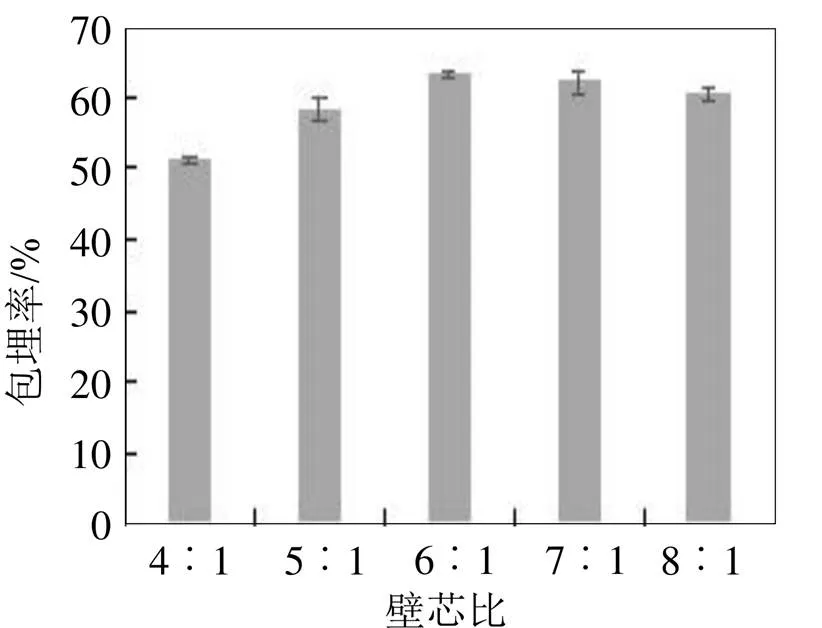
图4 不同壁芯比对玉米多肽微胶囊包埋率的影响
2.2.3 不同壁芯比对玉米多肽微胶囊制备效果的影响
不同壁芯比对玉米多肽微胶囊包埋率的影响见图4。由图4可知, 当壁芯比在4︰1~6︰1之间时, 随着壁材比例的提高, 微胶囊包埋率总体表现出逐渐上升的趋势, 主要是因为当壁材比例低时, 芯材对应比例较大, 形成的微胶囊壁比较薄而使其不稳定, 容易在碰撞中破裂。而当壁材比例继续增加大于6︰1时, 包埋率基本上是处于稳定的状态, 虽然包埋率也较高, 但是壁材有效利用率较低, 因此综合考虑选择壁芯比为6︰1。
2.2 响应面法优化玉米多肽微胶囊制备试验结果及分析
2.2.1 响应面法试验结果与方差分析
响应面试验结果见表2。

表2 Box-Behnken试验设计与结果
通过Design-Expert7.0 数据分析软件对上述试验的结果进行了多元线性回归分析, 得到了二次多项回归方程:= 64.55 + 0.43+ 3.93-2.00+ 3.80+ 1.33+ 64-0.112-6.502-4.442。之后对该回归方程进行了方差分析, 结果见表3。由表3可知, 该模型= 0.000 2<0.01, 达到了极显著的水平, 失拟项= 0.744 9>0.05, 表示差异不显著, 因此该回归方程可以用来拟合三个因素对包埋率的影响。方程2= 0.969 9,2Adj= 0.931 2, 表示该回归模型的拟合性较好, 试验变异系数较小, 为2.51%, 表明试验有较高的可靠性。从各因素对包埋率的影响结果分析可知, 一次项、, 交互项, 二次项2、2对结果影响达到了极显著的水平(<0.01), 不同因素对包埋率影响大小为:(明胶︰CMC)>(壁芯比)>(壁材浓度), 表明响应值的变化是复杂的过程, 各因素对包埋率的影响呈现二次关系, 且不同因素之间有相互的影响。试验结果分析表明, 该模型可以对玉米多肽微胶囊包埋率随各因素的变化情况进行有效预测。

表3 方差分析表

续表3
注:<0.05为差异显著,<0.01为差异极显著。
2.2.2 响应面分析和条件优化
对该预测模型进行响应面分析可得相应面图及等高线图, 见图5~7, 可用于评价各试验因素之间的交互作用及确定各因素的最佳条件。

图5 A(壁材浓度)和B(明胶: CMC)的响应面和等高线图

图6 A(壁材浓度)和C(壁芯比)的响应面和等高线图

图7 B(明胶︰CMC)和C(壁芯比)的响应面和等高线图
由图5和图7可知, 壁材比例(明胶: CMC)对于多肽微胶囊包埋率的影响最为明显,各响应面图中曲面都较陡, 对结果影响最大, 而壁芯比对结果的影响稍次之, 壁材浓度对结果的影响最小, 各响应面图中曲面都较平缓, 这和方差分析的结果是一致的。在选择的各因素设定范围内, 根据回归模型, 利用Design Expert7.0软件预测最佳玉米多肽微胶囊制备条件为: 壁材浓度为1.2%, 明胶︰CMC为7.59︰1, 壁芯比为5.97︰1, 模型预测最优的包埋率结果为67.18%, 在预测最优条件下进行试验验证, 重复测定3次取平均值, 测得实际包埋率为66.26%±1.53%, 和预测理论值只相差0.92%, 因此该模型可很好的反映复凝聚法制备玉米多肽微胶囊的条件。
2.3 玉米多肽微胶囊在模拟胃肠液中的释放情况分析
玉米多肽微胶囊在模拟胃肠液中的释放结果见图8和图9。由图8可知, 玉米多肽微胶囊在模拟胃液消化环境中, 在消化0.5~3 h时间内, 随着时间的延长, 微胶囊内多肽的累计释放率显著上升, 在消化1.5 h时多肽累计释放率为28.60%, 当在模拟胃液中消化3 h后微胶囊释放率达50.83%。由图9可以看出, 经模拟胃液消化的玉米多肽微胶囊在模拟肠液中进行了进一步的消化, 在消化15~90 min时间内, 多肽累计释放率逐渐上升, 消化60 min时多肽累计释放率为70.58%, 消化90 min时为75.83%。由此看出, 采用复凝聚法制备的玉米多肽微胶囊在模拟的胃肠液消化环境中起到了一定的缓释效果。主要是由于多肽作为芯材, 被壁材(明胶和CMC)包埋, 以微胶囊形式在胃肠液中时, 壁材可将芯材与外界分开, 使其缓慢释放于环境中, 产品性质更加稳定。

图8 玉米多肽微胶囊在模拟胃液中的累计释放率
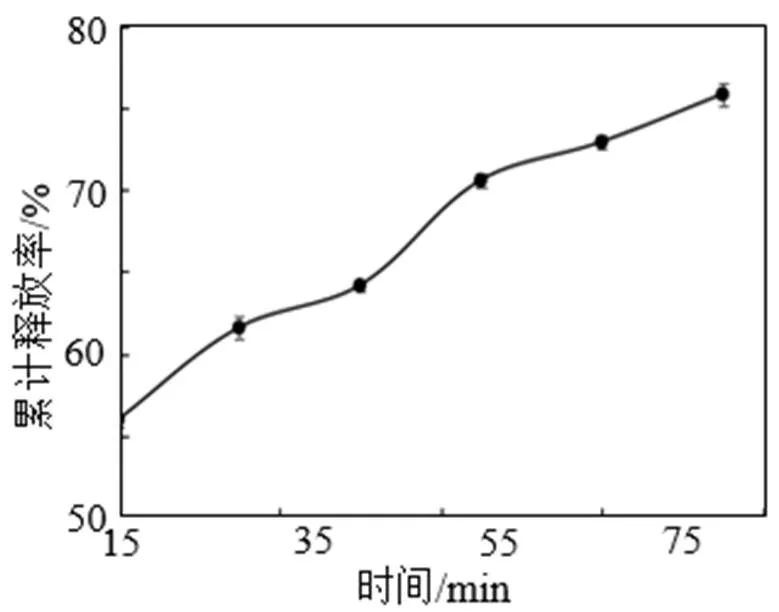
图9 玉米多肽微胶囊在模拟肠液中的累计释放率
3 总结
本文以玉米蛋白酶解产物多肽为主要原料, 采用复凝聚法制备玉米多肽微胶囊, 以包埋率为筛选指标, 在对影响微胶囊制备的主要因素壁材浓度、明胶: CMC、壁芯比进行单因素试验优化的基础上, 通过响应面分析法对微胶囊制备条件进行优化。不同因素对微胶囊包埋率的影响大小为: 明胶︰CMC>壁芯比>壁材浓度, 玉米多肽微胶囊最佳制备工艺为: 壁材浓度1.2%, 明胶与CMC比例7.59︰1, 壁材芯材比例5.97︰1, 在该条件下进行验证试验得出包埋率为66.26% ± 1.53%, 与预测值仅差0.92%。在体外模拟胃肠液消化试验结果表明玉米多肽经过微胶囊化处理后可起到一定的缓释效果, 经模拟胃液消化3 h后多肽累计释放率为50.83%, 再经模拟肠液消化1.5 h后累计释放率为75.83%。本文可以为玉米多肽微胶囊产品的开发提供一定的参考。
[1] 宋占兰, 郑喜群, 刘晓兰. Alcalase酶解高底物浓度玉米蛋白工艺优化[J]. 食品与机械, 2011, 27(6): 226–231.
[2] 杨露, 刘松柏, 赵江涛, 等. 玉米蛋白粉的营养价值及其在家禽饲料中应用研究进展[J]. 粮食与饲料工业, 2018(11): 58–61.
[3] Garcia-Mora P, Penas E, Frias J, et al. High-pressure improves enzymatic proteolysis and the release of peptides with angiotensin I converting enzyme inhibitory and antioxidant activities from lentil proteins [J]. Food Chemistry, 2015, 171(15): 224–232.
[4] Shanmugam V P, Kapila S, Sonfack T K,et al.Antioxidative peptide derived from enzymatic digestion of buffalo casein [J]. International Dairy Journal, 2015, 42: 1–5.
[5] 黄建韶, 张洪, 赵东海. Alcalase蛋白酶水解大豆分离蛋白的研究[J]. 湖南文理学院学报(自然科学版), 2010, 22(1): 28–30.
[6] 董志俭, 王庆军, 邵飞先, 等.明胶/桃胶复合凝聚凝胶化鱼油微胶囊的氧化稳定性研究[J]. 中国食品学报, 2014(7): 66–72.
[7] 杨小斌, 周爱梅, 王爽, 等. 蓝圆鲹鱼油微胶囊的结构表征与体外消化特性[J]. 食品科学, 2019, 40(1): 117–122.
[8] Dima C, Patra cu L, Cantaragiu A, et al. The kinetics of the swelling process and the release mechanisms of Coriandrum sativum L. essential oil from chitosan/alginate/inulin microcapsules [J]. Food Chemistry, 2015, 195(2): 39–48.
[9] 袁靖琳, 陈燏, 韦翠兰, 等. 锐孔法制备水牛乳活性肽微胶囊工艺优化及体外释放研究[J]. 食品工业科技, 2017, 38(8): 227–232.
[10] 袁强, 王玉梅, 殷实,等. 菜籽多肽微胶囊工艺优化及其抗氧化性研究[J]. 食品研究与开发, 2018, 39(7): 66–70.
[11] Timilsena Y P, Akanbi T O, Khalid N, et al. Complex coacervation:Principles, mechanisms and applications in microencapsulation [J]. International Journal of Biological Macromolecules, 2019, 121: 1 276–1 286.
[12] Eghbal N, ChoudhaRY R. Complex coacervation: Encapsulation and controlled release of active agents in food systems [J]. LWT-Food Science and Technology, 2018, 90: 254–264.
[13] 徐玉巧, 王金华, 熊智,等. 复凝聚法鼠李糖乳杆菌微胶囊工艺优化及储藏稳定性[J]. 食品与发酵工业, 2020, 46(5): 194–199.
[14] Da Silva T M, De Deus C, De Souza Fonseca B, et al.The effect of enzymatic crosslinking on the viability of probiotic bacteria ( Lactobacillus acidophilus) encapsulated by complex coacervation[J].Food Research International, 2019, 125: 108577.
[15] 张路. 锐孔法和复合凝聚法制备玉米肽微胶囊[D]. 长春: 吉林农业大学, 2012.
[16] 刘子毅, 顾丰颖, 王博伦, 等. 超高压协同碱性蛋白酶制备玉米黄粉ACE抑制肽[J]. 食品科学, 2020, 41(4): 222– 227.
[17] 赵静. 林蛙胶原蛋白多肽的分离纯化、功能性研究及其微胶囊的制备[D]. 长春: 吉林大学, 2019.
[18] 张玲, 石彩文, 肖凯军, 等. 双缩脲法测定罗非鱼源胶原蛋白肽含量的改良及应用评价[J]. 食品科学, 2019,40(20): 234–240.
[19] 陈琳, 李荣, 张禄捷, 等. 复凝聚法紫苏油胶囊的制备及其性能研究[J]. 食品工业科技, 2015, 36(2): 232–238.
[20] 马铁铮, 赵宏亮, 王静. 复合凝聚法制备脂溶性食品配料微胶囊的壁材研究进展[J]. 食品工业科技, 2016, 37(13): 365–369.
[21] 张奇, 刘长江, 胡丽莎. 鹿胎盘肽微胶囊技术的研究[J]. 食品研究与开发, 2008, 29(5): 28–32.
[22] Karaca A C, Nickerson M, Low N H. Microcapsule production employing chickpea or lentil protein isolates and maltodextrin: Physicochemical properties and oxidative protection of encapsulated flaxseed oil [J].Food chemistry, 2013, 139(1–4): 448–457.
[23] 宋敏, 何健东, 龚智强, 等. 复凝聚法制备金枪鱼鱼油微胶囊的工艺优化[J]. 食品工业, 2015, 36(3): 132–137.
[24] 贺银菊, 杨再波, 彭莘媚,等. 响应面优化紫果西番莲多糖提取工艺及抗氧化活性研究[J]. 食品研究与开发, 2020, 41(4): 38–44.
[25] 劳斐, 孔令明, 李芳, 等. 响应面法优化杏仁蛋白酶解工艺及其抗氧化活性研究[J]. 中国食物与营养, 2012, 18(3): 54–59.
[26] 罗鹏, 潘思轶, 何东平. 葵花籽ACE 抑制肽的微胶囊制备工艺研究[J]. 粮食与油脂, 2020, 33(2): 84–87.
Study on preparation of corn peptide microcapsules by complex coacervation method and release characteristics
Chen Jing1, Zhang Cuan2, Chen Zhihong2, He Xiaowei2, Liu Yang2
(1. School of Food and Environmental Engineering, Chuzhou Polytechnic, Chuzhou 239000, China; 2. School of Bio&Food Engineering, Chuzhou University, Chuzhou 239000, China)
The corn peptide microcapsules are prepared by complex coacervation method and then the influences of three main factors (wall material concentration, ratio of gelatin to sodium carboxymethy lcellulose (CMC) and ratio of wall material to core material)on embedding rates are analysed. On the basis of single factor and orthogonal tests, the best preparation technology of microcapsules is determined by response surface analysis method. And then the release characteristics of microcapsule products in the simulated gastric and intestinal fluid environments in vitro are analyzed. The optimum condition for the preparation of microcapsules is listed as follows: wall material concentration: 1.2%, ratio of gelatin to CMC is 7.59︰1, ratio of wall material to core material is 5.97︰1.Furthermore, the microcapsule products prepared under optimum condition shows a certain sustained-release effect in the simulated gastric and intestinal fluid environments in vitro.
complex coacervation method; corn peptide; microcapsules; process optimization; release characteris- tics
TS 213.4
A
1672–6146(2021)02–0042–08
10.3969/j.issn.1672–6146.2021.02.009
张汆,zhangchuan2005@126.com。
2020–08–31
安徽省高校青年人才重点项目(gxyqZD2018113); 滁州学院酶法加工科技创新团队项目(00001702); 滁州学院(经费结转)项目(2017001)。
(责任编校: 刘刚毅)
