铝处理下绣球实时荧光定量PCR内参基因筛选及验证
2021-05-07陈双双齐香玉陈慧杰王华娣秦紫艺邓衍明
陈双双,齐香玉,冯 景,陈慧杰,王华娣,2,秦紫艺,3,邓衍明,2,3
(1.江苏省农业科学院 休闲农业研究所,江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014;2.江苏大学 生命科学学院,江苏 镇江 212013;3.南京农业大学 园艺学院,江苏 南京 210014)
绣球(Hydrangea macrophylla)又名八仙花、紫阳花等,为虎耳草科绣球属植物。其花序密集且生于花枝顶部,花色丰富,观赏价值极高,广泛应用于园林绿化、庭院美化、盆栽等领域;此外,绣球对土壤酸碱度非常敏感,可作为测定土壤酸碱度的指示植物,具有很好的生态价值[1-2]。绣球还有较强的铝耐受和积累能力,部分绣球品种花色可通过调节土壤酸碱度和Al3+含量使萼片呈现蓝色[3-4]。大量研究表明,Al3+在绣球花色由红变蓝过程中起着重要作用;在萼片中,Al3+的积累主要通过铝离子转运蛋白来实现,如质膜铝转运基因(Plasmamembrane Al transporter,PALT)、液泡膜铝转运基因(Vacuolar Al transporter,VALT)等[5-8]。因此,了解关键基因的表达方式将有助于阐明绣球花色变化过程中所涉及的分子机制。
实时荧光定量PCR(qRT-PCR)是检测和定量基因转录水平表达模式的重要技术之一,具有高度的敏感性、特异性、可重复性和准确性;该技术还是当前检测低拷贝数目的基因转录水平的唯一方法[9-10]。RNA稳定性、质量、反转录效率、PCR扩增效率以及样本之间的差异,都会导致基因表达结果分析的差异[9,11]。因此,表达稳定的内参基因对于目的基因表达水平的标准化分析至关重要。最常用的内参基因包括α-肌动蛋白基因(α-actin gene,ACT)、3-磷酸甘油醛脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogenase gene,GAPDH)、18S核糖体RNA基因(18S ribosomal RNA gene,18S)、多聚泛素基因(Polyubiquitin gene,UBQ)、泛素结合酶基因(Ubiquitin conjugating enzyme gene,UBC)、环叶素基因(Cyclophylin gene,CYC)、延伸因子基因(Elongation factor-1α gene,EF-1α)、维管蛋白基因(Tubulin gene,TUB)等。关于绣球铝转运蛋白基因(PALT、VALT、NRAT等)表达分析中,已有研究使用18S作为qRT-PCR的内参基因[6-8,12-13],但对于18S以及其他常用的内参基因如ACT、EF-1α、TUB等在绣球中稳定性的表达分析尚未见报道。为了获得准确的基因表达数据,有必要为绣球选择合适的内参基因并验证其在特定试验条件下的稳定性。
本研究根据绣球转录组数据筛选出10个候选内参基因[14],分别是ACT7、β-TUB、EF-1α、18S、UBC23、DnaJ(伴侣蛋白基因)、VPS33(液泡蛋白分选相关蛋白基因)、TMN12(跨膜超家族成员基因)、UPL7(E3泛素蛋白连接酶基因)、UBP15(泛素羧基末端水解酶基因),利用geNorm[15]、NormFinder[16]、BestKeeper[17]、ΔCt[18]以及RefFinder[19]5种计算方法来分析他们在不同组织及Al2(SO4)3处理下的表达稳定性。同时,以绣球铝转运蛋白基因HmVALT作为目的基因进行表达模式标准化分析,以进一步验证内参基因的可靠性。本研究为进一步探索绣球基因表达分析提供依据。
1 材料和方法
1.1 试验材料
供试材料大花绣球Bailer(商品名:Endless SummerTM,中文名译为无尽夏,Al2(SO4)3处理后花色可由红色变为蓝色,为铝敏感品种)和Ruby(中文名译为红宝石,Al2(SO4)3处理后保持红色不变,为不敏感品种)种植于江苏省农业科学院绣球种质资源圃内。选取长势健壮、无病虫害的植株进行处理,对照组:浇灌不添加Al2(SO4)3的Hoagland营养液(pH 值6.0),Al2(SO4)3处理组:浇灌添加20 mmol/L Al2(SO4)3的Hoagland营养液(pH值 3.0),每7 d浇灌1次,每个处理15盆,每个处理设3次生物学重复。Bailer花色变化后(约21 d),分别取2个品种对照组与处理组的根、叶、萼片(绣球的观赏器官主要是萼片)于液氮中速冻,-80 ℃保存备用。
1.2 总RNA提取与cDNA合成
取样品约1 g于液氮中研磨成粉末,采用RN38 EASYspin plus Plant RNA kit (艾德莱)进行总RNA提取,具体操作方法参考说明书进行。利用Nanadrop-1000和1.0%的琼脂糖凝胶电泳检测总RNA浓度、纯度和完整性。cDNA 第一链合成采用PrimeScriptTMRT Master Mix(TaKaRa)反转录试剂盒进行,反应体系及反应条件参考说明书。反应产物cDNA保存于-20 ℃。
1.3 候选内参基因选择与引物设计
根据文献结合绣球转录组数据,筛选出10个表达量稳定的候选内参基因,包括5个传统内参基因(ACT7、β-TUB、EF-1α、18S、UBC23)及5个新内参基因(DnaJ、VPS33、TMN12、UPL7、UBP15),同时,选取液泡膜铝转运蛋白基因(HmVALT)作为鉴定筛选内参基因可靠性的目标基因(表1)。利用在线引物设计程序Primer 3 plus(http://primer3plus.com/primer3web/primer3web_input.htm)设计qPCR引物。参数设置如下:Tm值为58~62 ℃,GC含量为45%~60%,产物长度为150~250 bp。引物由南京思普金生物科技有限公司合成(表1)。

表1 绣球候选内参基因相关信息Tab.1 The primers information of the candidate reference genes and target genes in Hydrangea macrophylla
1.4 qRT-PCR
qRT-PCR反应在Real time PCR System 7500上进行。反应体系20 μL:cDNA模板2.0 μL,TB Green Premix Ex Taq(Tli RNaseH Plus)(2×)10 μL,引物(10 μmol/L)各0.4 μL,ROX Reference Dye(50×)0.4 μL,ddH2O 6.8 μL。实时荧光定量PCR反应程序如下:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,40个循环;40个PCR循环后,通过熔解曲线分析(60~95 ℃)验证扩增产物的特异性。
1.5 候选内参基因表达稳定性分析
将各样品cDNA混合模板依次稀释5个梯度,每个梯度稀释5倍(50,5-1,5-2,5-3,5-4)进行qRT-PCR。根据qRT-PCR结果,用Ct值绘制标准曲线并利用公式E=(5-1/slope-1)×100%计算扩增效率。
候选内参基因稳定性采用geNorm、NormFinder、BestKeeper和ΔCt 4种程序进行分析评价。其中,最优内参基因数量采用geNorm软件对变异系数进行分析完成。最后,用在线程序RefFinder(https://localhost/RefFinder-master/index.php)综合分析候选内参基因的稳定性。
2 结果与分析
2.1 候选内参基因引物扩增效率分析
采用标准曲线法对各引物扩增效率进行分析,引物的扩增效率为90.9%(TMN12)~102.2%(ACT7),相关系数(Correlation coefficient,R2)变化为0.990 7(18S)~0.999 9(UPL7)(表1)。由此可见,所用引物均具有良好的特异性与扩增效率,可用于后续分析。
2.2 候选内参基因表达丰度分析
将10个候选内参基因在不同品种对照组和处理组不同组织的全部Ct值进行汇总,分析它们在转录水平上的表达丰度的稳定性。10个候选内参基因的Ct值分布为16~39,其中,18S(16~21)和ACT7(17~23)的表达丰度最高,但存在变异;β-TUB(18~23)的表达丰度也较高,其次是UPL7(21~24)和TMN12(20~26)(图1)。从Ct值推测,β-TUB和UPL7可作为候选内参基因。
2.3 候选内参基因表达稳定性分析
2.3.1 geNorm分析 geNorm程序通过计算每个候选内参基因在不同样品中的表达稳定性M值来确定其稳定性,M值越小表明基因的稳定性越高,反之则越低。geNorm程序通常会将稳定性M值低于1.5的候选基因作为内参基因。geNorm分析结果显示,在所有样本、不同组织、Bailer、Ruby中10个内参基因的M值均小于1.5,表明这些候选内参基因的表达稳定性较好(图2)。其中,在绣球不同组织中表达最稳定的候选内参基因是UPL7和β-TUB;在Al2(SO4)3处理条件下,Ruby中表达最稳定的候选内参基因同样是UPL7和β-TUB;而在Al2(SO4)3处理条件下,Bailer中表达最稳定的候选内参基因为UPL7和ACT7;当综合考虑所有样本时,候选内参基因UPL7和β-TUB的M值最小,表达稳定性最好,而EF-1α稳定性最差。
geNorm程序还可通过计算候选内参基因的变异系数(Pairwise variation,Vn/Vn+1)来确定最适的内参基因个数。通常,以0.15作为临界值来确定参考基因的最佳数量。geNorm分析结果显示,Al2(SO4)3处理条件下,Bailer和Ruby变异系数V2/V3(0.106,0.113)小于0.15,表明选择2个内参基因即可满足要求;在绣球不同组织中,变异系数V2/V3(0.161)高于临界值0.15,而V3/V4(0.143)小于0.15,表明需要3个内参基因(UPL7、β-TUB和VPS33);而在本研究中考虑所有样本时,变异系数V2/V3为0.131,低于0.15(图3)。因此,可选用2个内参基因用于Al2(SO4)3处理条件下绣球实时荧光定量PCR标准化分析。
2.3.2 NormFinder分析 NormFinder程序算法与geNorm类似,通过计算内参基因的表达稳定性M值来评价基因的表达稳定性,M值越小则表达稳定性越高。NormFinder分析结果显示,在Al2(SO4)3处理条件下,Bailer中UPL7(0.154)和β-TUB(0.242)表达最稳定,EF-1α(1.536)表达最不稳定;Ruby中UBP15(0.154)和β-TUB(0.424)表达最稳定,而EF-1α(1.918)表达最不稳定;在不同组织中,UBP15(0.274)和β-TUB(0.455)表达最稳定,EF-1α(1.977)表达最不稳定;在综合考虑所有样本时,同样是UBP15(0.230)和β-TUB(0.343)表达最稳定,EF-1α(1.799)表达最不稳定(表2)。
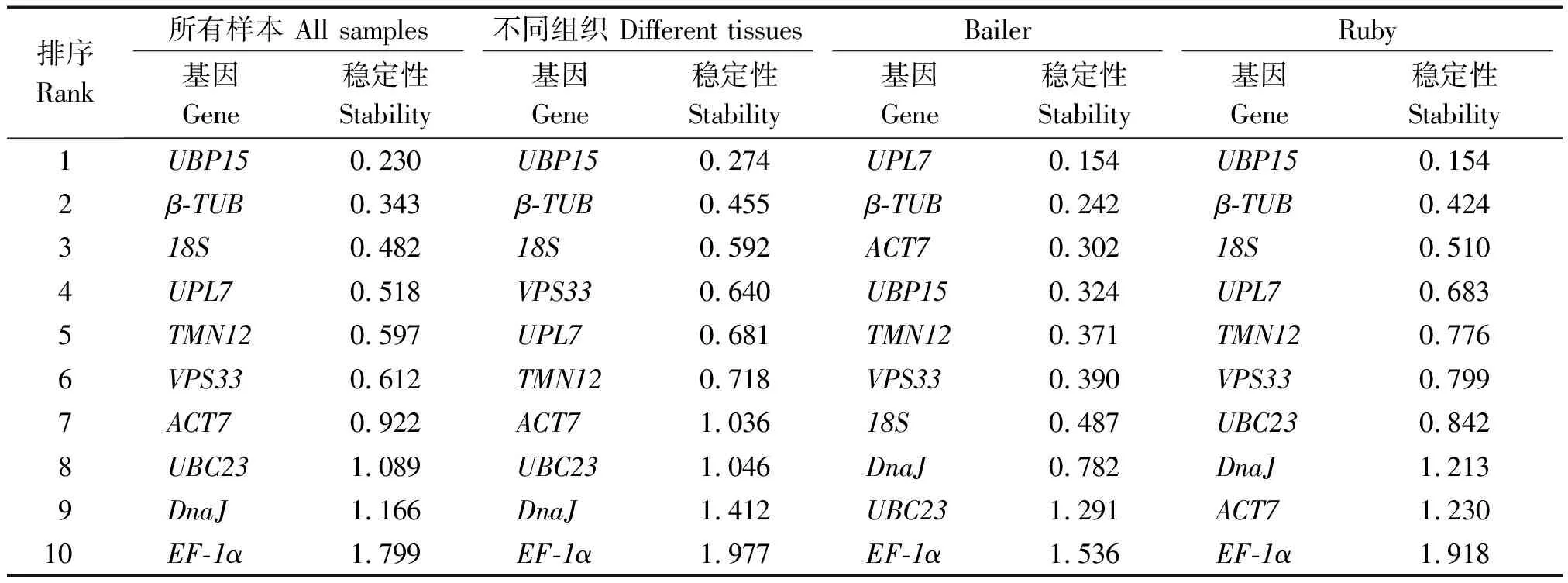
表2 NormFinder 表达稳定性分析Tab.2 Stability analysis of expression genes assayed by NormFinder
2.3.3 BestKeeper分析 BestKeeper程序是通过比较候选内参基因的Ct值所产生的标准偏差(Standard deviation,s)和变异系数(Coefficient of variation,CV)来评价基因表达稳定性,s和CV值越小则稳定性越好,反之则稳定性越差。BestKeeper程序分析结果见表3,在Al2(SO4)3处理条件下,Bailer中DnaJ(s=0.36)、18S(s=0.62)、β-TUB(s=0.80)、VPS33(s=0.84)、UPL7(s=0.89)和UBC23(s=0.99)的s值小于1,Ruby中DnaJ(s=0.54)、VPS33(s=0.71)、UBC23(s=0.73)、UPL7(s=0.79)和β-TUB(s=0.91)的s值小于1,说明这些候选内参基因的表达稳定性较好;在不同组织中,比较稳定的候选内参基因为DnaJ(s=0.55)、UPL7(s=0.84)、β-TUB(s=0.87)和VPS33(s=0.87);在所有样本中,DnaJ(s=0.46)、VPS33(s=0.84)、β-TUB(s=0.87)和UPL7(s=0.88)表达稳定性最高,EF-1α(s=2.45)稳定性最差(表3)。
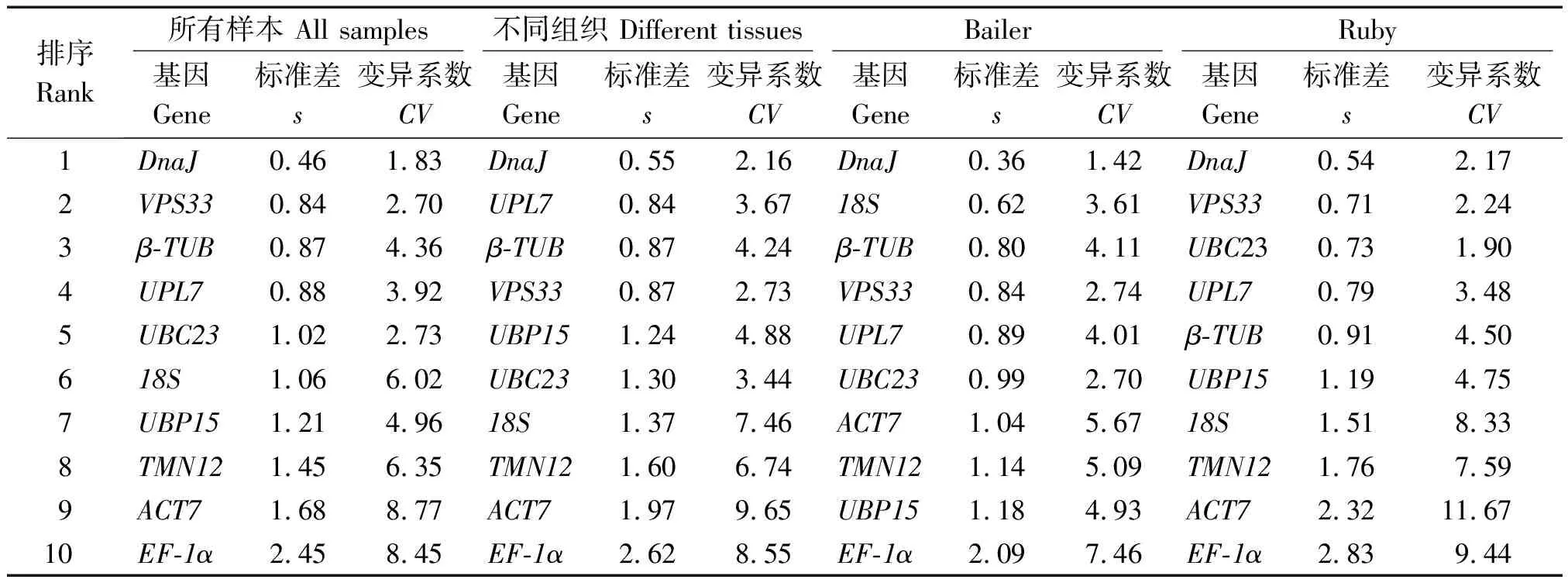
表3 BestKeeper 表达稳定性分析Tab.3 Expression stability was calculated by BestKeeper
2.3.4 ΔCt分析 ΔCt分析是通过比较候选内参基因之间的ΔCt值来评价基因稳定性的方法。结果显示,在Al2(SO4)3处理条件下,Bailer中UPL7和β-TUB表达最稳定,Ruby中UBP15和β-TUB表达最稳定;在不同组织中,β-TUB和UBP15的表达稳定性最好;在所有样本中,同样是β-TUB和UBP15的表达稳定性最好,稳定性最差的是EF-1α(表4)。
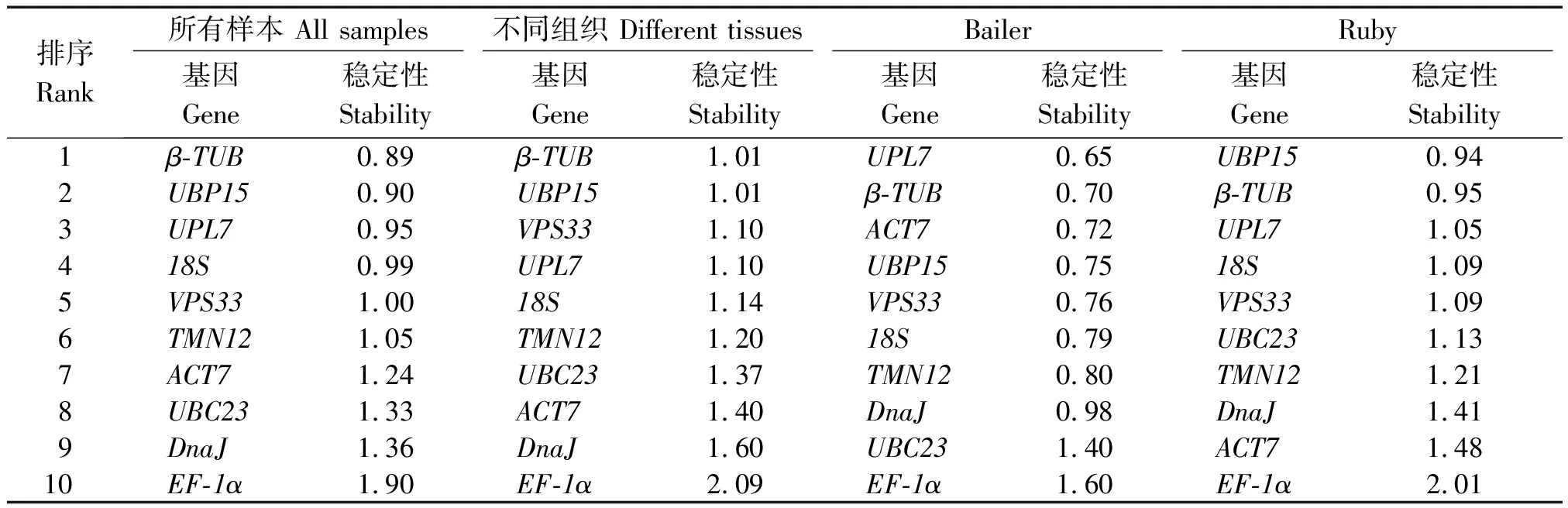
表4 ΔCt表达稳定性分析Tab.4 Expression stability was analyzed by ΔCt
2.3.5 RefFinder分析 geNorm、NormFinder、BestKeeper和ΔCt 4种程序根据候选内参基因表达稳定性进行排名,结果存在差异。因此,利用RefFinder方法来建立候选内参基因稳定性的综合排名。结果显示,在所有样本中,候选内参基因稳定性由高到低依次为:β-TUB>UPL7>UBP15>VPS33>18S>DnaJ>TMN12>UBC23>ACT7>EF-1α(表5、图4);在不同组织器官中,候选内参基因稳定性由高到低依次为:β-TUB>UBP15>UPL7>VPS33>18S>DnaJ>TMN12>UBC23>ACT7>EF-1α(表6、图4);在Al2(SO4)3处理条件下,Bailer中候选内参基因稳定性由高到低依次为:UPL7>β-TUB>ACT7>18S>VPS33>DnaJ>UBP15>TMN12>UBC23>EF-1α(表7、图4),Ruby中候选内参基因稳定性由高到低依次为:β-TUB>UBP15>UPL7>VPS33>DnaJ>UBC23>18S>TMN12>ACT7>EF-1α表达最稳定(表8、图4)。
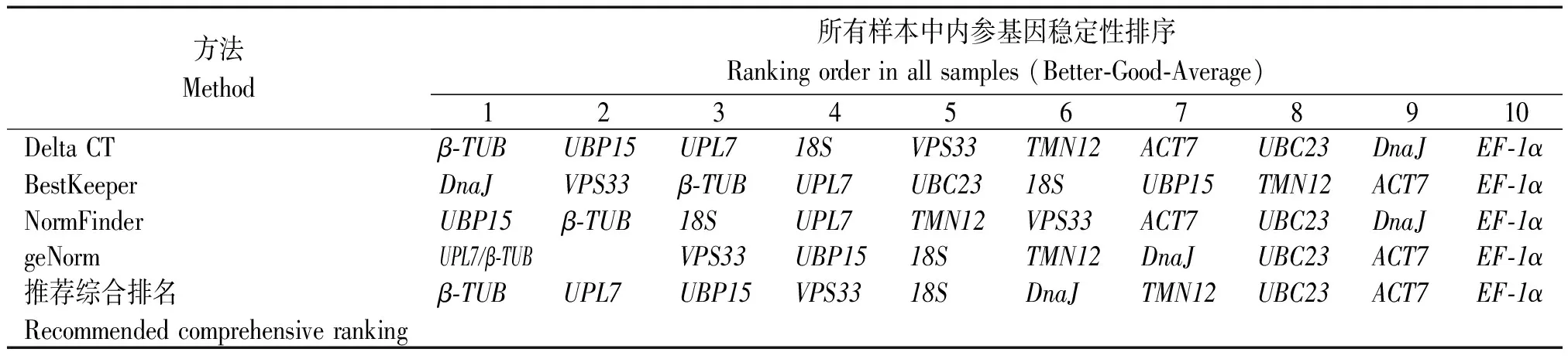
表5 RefFinder 表达稳定性分析-所有样本Tab.5 Stability analysis was calculated by RefFinder-all samples
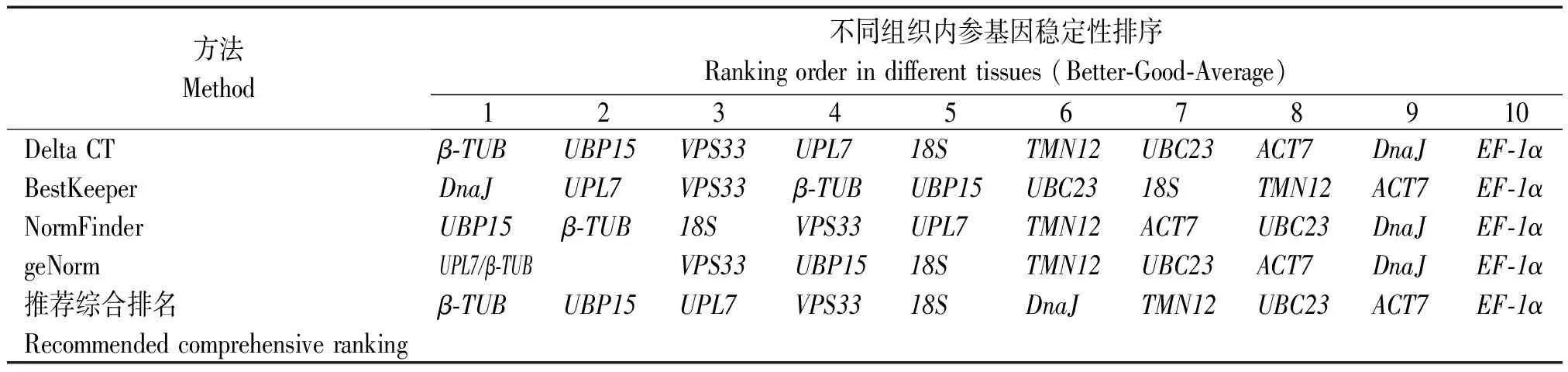
表6 RefFinder 表达稳定性分析-不同组织Tab.6 Stability analysis was calculated by RefFinder-tissues

表7 RefFinder 表达稳定性分析-BailerTab.7 Stability analysis was calculated by RefFinder-Bailer
2.4 绣球铝转运蛋白基因表达分析
为了进一步验证所筛选出来的候选内参基因的稳定性,以稳定性最好的UPL7、β-TUB以及UPL7+β-TUB分别作为内参基因,同时以稳定性最差的EF-1α作为对照,分析绣球铝转运蛋白基因HmVALT的表达模式。结果如图5所示,以UPL7、β-TUB以及UPL7+β-TUB分别作为内参基因,目的基因HmVALT

表8 RefFinder 表达稳定性分析-RubyTab.8 Stability analysis was calculated by RefFinder-Ruby
在Bailer处理组根和萼片中表达量最高,且趋势一致;而在Ruby中,HmVALT在处理组根中表达量最高,表达模式一致。但EF-1α做内参基因时HmVALT的表达模式却有别于二者,而且表达丰度较低。因此UPL7、β-TUB可作为绣球内参基因进行功能基因的表达研究。
3 讨论与结论
qRT-PCR因其高灵敏度、特异性强、准确性高和定量范围广而广泛应用在基因表达水平分析及基因调控模式研究中[11]。为了在qRT-PCR分析中获得可靠、准确的定量结果,选择和验证合适的内参基因进行qRT-PCR数据分析至关重要。理想的内参基因在不同的发育阶段、不同组织器官以及不同的胁迫条件下都可以稳定表达即产生稳定的Ct值。本研究通过转录组数据及文献参考筛选出10个候选内参基因,包括5个传统内参基因(ACT7、β-TUB、EF-1α、18S、UBC23)及5个新内参基因(DnaJ、VPS33、TMN12、UPL7、UBP15),分析其在不同组织、铝处理条件下实时定量PCR的表达稳定性。
通过geNorm、NormFinder、BestKeeper和ΔCt 4种算法,这10个候选内参基因在表达稳定性方面表现各异,4种算法生产的排名顺序也不完全相同。本研究中,DanJ在BestKeeper算法中排序最好,即表达稳定性最好,而在geNorm、NormFinder、和ΔCt 3种算法中排序较差;β-TUB、UPL7和UBP15在BestKeeper算法中排序中等,而在其他3种算法中排序较好,表达稳定性好。这些结果与太阳花、剑麻、朱顶红等的内参基因筛选研究结果类似,这种排序的不同可能是由不同算法的统计计算原理不同所导致[20-22]。RefFinder是一种综合统计程序,是综合分析不同软件得到的结果进行排名,已被广泛用于内参基因筛选的研究中[20,23-24]。基于RefFinder的综合分析排名,β-TUB、UPL7和UBP15被认为是绣球中表达稳定的内参基因。因此,RefFinder综合分析不同程序获得的结果可能会使本研究中候选内参基因稳定性排序的准确性更高,这表明应选用多个不同的算法对参考基因进行稳定性评估。
越来越多的研究表明,常用的内参基因在不同的试验条件、不同组织中稳定性的表现不同。如剑麻中,内参基因β-TUB4、PP2A-1(Protein phosphates 2 gene,蛋白磷酸基因)和RPⅡ(RNA polymeraseⅡ gene,RNA聚合酶基因)在干旱处理条件下是最稳定的,β-TUB4、ARF2(ADP-Ribosylation factor 2 gene,ADP-核糖基化因子2基因)和GAPDH(Glyceraldehyde-3-phosphate dehydrogenase gene,甘油醛-3-磷酸脱氢酶基因)在复水条件下稳定性较好,CYC-A、GAPDH和CUL-1(Cullin gene,泛素化连接酶基因)热处理后稳定性较好,CUL-1、WIN-1和ACT11是冷处理条件下稳定性较好的内参基因,而盐处理条件下稳定性较好的内参基因是β-TUB4、RPⅡ和ARF2[21];大白菜-结球甘蓝易位系经生长素IAA处理后,稳定性最好的内参基因是BcTIP41(Tonop last intrinsic proteins,液泡膜内在蛋白基因)和ACTIN,而生长素抑制剂TIBA处理后,UKN1(Hypothetical,假设蛋白基因)和BcTIP41的稳定性较好,UKN1和TUB4在营养生长阶段表达最为稳定,DnaJ(DnaJ-Like,锌指蛋白基因)、ACTIN和PP2A是花发育阶段表达较稳定的内参基因[25];GAPDH2是朱顶红不同组织器官中表达稳定性较好的内参基因[22]。在本研究中,β-TUB、UPL7和UBP15是在不同组织中表达较稳定的内参基因,而铝处理条件下,Bailer和Ruby中表达稳定性较好的基因分别是UPL7、β-TUB、ACT7和β-TUB、UBP15、UPL7。在非模式植物中,与传统的内参基因相比,一些新基因可能表达出较好的稳定性。本研究中,UPL7在绣球中表达相对稳定,其次是UBP15。UPL7可通过调控调节蛋白的泛素化过程参与细胞内的多种生理过程,参与植物体内重要的蛋白降解途径。在柑橘中,UPL是研究病毒侵染的内参基因[26];海滨雀稗中,UPL、PP2A和EF-1α组合在干旱处理(PEG)的叶片中稳定表达,是最适的内参基因组合[27]。UBP15属于泛素特异性加工家族,参与蛋白质的降解调节。杨树不定根再生阶段,UBP被认为是最佳的内参基因[28];UBP22在受到或未被白线虫感染的马铃薯植株根中均能稳定表达[29]。因此,不同物种、不同试验条件、不同组织中内参基因的稳定性存在一定差异,在进行目的基因表达分析之前,需对候选内参基因的表达稳定性进行评价和验证。
当在特定的试验条件下,选择2个或者多个内参基因进行目的基因表达量分析时,结果更加可靠、准确[24-25,30]。geNorm程序可以用于确定稳定内参基因最佳数量,以进行准确的基因表达分析。通常,以0.15(Vn/Vn+1)作为临界值用于计算内参基因的最佳组合。本研究中,Al2(SO4)3处理条件下,Bailer和Ruby以及所有样本的变异系数(V2/V3)分别为0.106,0.113,0.131均小于0.15,表明在铝处理条件下,选用2个内参基因足以分析目的基因的表达量;而在不同组织的分析中,变异系数V2/V3为0.161,大于0.15,V3/V4为0.143,可能需要3个内参基因才能满足需求,而导致这种变异的原因可能是材料来源的不同。根据已有文献报道,2个稳定的内参基因足以满足目的基因表达研究的需求[21-22,25,30]。结合qRT-PCR Ct值分析,UBP15Ct值相对较高,因此,铝处理条件下绣球较合适的内参基因为β-TUB和UPL7。
通过研究Al2(SO4)3处理条件下铝转运蛋白HmVALT作为靶基因的表达谱,进一步验证了鉴定出的最稳定(β-TUB和UPL7)和最不稳定(EF-1α)的内参基因的可靠性。使用最稳定的基因做内参基因时,目的基因HmVALT的表达丰度较高且表达模式一致,而不稳定的EF-1α作内参基因时,HmVALT的表达模式出现变化且HmVALT的表达丰度相对降低。这些结果说明,选择合适内参基因对于分析目的基因表达变化至关重要。
本研究基于qRT-PCR对绣球铝处理条件下的内参基因进行了筛选,确定β-TUB和UPL7为最适的内参基因。研究结果为后续开展绣球功能基因表达分析奠定了理论基础。
