小白菊内酯及其衍生物抗肿瘤作用机制研究进展
2021-05-06史胜利徐会敏马利刚郑晓珂安娜王蕾河南中医药大学药学院郑州450046河南中医药大学基础医学院郑州450046
史胜利,徐会敏,马利刚,郑晓珂,安娜,王蕾(.河南中医药大学 药学院,郑州 450046;2.河南中医药大学 基础医学院,郑州 450046)
小白菊内酯(Parthenolide)是从菊科植物野甘菊(Dendranthema lavandulifolium)、艾菊(Tanacetum vulgareL.)、木兰科植物观光木[Michelia odora(Chun)Nooteboom& B.L.Chen]中提取分离出来的一种倍半萜烯内酯,其分子式为C15H20O3,相对分子量为248.3[1]。目前,已发现小白菊内酯在不同肿瘤中通过多种作用机制发挥抗肿瘤作用,其中包括诱导细胞凋亡、抑制细胞增殖、抑制肿瘤血管生成和逆转肿瘤细胞耐药性等[2]。小白菊内酯对肿瘤细胞的抑制作用呈剂量依赖,随剂量增大,抑制作用加强,但对正常细胞没有毒性或只有低毒性[3]。因此,小白菊内酯有望成为一种新的抗肿瘤药物。近年来,对小白菊内酯的研究越来越多,本文尝试对近几年小白菊内酯及其衍生物(结构见图1)在抗白血病、胶质瘤、肺癌等肿瘤的研究进展进行一次比较全面的综述,为小白菊内酯治疗上述肿瘤提供参考。

图1 小白菊内酯及其衍生物的分子结构图Fig 1 Molecular structures of parthenolide and its derivatives
1 白血病
白血病是大量尚未完全发育的白细胞在骨髓中异常堆积而成的一种癌症,属于我国十大高发的恶性肿瘤之一[4],其中急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)主要见于儿童[5],而急性髓性白血病(acute myeloid leukaemia,AML)则在成人中最常见[6]。小白菊内酯对淋巴白血病干细胞(LSC)不同细胞亚群的药效不同,其药效高低主要取决于核转录因子κB(nuclear factor kappa-B,NF-κB)的表达水平。相较于CD34+、CD38+、CD19+等对小白菊内酯敏感的白血病干细胞,对小白菊内酯不敏感的脐带血造血干细胞可表达更高水平的NFκB p65[7]。对于AML 的U937 细胞,小白菊内酯可以降低骨桥蛋白(osteopontin,OPN)的表达水平,并下调Rel BmRNA 的表达,使AKT1、mTOR、同源性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)以 及β-catenin的编码基因CTNNB1等的mRNA 表达均下降。OPN 蛋白水平下降,可增加肿瘤细胞对小白菊内酯的敏感性。Rel B 蛋白是NF-κB 的一个亚基,小白菊内酯可通过抑制NF-κB 信号通路,影响Wnt/β-catenin、PI3K/AKT/mTOR 等信号通路,抑制肿瘤细胞增殖并诱导其凋亡[8-9]。与U937 细胞不同,在AML 的KG1a 细胞中小白菊内酯可下调AKT1、mTOR、PTEN和β-catenin等基因的mRNA 的表达,但促进OPN 蛋白表达,增强CD34+/CD123+白血病干细胞对小白菊内酯的耐药性[10]。骨髓基质细胞(bone marrow stromal cells,BMSCs)是造血微环境中的主要成分,分泌的各种物质可介导其对白血病细胞的黏附,增强白血病细胞的增殖与抗凋亡能力,是引起白血病化疗耐药及复发的重要原因。小白菊内酯可通过降低血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)的表达,抑制BMSCs 对Jurkat 肿瘤细胞的黏附作用,减弱骨髓微环境对白血病细胞的保护作用,使其对化疗更敏感[11]。此外,基质细胞衍生因子1蛋白(stromal cell-derived factor 1,SDF-1)是由CXCL12基因编码的一类骨髓造血微环境的趋化因子,其配体CXCR4 是一类G 蛋白偶联受体,主要在造血干细胞表面表达。SDF-1 及其受体CXCR4 是调节造血微环境的重要通路,可促进血液肿瘤细胞的迁移和浸润。小白菊内酯可剂量依赖性地降低CXCL12、CXCR4的mRNA 含量,降低CXCR4 蛋白表达[12],从而抑制白血病细胞的迁移与浸润。小白菊内酯还可剂量依赖性地降低c-myc、Bcl-2、cyclinA1、cyclinE等mRNA 含量,抑制细胞增殖与细胞周期基因的表达。因此,小白菊内酯能够抑制白血病干细胞增殖并使细胞周期停滞于G2/M 期[13]。
为了提高小白菊内酯的水溶性和药效,常对小白菊内酯进行化学修饰得到相关衍生物(见图1)。小白菊内酯衍生物1 和2 处理人骨髓白血病MOLM-13 细胞和嗜酸性粒细胞白血病EOL-1细胞后,通过抑制NF-κB,激活p53,增加活性氧(reactive oxygen species,ROS),诱导癌细胞凋亡,但不影响正常细胞[14]。在人急性单核细胞白血病THP-1 细胞中,小白菊内酯炔化物3 通过修饰热激蛋白HSP72 的赖氨酸、组氨酸等残基,引发细胞热激反应,抑制细胞增殖[15]。小白菊内酯衍生物4 可作为促氧化剂,引发氧化应激反应,诱导细胞死亡,也可抑制核转录因子κB 抑制蛋白激酶β(inhibitor kappa B kinaseβ,IKKβ)活性,阻断NF-κB 信号通路,抑制慢性淋巴细胞白血病MEC1 细胞增殖[16]。小白菊内酯的苯胺衍生物5、6、7 可与NF-κB 的cys38 残基结合,抑制DNA 与NF-κB p65 结合,进而抑制MEC1 细胞增殖[17]。小白菊内酯衍生物8(dimethylamino parthenolide,DMAPT)可下调细胞周期蛋白D1(cyclin D1)和细胞周期蛋白A(cyclin A),使细胞停滞于G0和G2期,还使细胞内ROS 水平升高并抑制NF-κB 激活,抑制慢性髓性白血病(chronic myeloid leuakemia,CML)细胞增殖[18]。小白菊内酯与伏立诺他(SAHA)反应生成的衍生物9 可显著降低组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)和酶6(HDAC6) 的蛋白水平,并通过线粒体途径诱导急性髄系白血病HL-60/ADR 癌细胞凋亡,还可降低ATP 结合盒亚家族C1(ATP binding cassette subfamily C1,ABCC1)表达水平,使癌细胞内药物浓度明显提高,克服癌细胞的耐药性[19]。小白菊内酯衍生物10 可上调Bax 和c-Jun 等凋亡相关蛋白的表达,使p38、JUK 等发生磷酸化而激活,抑制细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinases-1/2,Erk1/2)的活性;也可下调抗凋亡蛋白c-myc、X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP) 和Bcl-2, 上调caspase-3/9 和聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)-polymerase,PARP],诱导细胞凋亡;通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路抑制KG1a 细胞和HL-60 细胞增殖[20]。小白菊内酯衍生物11、12对人外周血白血病T 细胞Jurkat、套细胞淋巴瘤JeKo-1、HeLa 宫颈癌和人神经上皮瘤SK-N-MC 等细胞株有较强毒性,而小白菊内酯衍生物13、14对人结肠癌HCT-116 细胞有特异毒性[21]。小白菊内酯与噻唑烷二酮(thiazolidinedione)反应合成了一系列新产物,对其进行细胞毒性评估发现衍生物15 对人红白血病HEL、人前列腺癌PC3 和人乳腺癌MDA-MB-231 等恶性肿瘤细胞均表现出中等细胞毒性作用,对MDA-MB-231 细胞的毒性约是小白菊内酯的8 倍[22]。此外,利用化学酶法使小白菊内酯碳环主链上C9 和/或C14 发生羟化、酰化、烷化等反应,获得一些可显著提高的抗原发性急性髓系白血病活性,且对正常成熟的造血祖细胞表现出低毒性的衍生物,与小白菊内酯相比,衍生物16 对KG1a 细胞和HL-60 细胞的抑制作用分别增强8.7 倍和3.8 倍,而对正常细胞毒性较低,抗急性髓性白血病活性较高[23],衍生物17、18 对AML 细胞的毒性增强[24]。
2 胶质瘤
胶质瘤是临床上常见的一种颅脑神经系统肿瘤,生长迅速、发病隐逸、恶性程度极高,术后短期内可复发,临床治疗效果尚不理想,至今仍是一种预后最差的神经系统肿瘤,所以研究小白菊内酯抑制胶质瘤的作用机制愈显迫切[25]。小白菊内酯处理人脑恶性胶质瘤细胞U-87 MG 后,可使其p53 的392 位丝氨酸残基磷酸化,抑制其下游caspase 3、Bax、cyclin D1等基因的表达,阻滞细胞周期于S 期、G2/M 期,抑制U-87 MG 细胞增殖,诱导其凋亡[26]。此外,小白菊内酯还通过降低糖原合成酶激酶-3β(GSK3β)的9 位丝氨酸残基磷酸化水平,抑制SNAIL 蛋白表达及入核,促进E-cadherin 蛋白的表达,从而抑制U-87 MG 细胞的迁移和侵袭[27]。
衍生物8(LC-1,DMAPT)可抑制U-87 MG、胶质母细胞瘤GBM6、荧光标记小鼠胶质瘤GL261-GFP-Luc 等3 种胶质瘤细胞生长并延长荷瘤小鼠的生存时间,同时对正常细胞的毒性极低。通过小鼠恶性胶质瘤模型发现,衍生物8 可通过血脑屏障,在脑组织中积累到微摩尔水平,并在延长口服给药时间时是无毒的[28]。在糖酵解中,细胞内丙酮酸激酶M2(pyruvate kinase M2,PKM2)有高活性四聚体和低活性二聚体两种形式,两者处于平衡状态。四聚体PKM2 在癌细胞的糖代谢中发挥重要作用,而位于细胞核内的二聚体PKM2 则对肿瘤的增殖和迁移至关重要。PKM2 激活后形成PKM2 四聚体,可减少PKM2 转入细胞核,从而抑制肿瘤发生。衍生物19 的抗多形性胶质母细胞瘤作用主要依赖于PKM2 的表达。衍生物19 可与PKM2 的424 位半胱氨酸的巯基直接结合而使之激活,阻止其进入细胞核,并抑制信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3),激活丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase 4,PDK4),同时上调E-cadherin 与Bax,下调vimentin、Bcl-2 和Bclxl,抑制U-87 细胞和神经胶质母细胞瘤U118 细胞增殖和迁移,诱导细胞凋亡[29]。
3 肺癌
肺癌是全球发病率和死亡率最高的恶性肿瘤,手术是其主要的治疗方式,术后辅助放疗和化疗,但患者生存率仍然较低[30]。小白菊内酯通过抑制B-raf 和c-myc 的表达及MAPK 和Erk的磷酸化以阻断MAPK/Erk 信号通路,还可抑制STAT3 的活性,进而抑制人肺腺癌GLC-82 细胞增殖和迁移,并诱导其凋亡[31]。小白菊内酯可阻断IGF-1R(growth factor 1 receptor)、AKT(protein kinase B,PKB) 和FoxO3α(forkhead box O3α)的磷酸化,也可抑制IGF-1 诱导的AKT与FoxO3α磷酸化。提示小白菊内酯可通过抑制IGF-1R 介导的PI3K/AKT /Fox O3α信号传导而抑制A549 和H1299 等人非小细胞肺癌细胞的增殖和迁移[32]。小白菊内酯通过抑制血管内皮生长因子(vascular endothelial growth factor,VEGF) 表达,下调Bcl-2 表达,上调E2F1、TP53、生长阻滞与DNA 损伤基因45(the growth arrest and DNA damage-inducible gene 45,GADD45)、BAX、BIM和CASP-3/7/8/9,激活p53 依赖细胞凋亡途径并抑制血管发生,而发挥抗癌作用[33]。在表皮生长因子受体(the epidermal growth factor receptor,EGFR)突变型肺癌细胞中,小白菊内酯可下调p-EGFR、AKT 和Erk 的表达,抑制EGFR/Erk和EGFR/AKT 信号通路,诱导非小细胞肺癌细胞生长抑制和凋亡[34]。小白菊内酯能抑制非小细胞肺癌H1975 细胞的侵袭和迁移,并诱导其凋亡(机制可能与AKT 活性被抑制有关),进而调节PI3K/AKT 信号通路下游靶蛋白Bcl-2、Bax、caspase-3、缺氧诱导因子1α(hypoxia inducing factor 1α,HIF-1α)及基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达,发挥抗肿瘤作用[35]。尼古丁可使小胶质细胞的极化偏向M2 型,增加IGF-1 和CC 趋化因子配体20(CC chemokine ligand 20,CCL20)的分泌,使肺癌恶化和干细胞化,并使肺癌向脑部迁移。此外,尼古丁增强了小胶质细胞表达SIRPα,并限制其吞噬能力。小白菊内酯可有效抑制尼古丁诱导小胶质细胞向M2 表型极化,增加M1 表型小胶质细胞,抑制肺癌向脑部迁移[36]。小白菊内酯可与Erk2 的34 位甘氨酸、54 位赖氨酸和157 位亮氨酸等氨基酸残基形成氢键,抑制Erk2 活性,阻断Erk2/NF-κB/Snail 信号通路,下调人小细胞肺癌NCI-H446 细胞和人大细胞肺癌NCI-H460 细胞内vimentin、N-cadherin、VE-cadherin 等间充质细胞标志蛋白的表达,上调E-cadherin、Occludin、EMA 等上皮细胞标志蛋白的表达,抑制这两种细胞系的上皮-间质转化(epithelial-to-mesenchymal transition,EMT),抑制肿瘤细胞增殖、迁移和浸润[37]。经小白菊内酯处理后,NCI-H446 细胞中NF-κB mRNA 及蛋白的表达均被下调,但caspase-3、caspase-8、caspase-9 等凋亡因子的mRNA 及蛋白表达被上调,提示小白菊内酯可通过抑制NF-κB 信号通路以及活化caspase 系统来抑制肿瘤细胞的增殖并诱导其凋亡[38]。
在非小细胞肺癌A549/shCDH1 细胞中,小白菊内酯可显著地上调死亡受体5(death receptor 5,DR5)、佛波醇-12-肉豆蔻酸酯-13-乙酸酯诱导的蛋白1(phorbol-12-myristate-13-acetateinduced protein 1,PMAIP1)、转录激活因子-4(activating transcription factor 4,ATF4)和DNA损伤诱导转录蛋白3(DNA damage inducible transcript 3,DDIT3)等蛋白的表达,并下调CASP-8 和FADD 样凋亡调节因子(caspase 8 and FADD like apoptosis regulator,CFLAR)、骨髓细胞白血病因子1(myeloid cell leukemia sequence 1,MCL1)的表达。小白菊内酯诱发外源性细胞凋亡,还通过增加PMAIP1 表达和降低MCL1水平,诱导非小细胞肺癌内源性细胞凋亡。此外,小白菊内酯还可增加内质网核信号转导蛋白1(endoplasmic reticulum to nucleussignaling 1,ERN1)、热休克蛋白5(heat shock protein family A member 5,HSPA5)、p-EIF2A、ATF4 和DDIT3 等内质网应激特征性蛋白的表达,表明小白菊内酯可通过引发内质网应激反应诱导非小细胞肺癌细胞凋亡[39]。
4 小白菊内酯及其衍生物的抗肿瘤机制
小白菊内酯可诱导肿瘤细胞凋亡,且不损伤正常细胞,可作为潜在的抗肿瘤药物[40],但因其在机体内的溶解度低,使得血浆中小白菊内酯浓度较低,影响其药效发挥[41]。小白菊内酯分子的α-亚甲基-γ-内酯环和环氧结构均具有细胞毒性,可与巯基酶等功能蛋白反应。为了改善小白菊内酯的溶解性和抗肿瘤活性,可通过多种方法对其碳环结构的C9[22]、C13[42]、C14[22-23]等原子及双键进行改造。
由表1可知,小白菊内酯以NF-κB、STATs、应激活化蛋白酶(JNK)、MAPK 等多种信号通路中的关键蛋白为作用靶点,通过使细胞内ROS 浓度增加,阻滞细胞周期等,抑制肿瘤细胞增殖、迁移和浸润,并诱导其凋亡。NF-κB 属于NF-κB/Rel 蛋白家族,是一种能与免疫球蛋白κ轻链基因的增强子κB 序列特异结合并调节该基因表达的核蛋白,是小白菊内酯作用的主要靶点[43]。NFκB/Rel 家族还有P50、P52、P65、c-Rel/Rel、RelB等亚基蛋白[44]。它们的N-末端均有Rel 同源区(Rel homology domain,RHD),内含DNA 结合区、二聚体化区和核定位序列,可与DNAκB 序列结合,参与形成同源或异源二聚体,与IκB 相互作用激活NF-κB,使其从细胞质向细胞核转移等功能[45]。NF-κB 信号通路包括受体和受体近端信号衔接蛋白、IκB 激酶(IKK)、NF-κB 二聚体和IκB 家族等。正常情况下,细胞质中NF-κB 是由p65、p50、IκB-α组成的无活性三聚体[46]。当细胞癌变后,IKK 被激活,再使IκB 蛋白磷酸化、泛素化而被降解。NF-κB 二聚体被释放并激活,暴露出核定位序列(NLS),被转移到细胞核中与DNA 特异序列相结合,促进cyclinD1、c-myc、MMP-9、VEGF等基因转录。在细胞中,该通路的持续激活会使细胞生长失控,导致癌变[47]。

表1 小白菊内酯作用靶点Tab 1 Related target of parthenolide
小白菊内酯及其衍生物可从不同水平作用于NF-κB 信号通路的不同位点,阻断信号通路,干扰细胞增殖,甚至诱导其凋亡(见表1)。例如,小白菊内酯与ErK2 形成氢键而结合,抑制ErK2的活性,阻断ErK2/NF-κB/Snail 信号通路,抑制NF-κB 激活,阻断NCI-H446细胞和NCI-H460细胞的上皮-间质转化,抑制其增殖。骨桥蛋白(OPN)是NF-κB 的重要激活因子[48-49]。小白菊内酯可下调NF-κB 亚基Rel B 蛋白及骨桥蛋白的表达,阻断NF-κB 信号通路,抑制U937 AML 细胞增殖,并诱导其凋亡。B-raf 蛋白是由原癌基因BRAF 编码的、MAPK 信号通路中的丝氨酸-苏氨酸蛋白激酶,其激活可促进c-myc癌基因的表达[50-51]。小白菊内酯可抑制GLC-82 细胞内癌基因BRAF与c-myc的表达,同时抑制MAPK 与Erk 的磷酸化,阻断MAPK/Erk 信号通路,抑制细胞增殖和迁移,并诱导其凋亡。此外,小白菊内酯可使U-87 MG 细胞的抑癌蛋白p53 磷酸化,干扰其下游基因表达,阻滞细胞周期,抑制细胞增殖,并诱导其凋亡(见表1)。
小白菊内酯衍生物可直接作用于肿瘤增殖的相关蛋白,抑制其活性。衍生物5 可直接与NFκB p65 亚基结合,抑制其与DNA 结合,影响其生物学活性的发挥,进而抑制MEC1 细胞增殖。小白菊内酯及衍生物16、衍生物19 可抑制致癌因子STAT3 的活性,或阻断STAT3 信号通路,抑制GLC-82、U-87 和U118 等GBM 细胞增殖和迁移,并诱导细胞凋亡。
小白菊内酯衍生物的抗肿瘤活性基本与小白菊内酯一致,但也有部分衍生物的活性有所变化(见表2)。衍生物3 的药效虽不如小白菊内酯,但可与热激蛋白Hsp72 作用,引发热激反应,使细胞凋亡。衍生物4 和8 对MEC1 细胞的EC50稍低于小白菊内酯,表示它们的细胞毒性比小白菊内酯稍高。此外,衍生物5、6、7 对MEC1 细胞的EC50比小白菊内酯高,说明它们对肿瘤细胞的毒性较低,而安全性较高。衍生物8 与小白菊内酯对CML 细胞的IC50相当,但其水溶性比小白菊内酯好。衍生物11、12 对特定类型肿瘤的细胞毒性增强,而衍生物13 则对多种类型肿瘤细胞的毒性都增强。小白菊内酯衍生物1、2、9、10、15、16、19 对MOLM-13、EOL-1、HL-60/ADR、KG1a 等肿瘤细胞的IC50都显著低于小白菊内酯,说明上述衍生物对相应肿瘤细胞的抑制作用都明显强于小白菊内酯。还有衍生物11、12、13、14、17、18 等 对HCT-116、Jurkat、JeKo-1、Hela、SK-N-MC 等肿瘤细胞的LC50比小白菊内酯明显低,表示这些物质对上述肿瘤细胞的毒性明显强于小白菊内酯。对小白菊内酯及其衍生物作用机制和靶点的深入研究,将更加有利于小白菊内酯的修饰和改造,研发药效更强的小白菊内酯衍生物。
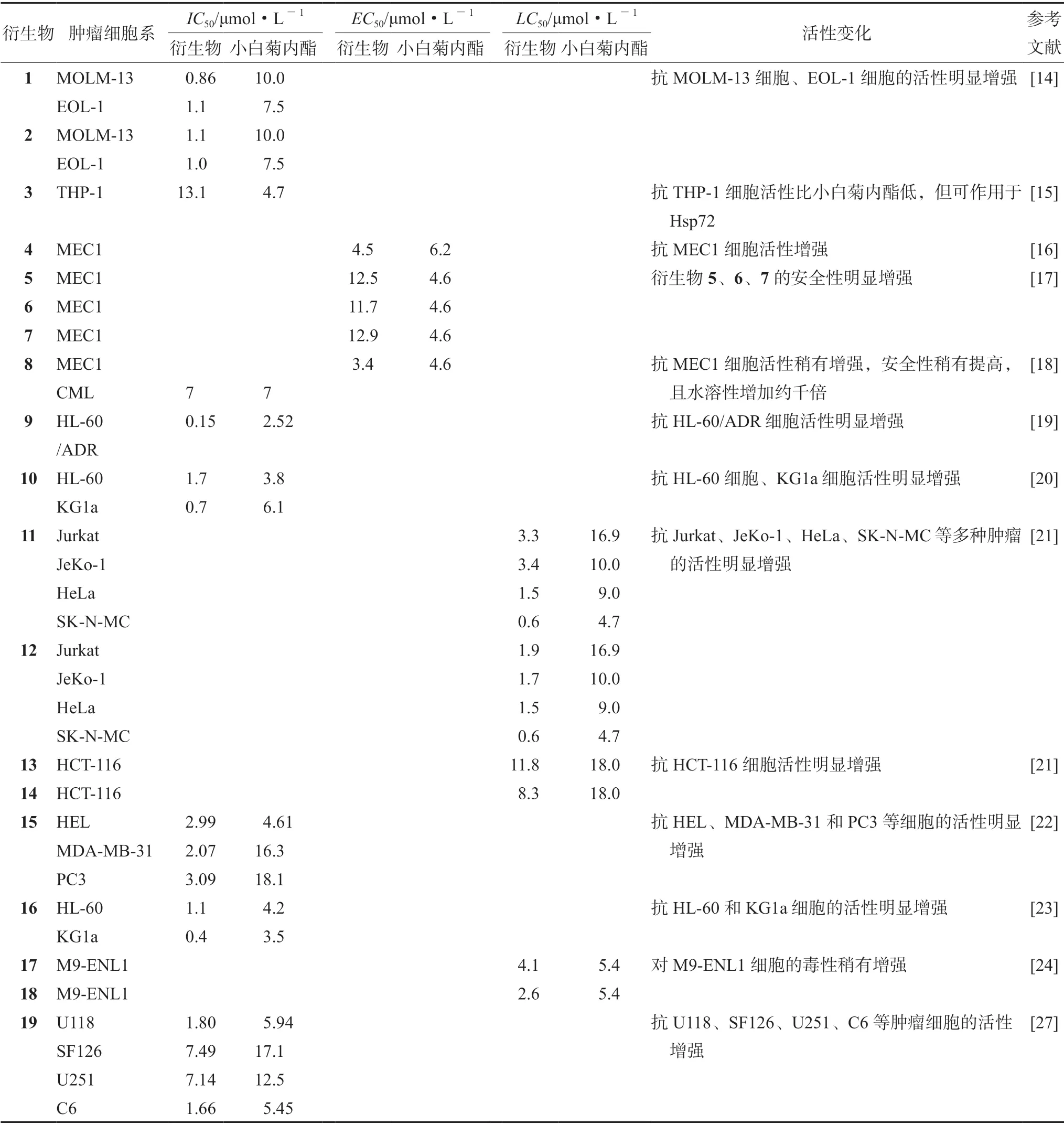
表2 小白菊内酯衍生物及其活性Tab 2 Derivatives of parthenolide and their activities
目前,发现小白菊内酯及其衍生物抗白血病、胶质瘤和肺癌的主要作用机制为抑制 NFκB、p53、STAT3 等信号通路。但对小白菊内酯抗白血病、胶质瘤和肺癌作用机制及其药理作用研究还存在不足,有待深入。此外,尽管小白菊内酯在体外实验表现出多种抗肿瘤效应,且对正常细胞的毒副作用较低,有望成为一种新的抗肿瘤药物,但其在体内的溶解性低而表现出较弱的药效,故而还需要在小白菊内酯其结构修饰、生物活性及构效关系研究深入探索,并加以修饰、改造,合成理想的抗肿瘤新药。总之,对小白菊内酯抗肿瘤作用机制的研究对我国传统中药资源的研究与开发,以及对疾病的治疗均具有重要意义,值得深入探索。
