新藤黄酸纳米乳的制备、表征以及体外抗肿瘤药效学的研究
2021-05-06尹孝莉周思敏吴方雨魏晴王雷陈卫东安徽中医药大学药学院合肥23002中药复方安徽省重点实验室合肥23002安徽省中医药科学院药物制剂研究所合肥23002药物制剂技术与应用安徽省重点实验室合肥23002现代药物制剂安徽省工程技术研究中心合肥23002
尹孝莉,周思敏,吴方雨,魏晴,王雷,2,3,4,5,陈卫东,2,3,4,5*(.安徽中医药大学药学院,合肥 23002;2.中药复方安徽省重点实验室,合肥 23002;3.安徽省中医药科学院药物制剂研究所,合肥 23002;4.药物制剂技术与应用安徽省重点实验室,合肥 23002;5.现代药物制剂安徽省工程技术研究中心,合肥 23002)
癌症是当今世界的一个主要公共健康问题,许多化学药物均可引起不同的不良反应[1-2]。越来越多的证据表明,传统中药在各种癌症的治疗中已引起广泛关注[3-6]。新藤黄酸(gambogenic acid,GNA,C38H47O8,结构见图1)是从传统中药藤黄中分离得到的生物活性成分,具有多种抗肿瘤活性[7],例如肝癌(HepG2)[8]、肺腺癌[9]、人鼻咽癌[10]、多发性骨髓瘤[11]、脉络膜黑色素瘤[12]等,还可能是逆转P-糖蛋白介导的多药耐药性的潜在抑制剂[13],因此有望成为一种新型的抗肿瘤结构药物。但是GNA 水溶性差、血管刺激较大,限制了它的临床应用[14],亟需适当的制剂以改善GNA 的缺陷。

图1 GNA 的化学结构Fig 1 Chemical structure of GNA
目前,关于GNA 的研究主要集中于注射剂。如Huang 等[15]采用高温乳化-低温固化的方法成功研制了注射剂GNA 固体脂质纳米粒;Yuan 等[16]采用反溶剂沉淀法制备了以PVPK30 和PEG2000为稳定剂的注射型GNA 纳米悬浮液(GNA-NS);Luo 等[17]制备了注射剂GNA 脂质立方液晶纳米粒;Lin 等[14,18]制备了注射型长循环纳米脂质载体及PEG 化非离子表面活性剂等纳米载体来包裹GNA;Liu 等[19]制备了负载GNA 的注射型pH 响应聚合物胶束(PMS)。虽然静脉内给药具有许多优点,但是鉴于口服给药便利、可减少并发症,尤其是能有效地解决血管刺激性问题,而静脉注射的成本高,因此,本文旨在制备出一种优良的口服制剂来解决GNA 现存的不足。
纳米乳是由水、油、表面活性剂和助表面活性剂等自发形成,粒径为10 ~100 nm,热力学稳定、各向同性的透明或半透明的均相分散体系[20]。纳米乳一般被用作载体来增加难溶性药物的溶解度、提高药物的稳定性及生物利用度。在蒿甲醚纳米乳的制备中,纳米乳显著提高了蒿甲醚在水中的溶解度,且粒径小,稳定性好,体内口服生物利用度比普通药物高2.6 倍[21]。纳米乳还能减少药物的不良反应,起到缓释效应和增强药物的被动靶向性的作用。如将氨苯砜制成纳米乳后,不仅改善了溶解度,减少了药物的必要剂量和不良反应,还提高了药物生物利用度和稳定性[22]。随着纳米剂型的快速发展,国内外关于纳米乳的研究越来越多,通过纳米乳来改善药物缺陷的报道也越来越多,如吡罗昔康[23]、阿伐那非[24]、灯盏花素[25]等;另外,纳米乳还被用来增加疫苗的免疫作用[26]。众多研究表明,纳米乳在改善药物自身缺陷和提高药效方面具有广泛的应用前景,并可以通过各种途径如口服、透皮和静脉注射等递送药物,尤其是口服制剂,在其中占据了较大的比例[27-28]。因此,将GNA 制成纳米乳口服给药将是一个优良的选择。
本研究主要基于GNA 的局限性设计开发了新藤黄酸纳米乳(GNE):首先通过溶解度实验筛选出对GNA 溶解度最大的赋形剂,并利用伪三元相图和单因素的考察优化纳米乳的配方;然后通过外观、类型、粒径、多分散系数、透射电镜、稀释稳定性和放置稳定性等方法系统地表征GNE;最后通过体外药效学来证明纳米乳增加了GNA 的药效。
1 材料
1.1 仪器
岛津LC-20AXR 高效液相色谱仪(日本岛津公司);AB135-S 型十万分之一电子分析天平(德国Mettler Toledo 公司);DF-101B 集热式恒温磁力搅拌器(金坛市鑫鑫实验仪器厂);LC-4016 低速离心机(安徽中科中佳科学仪器有限公司);TG16-WS 高速离心机(长沙湘仪离心机仪器有限公司);Zetasizer3000HS 型激光粒度仪(英国Malvern 公司);Hitachi-HT7700 透射电镜(上海沪西分析仪器厂有限公司);KQ-300B 型超声波清洗器(昆山市超声仪器有限公司);DZF-6050 型真空干燥箱(上海傅讯实业有限公司);ESCO 二氧化碳培养箱(新加坡Esco 公司);YM50B 型高压蒸汽灭菌锅(上海三申医疗器械有限公司);酶标仪(赛默飞世尔科技公司);注射泵(上海蓝德医疗器械有限公司);Cascada 超纯水仪(美国PALL 公司)。
1.2 试药
新藤黄酸(GNA)对照品(纯度≥ 98%,安徽中医药大学药学院 GNA 课题组提供);亚麻籽油、橄榄油、油酸乙酯、中碳链三酰甘油(MCT)(上海源叶生物科技有限公司);肉豆蔻酸异丙酯(上海阿拉丁生化科技股份有限公司);蛋黄卵磷脂(上海艾韦特医药科技有限公司);聚氧乙烯氢化蓖麻油(RH40,江苏省海安石油化工厂);泊洛沙姆188(F68,德国BASF 公司);吐温80、甘油、聚乙二醇400(PEG400)(上海润捷化学试剂有限公司);1,2-丙二醇(上海苏懿化学试剂有限公司);异丙醇(天津市大茂化学试剂厂);苏丹红(天津市科密欧化学试剂有限公司);三水合亚甲蓝(西陇科学股份有限公司);RPMI 1640 培养基、胎牛血清(美国Hyclone 公司);胰酶细胞消化液(Biosharp 公司);四甲基偶氮唑蓝(MTT,美国Sigma 公司);青霉素-链霉素溶液(碧云天生物技术);甲醇为色谱纯,其余试剂均为分析纯。
1.3 细胞
乳腺癌4T1 细胞购自中国科学院上海细胞所(传代4 次)。
2 方法与结果
2.1 GNE 的制备
2.1.1 油相和助表面活性剂的确定 各取1 mL的油相和助表面活性剂于离心管中,加入过量的GNA,室温振荡48 h,15 000 r·min-1离心5 min后取上清液,甲醇稀释适宜的倍数后,用0.22 μm的微孔滤膜过滤,采用HPLC 在360 nm 测定GNA的含量。计算GNA 在不同油相、助表面活性剂中的溶解度,其结果见图2A。GNA 分别在油相MCT和助表面活性剂PEG400 中GNA 的溶解度最高,因此选择MCT 为油相,PEG400 为助表面活性剂。
2.1.2 表面活性剂的确定 各取50 mg 的表面活性剂于离心管中,加水稀释成10.83 mg·mL-1的胶束溶液,加入过量的GNA,室温振荡48 h,15 000 r·min-1离心5 min 后取上清液,甲醇稀释适宜的倍数后,用0.22 μm 的微孔滤膜过滤,采用HPLC 在360 nm 测定GNA 的含量。计算GNA在不同表面活性剂中的溶解度,其结果见图2B。结果显示,GNA 在表面活性剂RH40 中的溶解度最高,因此选用RH40 为纳米乳的表面活性剂。

图2 GNA 在不同油相(A)、助表面活性剂(A)和表面活性剂(B)中的溶解度Fig 2 Solubility of GNA in oil phases(A),co-surfactants(A)and surfactants(B)
2.1.3Km的确定 由图2可知,以溶解度最大的MCT、RH40 和PEG400 分别作为油相、表面活性剂和助表面活性剂。采用伪三元相图的方法,在室温条件下,将表面活性剂与助表面活性剂按不同质量比(1∶2、1∶1、2∶1、3∶1、4∶1)振荡摇匀后,再将混合表面活性剂与MCT 按不同质量比(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1)振荡混匀,滴入水相。以混合表面活性剂、油相和水分别为一条边,记录体系从浑浊到澄清时所用水相的体积,计算各组分的质量百分数,用Origin 软件绘制伪三元相图[29](Km为表面活性剂与助表面活性剂质量比,阴影面积为乳化区域),其结果如图3。

图3 MCT/RH40/PEG400/水纳米乳伪三元相图Fig 3 Pseudo ternary phase diagram of MCT,RH40,PEG400 and water with different Km
当Km=1/2、Km=1、Km=3 时无法形成伪三元相图,在Km值为2 时,纳米乳区域面积最大,因此选择Km值为2。同时为增加GNA 的载药量,减少表面活性剂的用量,选择阴影区域中油相和表面活性剂比为3∶7 的点作为后续纳米乳的处方(油相最多,载药最多,混合表面活性剂最小);即空白纳米乳的最优处方为:MCT/RH40/PEG400/水(0.3∶0.47∶0.23∶1.0)。为 便于后续单因素实验的考察,精密称取MCT 0.9 g、RH40 1.4 g、PEG400 0.7 g 和水3 g 进行实验。
2.1.4 转速的确定 固定其他因素不变,考察搅拌速度对评价指标的影响。结果见表1,可以看出,转速的大小对于纳米乳的外观无明显的影响,但粒径和多分散系数(PDI)均随着搅拌速度的增加,先减小后增大。其中,当转速在400 r·min-1时粒径和PDI 均最小,故选择搅拌速度为400 r·min-1。

表1 搅拌速度对空白纳米乳外观、粒径和PDI 的影响Tab 1 Influence of stirring velocity on appearance,size and PDI of blank nanoemulsion
2.1.5 滴加速度的确定 固定其他因素不变,通过注射泵控制滴加速度,考察滴加速度对评价指标的影响。结果见表2,可以看出,滴加速度对于纳米乳的外观无明显的影响,但粒径和PDI 均在滴加速度为0.3 mL·min-1和0.7 mL·min-1时较优。从节省时间成本上的考虑,选择滴加速度为0.7 mL·min-1。

表2 滴加速度对空白纳米乳外观、粒径和PDI 的影响Tab 2 Influence of drop acceleration on appearance,size and PDI of blank nanoemulsion
2.1.6 温度的确定 固定其他因素不变,考察温度对评价指标的影响。结果见表3,可以看出,温度对于纳米乳的外观无明显的影响,但对粒径和PDI 均有较大的影响,其中在50 ℃时粒径最小,在40 ℃时PDI 最小,两者相差不大,从节约能源的角度考虑,选择温度为40℃。

表3 温度对空白纳米乳外观、粒径和PDI 的影响Tab 3 Influence of temperature on appearance,size and PDI of blank nanoemulsion
2.1.7 GNE 的制备 精密称取MCT 0.9 g、RH40 1.4 g、PEG400 0.7 g 于锥形瓶中,在40℃下用磁力搅拌器以400 r·min-1的转速搅拌混匀,然后用注射泵以0.7 mL·min-1的滴加速度缓慢滴加3 g 水于混合体系中,搅拌至澄清透明即得空白纳米乳。最后多次少量地将36 mg GNA 粉末加入空白纳米乳中[30-31],直至搅拌完全溶解,即得6 mg·mL-1的淡黄色澄清透明纳米乳制剂。
2.2 GNA 分析方法的建立
2.2.1 GNA 对照品溶液的配制 精密称取GNA对照品4.99 mg 于10 mL 量瓶中,甲醇溶解定容,再精密吸取0.1 mL 并用甲醇稀释为4.99 μg·mL-1,涡旋混合即得GNA 对照品溶液,置于4℃冰箱中储存备用。
2.2.2 GNA 供试品溶液的配制 吸取一定体积的GNE 于10 mL 量瓶中,加入适量甲醇涡旋,超声使其完全破乳,再加入甲醇定容至刻度线即得GNE 破乳溶液,现配现用。
2.2.3 空白纳米乳的配制 吸取等量的空白纳米乳于10 mL 量瓶中,加入适量甲醇涡旋,超声使其完全破乳,再加入甲醇定容至刻度线即得空白纳米乳破乳溶液,现配现用。
2.2.4 色谱条件 采用COSMOSIL C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.1%磷酸水溶液(90∶10,V/V),流速为1.0 mL·min-1,检测波长为360 nm,柱温为30℃,进样量为10 μL。
2.2.5 方法学验证 对所建立的 HPLC 方法进行方法学考察,结果见图4。可以看出辅料对GNA 的含量测定无干扰,表明此方法的专属性好。其线性关系、日内精密度、日间精密度、回收率、重复性及稳定性均符合体外分析的要求(RSD值均小于5%)。

图4 GNA 的HPLC 色谱图Fig 4 HPLC chromatogram of GNA
2.3 包封率和载药量的测量
结合课题组的前期研究,选择微柱离心法作为测量GNA 的主要方法。精密吸取稀释后的GNE 100 μL 于葡聚糖凝胶柱顶端中央,3000 r·min-1离心3 min 后,在顶端加入100 μL 的超纯水,连续洗脱5 次,收集并合并滤液,加甲醇定容至2 mL,按“2.2.4”项下方法测定GNA 含量,计算GNA 的包封量(W包封)。另取GNE 100 μL,直接用甲醇定容至2 mL,按“2.2.4”项下方法测定GNA 含量,计算GNA 的量(W总)。包封率(EE%)和实际载药量(DL%)的计算公式如下:

其中,W包封是被包裹在纳米乳里的GNA 质量,W总是投的GNA 总量,W载体是除水后纳米乳空白载体的质量。根据计算公式,可得出GNE的包封率为93.50%,实际载药量为1.11%。
2.4 GNE 的质量评价
2.4.1 纳米乳外观考察 由图5可知,所制备的空白纳米乳是外观带有淡蓝色乳光的澄清透明的液体,没有沉淀或絮凝,而GNE 则呈现黄色。

图5 空白纳米乳(左)和GNE(右)的外观Fig 5 Outward appearances of the blank nanoemulsiom (left)and GNE(right)
2.4.2 鉴别实验 各取两份GNE 1 mL 于进样小瓶中,分别滴加苏丹红(红色油性染料)和亚甲基蓝(蓝色水性染料)1 滴,结果观察到蓝色的扩散速度快于红色,如图6,表明所制备的GNE 为水包油型。

图6 纳米乳的鉴别实验(左-苏丹红;右-亚甲基蓝)Fig 6 Identification experiment of GNE (left-Sudan red;rightmethylene blue)
2.4.3 形态学考察 将铜网置于干净的载玻片上,滴加10 μL 稀释适量倍数的GNE 静置挥干,然后用2%的磷钨酸染色2 min,用滤纸吸去多余的染液,置透射电镜下观察,如图7。结果显示GNE 外观呈类球型,大小均匀,表面光滑圆整,粒子间无粘连。

图7 GNE 透射电镜图Fig 7 Transmission electron microscope of GNE
2.4.4 粒径分布与Zeta 电位 取GNE 1 mL,用外相水稀释至50 mL,用激光粒度分析仪分别测定其粒径和Zeta 电位,结果显示GNE 的平均粒径为(45.28±0.32)nm,多分散指数(PDI)为(0.137±0.01);Zeta 电位为(-10.5±0.52)mV。由此可知,制备的GNE 粒径分布窄,大小均匀,符合纳米制剂的要求(见图8)。

图8 GNE 的粒径分布图(A)及Zeta 电位图(B)Fig 8 Particle size distribution(A)and Zeta potential(B)of the GNE
2.4.5 稀释稳定性 取等量的GNE 用水稀释至不同的倍数(20、100、400、800 倍),观察GNE的外观,测定其平均粒径、PDI。结果显示,纳米乳外观保持稳定,呈淡黄色,无絮凝、沉淀和分层等现象,粒径和PDI 均稍微增大,但都在允许范围内(粒径 <200 nm,PDI <0.3),具有较好的稀释稳定性,见图9。

图9 GNE 的稀释稳定性Fig 9 Dilution stability of GNE
2.4.6 放置稳定性 将GNE 分别放置于4℃及25℃条件下,分别于0、7、14、21 和28 d 时取出,观察GNE 的外观,测定其平均粒径、PDI、包封率,初步评价GNE 的放置稳定性。结果表明在4℃下,GNE 一直呈淡黄色透明液体,4 周内的平均粒径略有增加趋势,PDI 变化不明显,包封率稍有下降;但在25℃下纳米乳第3 周就变得稍微浑浊,平均粒径、PDI 和包封率均有较大的变化(见图10)。说明温度会对纳米乳的放置稳定性产生一定的影响,GNE 在4℃环境中放置4 周是相对稳定的。

图10 GNE 在4 和 25 ℃环境中的放置稳定性(A.粒径;B.多分散系数;C.包封率)Fig 10 Storage stability of GNE at 4 and 25℃ for 4 weeks(A.size;B.PDI;C.Encapsulation efficiency)
2.5 GNE 的体外抗肿瘤活性
2.5.1 细胞培养 将4T1 细胞培养于含有10%胎牛血清,1%青霉素-链霉素溶液的RPMI 1640培养基,并放在37℃,5%CO2的恒温、恒湿的无菌培养箱中,定期更换培养液,待细胞铺满培养瓶底部90%时进行下一步实验。
2.5.2 细胞活力实验 选择MTT 法研究细胞活力实验。将细胞以1×105个/孔的密度接种在96 孔板中,培养24 h 后,加入不同浓度的游离GNA,空白纳米乳和GNE 到细胞中温育24 h,并向每个孔中加入20 μL MTT 溶液(5.0 mg·mL-1),温育4 h,除去培养基,加入150 μL DMSO,摇晃10 min。用酶标仪在490 nm 处测定各孔光密度(OD)值,记录实验结果,计算细胞存活率,细胞存活率(%)=OD给药/OD空白×100%其中,OD给药、OD空白分别代表给药组和空白对照组的OD值,根据上式计算出各浓度所对应的细胞存活率的柱状图,并采用GraphPad prism 5 拟合计算半数抑制浓度(IC50),见图11。
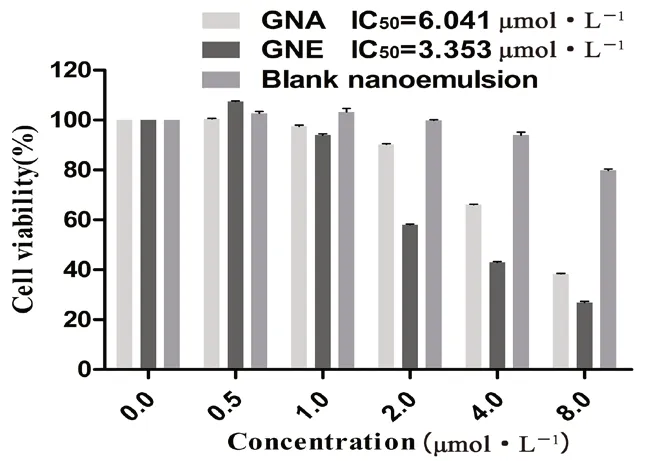
图11 GNA 和GNE 对4T1 细胞的存活率的影响( ±s,n =3)Fig 11 Effect of GNA and GNE on the cell viability of 4T1 cells( ±s,n =3)
MTT 结果显示,GNA 以及GNE 对4T1 细胞均有明显的抑制作用,且随着浓度的升高,抑制程度增强。空白纳米乳在8.0 μmol·L-1(即5048 μg·mL-1)时对细胞有微弱的毒性,但细胞存活率达到80%,根据部分文献报道,可认为该载体是安全无毒的[32-33]。且从图11 中可以看出,GNE较GNA 而言细胞存活率下降更加明显,IC50值更小,是游离GNA [IC50值(6.041 μmol·L-1)]的0.55 倍,这表明纳米乳包裹后的GNA 相对于游离药物,其抑制细胞增殖的能力提高了,对癌细胞的毒性增大了,因此其抗肿瘤活性得到增强。
3 讨论
GNA 和藤黄酸均是从藤黄科植物藤黄中分离提取出来的有效活性成分,但GNA 表现出更强的抗肿瘤作用。曲宝玺等[34]通过实验发现GNA 对小鼠白血病的抑制作用优于藤黄酸,最高生存期延长率可达292%,而藤黄酸最高只达到119%。并且GNA 对正常细胞(如人脐静脉内皮细胞HUVEC)不敏感,不影响脾、肾等主要器官的生理功能[35],是一种极具开发前景的天然抗肿瘤药物。尤其是在藤黄酸Ⅲ期临床失败以后,GNA 的研究变得更为重要。本文旨在通过制备纳米乳来改善GNA 的脂溶性强、水溶性差的问题,并以期通过改变给药方式从而避免其血管刺激性。
在纳米乳的制备上,首先挑选符合2020年版《中国药典》规定的几种不同辅料,再根据溶解度实验,筛选对GNA 溶解度最大的油相、表面活性剂和助表面活性剂,决定出纳米乳的组分因素。虽然该成分组成的伪三元相图纳米乳区域小,但稳定性良好,且文献鲜少报道,具有一定的研究价值。在投药量的选择上,本研究将过量的GNA 多次少量地加入到事先制备好的空白纳米乳中。冷藏24 h 后,出现沉淀;表明添加的60.23 mg GNA 不能被纳米乳剂完全溶解。所以通过低速离心(3000 r·min-1)将沉淀物与载有GNA 的纳米乳剂分离[36]。然后取上清液溶于甲醇测定GNA 含量,得纳米乳的最大载药量为56.16 mg;考虑到GNE 的长期稳定性,根据预实验选择了36 mg 为纳米乳的投药量用于后续实验。该制剂存在的不足地方是Zeta 电位的绝对值不够大,但Zeta 电位并非是考察稳定性因素的唯一评价指标。文献表明,即使Zeta 电位绝对值小于20 mV,结果依然表现出良好的稳定性[37-38]。此外,在MTT 实验中,空白纳米乳对肿瘤细胞有微弱的毒性,可能是由于空白纳米乳辅料量较大的原因。空白纳米乳同GNE 制备方法一致,辅料量一样,若降低了GNE 的辅料量,则可降低空白纳米乳的辅料量。因此根据载药量的计算公式,在控制药量相等的情况下,提高载药量是减少辅料量的有效途径,但载药量低是传统纳米载药系统的通病,比如GNA PEG 化脂质体、纳米脂质体和叶酸靶向磁性纳米粒的载药量分别仅为3.72%、4.23%和4.35%[7,39-40],肉豆蔻香精油纳米乳的载药量为1.11%~4.12%[41]。因此,越来越多的人通过将药物与辅料化学键合来提高载药量,在摄取相同剂量药物时,载药量大的制剂摄取的辅料量少,从而达到减少辅料毒性的目的[42-43]。
本文通过制备经口给药纳米乳改善了GNA 的不足,并通过外观、类型、粒径、PDI、透射电镜、稀释稳定性和放置稳定性等方法对其进行了系统的表征;体外细胞药效学也初步证明了纳米乳可以增强GNA 对肿瘤的抑制作用。虽然涉及的内容范围较少,但后期课题组会通过细胞毒性试验、体外释放试验、流式细胞术、安全性试验等进行进一步的考察,以期为其用于临床研究提供理论基础。
