不同地区黄秋葵根结线虫的SCAR鉴定及其防治
2021-04-29练冬梅赖正锋姚运法
练冬梅 赖正锋 姚运法


摘要:根结线虫病是黄秋葵生产中的重要地下病害,危害黄秋葵植株的生长,降低其产量。采用序列特异性扩增区聚合酶链反应(SCAR-PCR)技術鉴定不同地区黄秋葵上根结线虫的种类,并通过4种不同措施防治黄秋葵根结线虫。结果表明,在福建省漳州市龙文区、福建省三明市永安市和福建省莆田市秀屿区,黄秋葵根结线虫的种类为南方根结线虫,10.2%阿维噻唑膦颗粒剂的防治效果最好,为今后黄秋葵根结线虫病的防治研究提供了理论参考。
关键词:黄秋葵;根结线虫;SCAR;防治
黄秋葵(Abelmoschus esculentus L.)属锦葵科(Malvaceae)秋葵属(Abelmoschus)[1],别称秋葵(okra)、补肾草、咖啡葵等,为一年或多年生草本植物,原产于非洲,20世纪20年代初从印度引入我国,现在国内各地均有栽培。黄秋葵作为一种特色的保健型蔬菜,在广东、福建、山东等地区均有大规模种植[2],在福建省不同地区,每年的黄秋葵种植面积累计达到2 000 hm2,在福建建宁、泰宁和将乐等地区,黄秋葵品种洋辣、痴椒的种植历史已有百年之久[3]。由于黄秋葵生产的规模化、设施化和连作化且绝大部分黄秋葵易受根结线虫侵染[4],根结线虫病已经成为世界上黄秋葵分布最广、危害最大的植物寄生线虫之一,严重影响了黄秋葵的生长和产量[5]。因此,黄秋葵根结线虫病防控技术的研究受到越来越多的关注,研究内容包括黄秋葵嫁接玫瑰茄砧木[6]、筛选抗病品种[4-5,7-8]等手段。本研究采用序列特异性扩增区聚合酶链反应(SCAR-PCR)快速检测技术鉴定黄秋葵根结线虫种类,并研究不同技术措施对黄秋葵根结线虫的防治效果,以期为今后黄秋葵根结线虫病的防治研究提供理论参考。1 材料与方法
1.1 SCAR-PCR鉴定
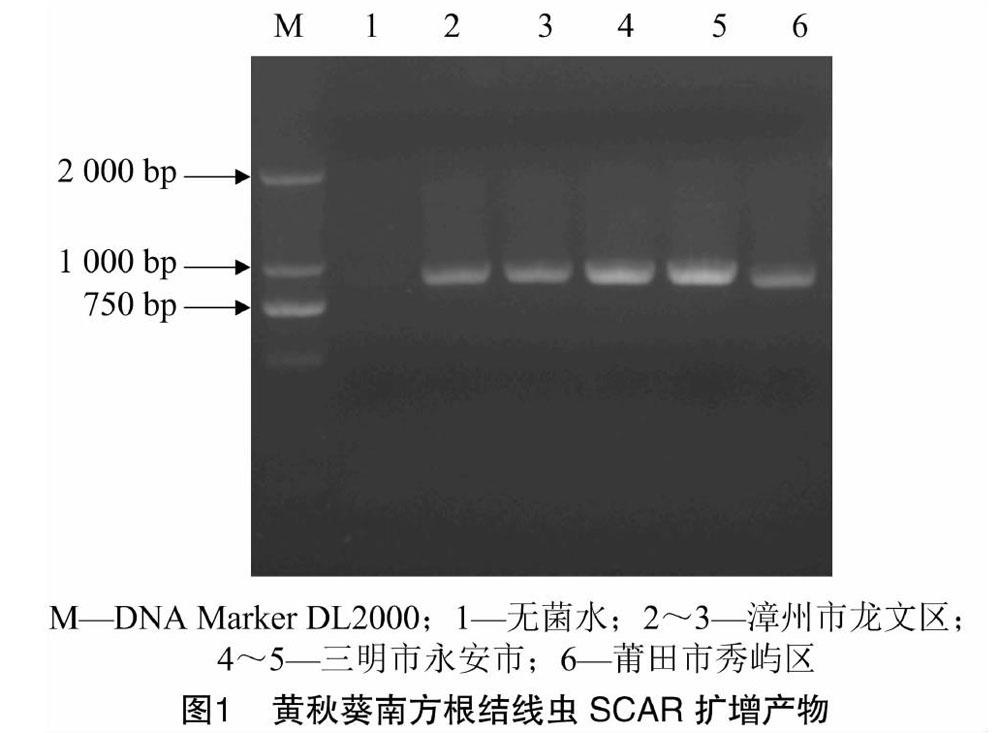
1.1.1 样品采集 于2019年7月分别采集福建省漳州市龙文区、三明市永安市、莆田市秀屿区黄秋葵生长后期的根样。采样方法以5点式为主,剪去植株地上部后将5~10株黄秋葵的根系放在1个塑料袋中作为根样。
1.1.2 线虫的分离 在解剖镜下直接用挑针挑出发病根样中的雌虫,用液氮处理后于-70 ℃冰箱中保存。
1.1.3 单条线虫DNA的提取 线虫DNA提取参考王江岭等的方法[9]。将单条根结线虫雌虫放入含有8 μL ddH2O、1 μL 10×Ex Taq buffer(Mg2+ free)的200 μL PCR管中,在液氮中冷冻1 min后,于95 ℃处理2 min,重复3次,向PCR管中加入1 μL 1 mg/mL蛋白酶K,于65 ℃温育1 h后,于 95 ℃ 静置10 min。用掌上离心机瞬时离心,上清液即可用于PCR扩增或置于-20 ℃冰箱中备用。
1.1.4 PCR引物 本研究采用的SCAR标记引物见表1。
1.1.5 PCR扩增与电泳 PCR扩增反应采用 25 μL 体系,包括5 μLDNA模板,1 μL F引物,1 μL R引物,12.5 μL 2×Taq MasterMix(含染料),4.5 μL ddH2O。PCR扩增程序:94 ℃预变性4 min;94 ℃ 变性30 s,退火30 s(温度参照表1),72 ℃延伸1 min,40个循环;72 ℃延伸10 min,4 ℃保存。取5 μL PCR扩增产物在浓度为1.2%的琼脂糖凝胶上检测扩增片段的大小,以DNA marker DL 2000作为分子量对照。电泳完毕后在溴化乙锭(EB)染液中染色10 min,用凝胶成像仪观察并拍照。
1.2 防治技术研究
1.2.1 材料与药剂 供试黄秋葵品种闽秋葵3号由福建省农业科学院亚热带农业研究所选育[14]。淡紫拟青霉颗粒剂(含5亿活孢子/g,处理1)、10%阿维菌素颗粒剂(处理2)、10.2%阿维噻唑膦颗粒剂(处理3)、生菜(处理4)种子均为市售。
1.2.2 试验方法 2019年8月,选择根结线虫发生较重的福建省漳州市龙文区朝阳镇登科村福建省农业科学院亚热带农业研究所蔬菜种植基地进行试验,设3次重复,每个重复设1个小区,每个小区面积为24 m2。处理1~3的施药方法严格按照说明进行,处理4为黄秋葵幼苗定植前20 d,在栽培垄两侧条播诱集根结线虫的生菜种子,黄秋葵定植 35 d 后,将生菜连根拔除。黄秋葵移栽60 d后,采用5点随机取样法,每个点取3株,每个小区共取样15株,取样后记录发病级数。CK为清水处理。
1.2.3 根结线虫病分级标准 0级,无根结;1级,仅有少量根结,1% ≤根结百分率<10%;2级,根结明显,10% ≤根结百分率<25%;3级,25%≤根结百分率<50%;4级,50%≤根结百分率<75%;5级,根结百分率≥ 75%。
根结线虫病病情指数=[(病级数×该级病株数)/(调查总株数×最高病级数)]×100;
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.2.4 根结线虫虫口密度调查 采用5点取样法,每点取0~40 cm土层的病土,将5点取到的土样混匀后从中称取100 g,用贝尔曼漏斗法分离土壤中的二龄幼虫,将二龄幼虫悬浮液充分混匀后,取2 mL液体定容,从中吸取100 μL于皿底打格的培养皿中,在解剖镜下对二龄幼虫进行计数,重复3次,取平均值。每个处理小区的二龄幼虫总量统一换算成1 kg土样中的幼虫总量。
1.2.5 数据分析 用DPS进行数据分析。
2 结果与分析
2.1 SCAR分子鉴定结果
利用5种常见根结线虫的特异性引物(表1)对福建省漳州市龙文区、福建省三明市永安市、福建省莆田市秀屿区所采集样本中分离得到的根结线虫进行扩增与电泳观察,得到的片段均为1 000 bp左右(图1),与前人所得扩增产物大小一致[10],确定根结线虫的种类为南方根结线虫(Meloidogyne incognita),但未检出其他根结线虫种类。
2.2 防治效果分析
2.2.1 病情指数和防治效果统计 试验结果表明,4种不同措施对黄秋葵根结线虫病均有一定的防治效果(表2),其中淡紫擬青霉(含5亿活孢子/g)颗粒剂、1.0%阿维菌素颗粒剂、10.2%阿维噻唑膦颗粒剂、种植诱集根结线虫的生菜的防治效果分别为36.4%、33.1%、67.5%、39.5%,其中10.2%阿维噻唑膦颗粒剂的防治效果最好。
2.2.2 根结线虫虫口密度统计 由表3可以看出,4种不同措施对黄秋葵根结线虫虫口密度均有一定的降低作用,淡紫拟青霉(含5亿活孢子/g)颗粒剂、1.0%阿维菌素颗粒剂、10.2%阿维噻唑膦颗粒剂、种植诱集根结线虫的生菜的二龄幼虫虫口下降效果分别为37.4%、36.0%、60.7%、40.6%,其中10.2%阿维噻唑膦颗粒剂对根结线虫虫口密度的下降效果最佳。
3 讨论
我国已报道的根结线虫种类为57种,其中能引起蔬菜发生根结线虫病的主要为南方根结线虫(M. incognita)[15]、象耳豆根结线虫(M. enterolobii)[16]、爪哇根结线虫(M. javanica)[17]、北方根结线虫(M. hapla)[18]、花生根结线虫(M. arenaria)[19]。常规的根结线虫种类鉴定方法主要有形态学鉴定法、寄主及生化鉴定法。近十几年来,分子生物学技术的发展,为根结线虫的准确鉴定提供了重要手段。其中,序列特异性扩增区(sequence characterized amplified region,简称SCAR)是一种新型分子标记,结果稳定性好、可重复性强,已被广泛应用于植物根结线虫的种类鉴定中[20-22]。本研究通过SCAR-PCR方法,从分子水平对不同地区根结线虫的种类进行了准确检测和鉴定。世界范围内发现的危害黄秋葵的根结线虫主要是南方根结线虫(M. incognita)和象耳豆根结线虫(M. enterolobii)[6,23-25]。我国黄秋葵以南方根结线虫为主要种群,黄英凯鉴定得出,福建漳平地区黄秋葵的根结线虫病原为南方根结线虫[24];姚玉荣等鉴定得出,天津地区黄秋葵的根结线虫病原为南方根结线虫[25]。本研究结果显示,危害福建省漳州市龙文区、福建省三明市永安市、福建省莆田市秀屿区黄秋葵的根结线虫种类与我国黄秋葵上主要根结线虫种类相符,研究暂未发现其他根结线虫。
目前,防治根结线虫的方法有轮作、药剂防治、生物防治、抗病品种等。本试验发现,采用田间不同措施对黄秋葵根结线虫病均有一定防治效果,能够减轻根结线虫的危害,降低病情指数和虫口密度,其中10.2%阿维噻唑膦颗粒剂的防效最好,具有速效性好、残留毒性低、对环境友好等优点,可作为当前黄秋葵根结线虫防治的最佳药剂选择,但防治成本偏高,而1.0%阿维菌素颗粒剂、淡紫拟青霉(含5亿活孢子/g)颗粒剂和种植诱集根结线虫生菜的防效一般,但防治成本低,其中诱集根结线虫的生菜连根拔除后可出售,从而增加生产效益。淡紫拟青霉颗粒剂在可持续农业发展中的作用仍然十分重要,其高效防治技术还需不断提升。
参考文献:
[1]Nipaporn S,Leonard M C S,Renko D V,et al. Physicochemical properties of pectins from okra[J]. Food Hydrocolloids,2009,24(1):35-41.
[2]吴剑夫,程安玮,孙金月,等. 超声波辅助提取秋葵果胶工艺优化及理化性质分析[J]. 核农学报,2018,32(10):2002-2011.
[3]刘东祥,叶花兰,刘国道. 黄秋葵的应用价值及栽培技术研究进展[J]. 安徽农业科学,2006,34(15):3718-3720,3725.
[4]练冬梅,赖正锋,姚运法,等. 黄秋葵抗根结线虫病种质资源筛选[J]. 中国植保导刊,2019,39(7):45-49.
[5]Mukhta T,Hussain M A,Kayani M Z. Yield responses of 12 okra cultivars to southern root-knot nematode(Meloidogyne incognita)[J]. Bragantia,2017,76(1):108-112.
[6]Marin M V,Santos L S,Gaion L A,et al. Selection of resistant rootstocks to Meloidogyne enterolobii and M. incognita for okra(Abelmoschus esculentus L. Moench)[J]. Chilean Journal of Agricultural Research,2017,77(1):58-64.
[7]Hussain M,Kamran M,Singh K,et al. Response of selected okra cultivars to Meloidogyne incognita[J]. Crop Protection,2016,82:1-6.
[8]Tariq M,Muhammad A H,Muhammad Z K,et al. Evaluation of resistance to root-knot nematode (Meloidogyne incognita) in okra cultivars[J]. Crop Protection,2014,56:25-30.
[9]王江岭,张建成,顾建锋. 单条线虫DNA提取方法[J]. 植物检疫,2011,25(2):32-35.
[10]Meng Q P,Long H,Xu J H. PCR assays for rapid and sensitive identification of three major root-knot nematodes,Meloidogyne incognita,M. javanica and M. arenaria[J]. Acta Phytopathol Sin,2004,34:204-210.
[11]Zijlstra C,Donkers-Venne D T H M,Fargette M. Identification of Meloidogyne incognita,M. javanica,and M. arenaria using sequence characterized amplified region(SCAR) based PCR assays[J]. Nematology,2000,2(8):847-853.
[12]Long H,Liu H,Xu J H. Development of a PCR diagnostic for the root-knot nematode Meloidogyne enterolobii[J]. Acta Phytopathol Sin,2006,36:109-115.
[13]Zijlstra C. Identification of Meloidogyne chitwoodi,M. fallax and M. hapla based on SCAR-PCR:a powerful way of enabling reliable identification of populations or individuals that share common traits[J]. European Journal of Plant Pathology,2000,106:283-290.
[14]赖正锋,练冬梅,姚运法,等. 黄秋葵新品种“闽秋葵3号”[J]. 园艺学报,2019,46(6):1217-1218.
[15]Abad P,Gouzy J,Aury J M,et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita[J]. Nature Biotechnology,2008,26(8):909-915.
[16]Yang B J,Eisenback J D. Meloidogyne enterolobii n.sp.(Meloidogy nidae),a root-knot nematode parasitizing pacara earpod tree in China[J]. Journal of Nematology,1983,15(3):381-391.
[17]何 元,潘滄桑. 南方根结线虫和爪哇根结线虫的发育[J]. 厦门大学学报(自然科学版),2000,39(4):537-546.
[18]Opperman C H,Bird D M,Williamson V M,et al. Sequence and genetic map of Meloidogyne hapla:a compact nematode genome for plant parasitism[J]. Proc Natl Acad Sci USA,2008,105(39):14802-14807.
[19]宾淑英,姚圣梅,林进添,等. 花生根结线虫对花生植株主要生理指标的影响[J]. 华中农业大学学报,1999,18(2):121-124.
[20]杨艳梅,梁 艳,袁绍杰,等. 云南省部分烟区根结线虫形态和分子鉴定[J]. 南方农业学报,2017,48(2):284-291.
[21]亓竹冉,刘天鸿,王 宁,等. 出口蔬菜花卉种苗基地的植物线虫种类调查和鉴定[J]. 南京农业大学学报,2014,37(5):93-100.
[22]宋 莉,周培培,李 阳,等. 云南玉溪地区烟田根结线虫的SCAR鉴定、分布及其生物防治研究[J]. 农业资源与环境学报,2019,36(4):546-552.
[23]练冬梅,赖正锋,姚运法,等. 黄秋葵根结线虫病的病原鉴定[J]. 福建农业科技,2019(3):40-42.
[24]黄英凯. 福建省蔬菜基地根结线虫病病原鉴定及发病规律研究[D]. 福州:福建农林大学,2014.
[25]姚玉荣,霍建飞,郝永娟,等. 天津地区温室蔬菜根结线虫种类的多重PCR快速鉴定[J]. 北方园艺,2018(7):49-52.尹向田,杨立英,王超萍,等. 不同种类杀菌剂对6种葡萄致腐病菌的室内毒力测定[J]. 江苏农业科学,2021,49(3):99-104.
