水稻草铵膦耐性突变体的筛选及其耐性机制
2021-04-29叶亚峰陶亮之姜鸿瑞刘斌美吴跃进
任 艳,叶亚峰,陶亮之,谢 建,何 丹,姜鸿瑞,杨 阳,刘斌美,吴跃进
(1.中国科学院合肥物质科学研究院技术生物与农业工程研究所,合肥230031;2.中国科学技术大学,合肥230026;3.安徽农业大学农学院,合肥230036)
稻田杂草与水稻争夺生长空间、肥料和水分,同时又是传播病虫害的媒介,严重威胁水稻的产量和质量[1]。因此,防除农田杂草是保证水稻产量和质量的一项重要内容。传统人工除草方式效率低、成本高、费时费力;化学除草方式成本低、效率高,其中灭生性除草剂药效快、广谱高效。然而,由于灭生性除草剂的作用对象无选择性特点,其会损伤作物,不能直接施用于大田农作物[2]。同时长期施用同一类型除草剂易使田间杂草产生耐药性[3],增加除草难度,而交替施用不同类型除草剂虽可大大降低杂草产生耐药性的概率,但对水稻的损伤仍不可避免[4]。因此,筛选和培育抗多种广谱除草剂的水稻突变体是现代化农业发展的新趋势之一。目前市场上的灭生性除草剂有百草枯、草甘膦、草铵膦等,百草枯因对人体有剧毒,且无特效解毒药而被禁用;草甘膦使用不当易造成环境污染,降低了其利用价值;草铵膦因除草快速高效、在土壤中易分解、对人畜无毒等优势而获得广泛的使用[5]。草铵膦为接触性、广谱性和非选择性除草剂,其基本原理是通过抑制植物体内谷氨酰胺合成酶(Glutamine synthe⁃tase,GS)活性,降低氨代谢过程。有研究指出植物体内氨过量积累会降低光合活性,破坏叶绿体结构[6⁃8],几小时内可导致植物组织死亡。
抗草甘膦水稻种质目前可通过基因编辑[9]、EMS诱变[10]等途径获得;抗咪唑啉酮类水稻种质可通过EMS 伽马射线[5]和基因编辑技术[11]获得。而目前抗草铵膦水稻种质只能通过转基因技术而获得,抗草铵膦的基因是来自吸水链霉菌的Streptomyces hygroscopi⁃cus 的Bar 基因[12]和来自Streptomyces viridoehromogenes的Pat 基因[13]。然而,转基因技术复杂、存在未知风险,消费者对转基因作物较为排斥,推广难度较大[14]。近几年在常施用草铵膦的地区陆续发现具有草铵膦耐性的黑麦草[15⁃16],证明在禾本科植物中存在耐草铵膦的机制,然而迄今为止还未有通过非转基因技术获得抗草铵膦水稻的报道。本文选用具有咪唑乙烟酸抗性的水稻品种为野生型材料,对其进行重离子处理,筛选出对草铵膦具有耐性的水稻突变体,并对其作用机制进行初步探索,以期为遗传育种发掘新的抗除草剂的水稻新基因。
1 材料与方法
1.1 材料
供试水稻材料为粳稻品种“金粳818”,从种子市场上购买。除草剂草铵膦原药纯度为99.6%(购自湖北康宝泰精细化工有限公司);商用咪唑乙烟酸(水剂,有效成分5%)。
1.2 方法
1.2.1 水稻草铵膦耐性突变体的筛选与表征
“金粳818”种子经过重离子处理(12C6+,能量80 Mev,剂量120 Gy)。筛选实验于2018 年11 月在海南试验基地进行,播种量为15 kg/亩,水稻幼苗生长到三叶期时用300 mg/L(实验室前期验证的最佳筛选浓度)的草铵膦溶液均匀喷施幼苗。一周后对存活的幼苗进行复喷验证。复喷10 d后,筛选存活植株并移栽,常规田间管理至收获M3种子。M3种子播种后至三叶期时喷施草铵膦,10 d 后,每个系随机取20 株测定水稻株高、鲜重和烘干重量。
1.2.2 突变体水稻耐性生理指标的测定
草铵膦耐性突变体耐性水稻植株经过复筛后,进行草铵膦耐性验证和耐性机制研究。待水稻植株长至7~8 叶期时,用棉签蘸取质量浓度为200 mg/L 的草铵膦溶液均匀涂抹在水稻叶面上(含对照)。检测草铵膦处理后0、6、24、48、72 和96 h 叶片叶绿素含量相对值,及处理0、6、48 和96 h 叶片氨含量和谷氨酰胺合成酶(GS)活性。水稻叶片叶绿素含量相对值使用SPAD 计测量(Soil and Plant Analyzer Development,日本柯尼卡美能达)。氨含量检测方法采用茚满三酮比色法[17];谷氨酰胺合成酶(GS)活性采用海联生物科技公司的检测试剂盒测定。
1.2.3 突变体对咪唑乙烟酸耐性的验证
验证草铵膦耐性突变体是否仍具有野生型的咪唑乙烟酸耐性。播种草铵膦耐性突变体M3 代种子于田间,长至三叶期时,用咪唑乙烟酸溶液(500 mg/L)喷施幼苗,一周后观察植株存活情况。
1.3 数据统计
试验数据采用SAS 9.1 统计分析软件的Proc ANOVA 过程进行方差分析和多重比较(α=0.05)。数据图采用Excel 2019数据绘图软件绘制。
2 结果与讨论
2.1 水稻草铵膦耐性突变体的筛选与验证
喷药一周后对水稻的存活情况进行观察,根据叶色(绿色或枯黄)来鉴定对草铵膦具有耐性的植株,特别是选择被枯黄水稻植株包围的绿色水稻植株,以确保特定地区的水稻植株喷施了足够量的草铵膦除草剂,从而尽量减少遗漏的概率[18]。大田筛选结果如图1 所示,枯黄的水稻植株对草铵膦不具有耐性,有5 株保持绿色的水稻植株,初步确定为耐草铵膦水稻突变体并编号为R1~R5。为了排除由于漏喷而造成的错误选择,一周后对这些绿色植株进行复喷,结果表明这5株水稻植株仍表现出明显的草铵膦耐性。
在三叶期对草铵膦耐性突变体M3 代植株喷施草铵膦溶液,10 d 后,对照组水稻幼苗已枯黄萎蔫,而5个突变系水稻叶尖虽略微枯黄,但整株水稻仍保持绿色(图2)。生物量结果表明:因对照组水稻施药后迅速枯萎死亡,失去水分,鲜重与干重相差较小,而突变系水稻生长良好,含水量大,所以鲜重与干重相差较大。喷施草铵膦后,突变系水稻的鲜重、干重和株高均显著高于对照组水稻(P<0.05)(表1)。其中:突变系水稻R3 鲜重最高可达1.520 g,比对照组(0.719 g)增加111.5%;突变系水稻干重比对照组(0.2 g)增加36.6% ~53.4%;突变系水稻株高比对照组(17.5 cm)增加21.71%~48.00%。

图1 草铵膦耐性水稻的大田筛选Figure 1 Field screening of glufosinate⁃tolerant(GT)rice plants

图2 突变体M3代对草铵膦耐性的复筛Figure 2 The screening of glifosinate tolerance in mutant M3 generation
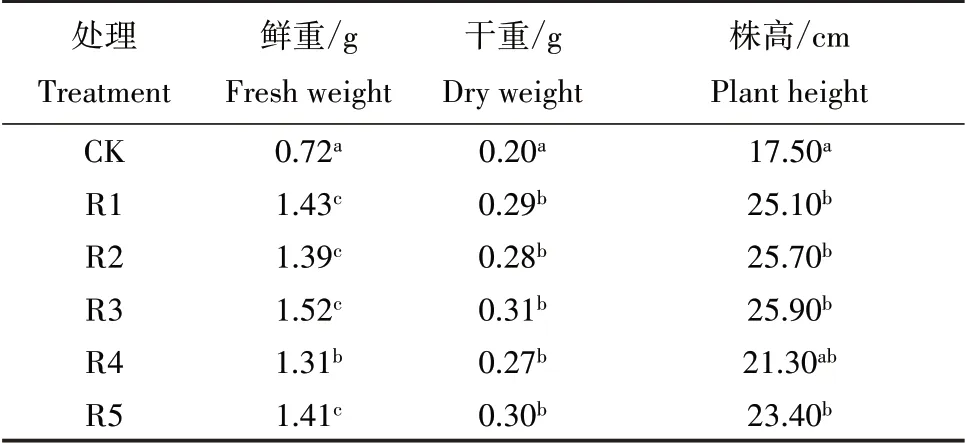
表1 草铵膦对水稻生物量和株高的影响Table 1 Effects of glufosinate on rice biomass and plant height
2.2 突变体水稻耐性生理指标的测定
2.2.1 草铵膦对水稻叶片SPAD值的影响
水稻叶片叶绿素的含量可以直接反映水稻的生理状况及受害程度[19]。由表2 可见,不同水稻单株和处理时间对叶片SPAD 影响显著(P<0.05):涂药后5 个草铵膦耐性水稻突变系和对照组水稻的叶片SPAD 值均随着时间推移而下降;在涂药72 h以后,各个突变系水稻的SPAD值均显著高于对照组(P<0.05)。突变系R4、R5 和对照组水稻在涂药48 h 时SPAD 值显著下降(P<0.05),而突变系R1、R2 和R3 则在24 h 均显著下降,这可能与离子束诱变的位置和个体间的差异有关。在涂药48 h 和72 h 之间,对照组叶片SPAD 值出现“陡降”现象(降低144.42%);在涂药96 h 时,对照组叶片SPAD值已降至8.43,出现不可逆的枯死(图3和表2)。突变系水稻的叶片SPAD 值在21.80 ~31.40,与对照组相比下降幅度较小。该结果说明:在施药后的24~48 h,草铵膦使对照组水稻内部系统出现“崩塌”式毁坏,可能是草铵膦诱发植物产生大量的活性氧以及其后的氨积累[20]使得叶绿体快速解体、细胞崩溃死亡;而突变系水稻则没有对照组的这种“崩塌”式毁坏过程。

图3 草铵膦对水稻叶片的影响Figure 3 Effect of glufosinate treatment on rice leaves
草铵膦耐性突变系水稻虽然仍受到草铵膦的药害,但是其受害程度要远远小于其野生型对照。野生型对照为整片叶的褪绿枯黄,而突变系水稻叶片仅叶尖失绿(图3)。由于草铵膦在组织中移动非常有限,只有极少量的草铵膦会运输到邻近的健康组织中[21],因此草铵膦耐性突变系水稻在受到草铵膦药害后,经过一定时间的恢复可以存活,而野生型对照则没有恢复能力。这一过程的差异可能是突变系水稻产生草铵膦耐性的机制之一。

表2 草铵膦对水稻叶片SPAD值的影响Table 2 Effect of glufosinate on SPAD value in rice leaves
2.2.2 草铵膦对水稻叶片氨含量的影响
草铵膦除草的主要原理是抑制GS活性,降低氨同化效率,导致氨大量积累,引起植物氨中毒死亡[7]。因此,叶片氨含量可作为衡量植物对草铵膦抗性大小的参考指标[22]。如图4 所示,对照组水稻在施药后,叶片氨含量保持在较稳定的水平,1.30 mg/g左右。突变系水稻R1~R5 在施药后,叶片氨含量呈现“先上升后下降”的趋势。其中在施药后6 h 时,各突变系水稻叶片氨含量之间无显著差异(P>0.05)。但施药后48 h时,突变系水稻R1、R2 和R5 叶片氨含量显著上升(P<0.05),分别增加53.29%、59.12%和63.49%,而突变系水稻R3 和R4 则无显著变化(P>0.05)。在施药后96 h时,突变系水稻R1~R5叶片氨含量均显著下降,且5 个突变系之间无显著差异(P>0.05),氨含量为0.67~0.80 mg/g。
施药后6 h,突变系水稻叶片氨含量与对照组也无显著差异(P>0.05);施药后48 h,突变系水稻R1、R2和R5 叶片氨含量(分别为1.96、2.32 和2.04 mg/g)均显著高于对照组(P<0.05),而R3 和R4 叶片氨含量与对照组无显著差异(P>0.05);施药96 h,R1~R5 叶片氨含量均显著低于对照组(P<0.05),且R1~R5之间叶片氨含量无显著差异(P>0.05)。其中R1、R2和R5突变系水稻叶片在涂药后48 ~96 h,出现了“快积快消”的特殊氨积累过程,而R3 和R4 突变系水稻叶片氨含量在涂药后则无显著上升的过程。最终各突变系水稻叶片氨含量均显著下降(P<0.05),可能是由于在叶片中的氨还没有实现植物毒性时就被及时清除或者代谢,大大降低了氨对水稻的损伤,这一特性是突变系水稻产生草铵膦耐性的另一可能机制。未来还需进一步研究突变系水稻中的两种不同氨积累过程,以揭示突变系水稻对草铵膦产生耐性的机制。
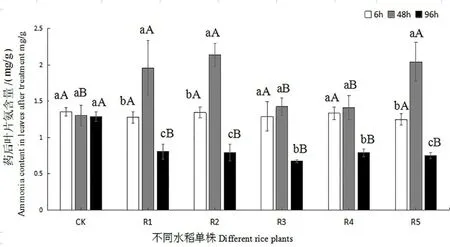
图4 草铵膦对水稻叶片氨含量的影响Figure 4 Effect of glufosinate treatment on ammonia content of rice leaves
2.2.3 草铵膦对水稻叶片GS活性的影响
谷氨酰胺合成酶(GS)在植物氨同化及氨代谢调节中起解毒作用,这是一个依赖于三磷酸腺苷(ATP)的酶系,可将氨同化成谷氨酰胺基,解除由硝酸还原作用、氨基酸降解及光呼吸中释放的氨的毒性,对植物中氮的同化起着核心作用[23]。草铵膦对GS 的不可逆抑制会导致有毒氨迅速积累,抑制光合作用,导致叶片组织坏死和植物死亡[24]。如表3 所示,施药后对照组与突变系水稻R1~R5的叶片GS活性均逐渐下降,说明施用草铵膦抑制叶片GS活性。在施药后各个时间,对照组与突变系水稻组内叶片GS活性无显著差异,变化趋势较一致。该结果说明,突变系水稻对草铵膦的抗性不是基因突变引起的GS 敏感性改变所致。研究结果与Wilson 等[25]的研究结果类似,其抗性可能与该突变株对草铵膦的吸收、转运、代谢有关,或者是减少到达目标GS 位置(如液泡固存)的除草剂的量[26],这种抗性机制在抗草甘膦机制中已经被证明[27],或者是由细胞对除草剂摄取的差异而产生的抗性[28]。

表3 草铵膦对水稻叶片GS活性的抑制率Table 3 Inhibition rate of glufosinate on GS activity in rice leaves
GS抑制率(%)=草铵膦处理叶片的GS活性/未处理叶片的GS活性×100%
2.3 咪唑乙烟酸抗性的验证
图5中,a为野生型水稻“金粳818”;b~f为筛选出的草铵膦耐性突变系水稻R1~R5,g 为无咪唑乙烟酸抗性的水稻“武运粳7号”。

图5 水稻咪唑乙烟酸抗性的验证Figure 5 Verification of resistance to imazamox in rice
“金粳818”携带抗咪唑乙烟酸的基因。前述结果已证明诱变筛选出的草铵膦耐性突变体对草铵膦具有较好的耐性,进一步分析草铵膦耐性突变体是否还具有咪唑乙烟酸抗性。结果表明(图5),对照组为对咪唑乙烟酸无耐性的粳稻品种“武运粳7 号”,喷施过咪唑乙烟酸后,对照组出现枯黄萎蔫症状,而草铵膦耐性突变体则未受到药害仍保持绿色无枯黄症状,说明其对咪唑乙烟酸的抗性并未丢失,仍具有抗除草剂咪唑乙烟酸的特性。因此,诱导筛选出草铵膦耐性突变体水稻适用草铵膦和咪唑乙烟酸联合除草,可提高田间除草效率,且不易使杂草产生耐药性。未来还需要进一步研究突变体中的抗咪唑乙烟酸基因和耐草铵膦的基因之间是否存在相互作用,以及两个抗除草剂基因叠加后是否会对水稻的产量和质量造成影响。
3 结论
研究利用重离子处理种子法结合大田试验,筛选出了5 株具有草铵膦耐性的水稻突变体并进一步培育出相应的突变系。用草铵膦溶液处理后代幼苗,对照组植株完全枯死,而草铵膦耐性突变系则表现为叶缘略微枯黄,所受药害程度显著轻于对照组,且一段时间后可复青。突变系水稻的叶片氨含量在施用草铵膦后呈现“快积快消”模式,这可能是具有草铵膦耐性的机制之一。有关草铵膦耐性突变系水稻受草铵膦药害后的快速恢复机制目前尚未清楚,还有待进一步研究。
