乳腺癌多模态超声特征与VEGF、SATB1、CK5/6表达的相关性*
2021-04-28车欣朱婷伍珑胡蓉菲
车欣 朱婷 伍珑 胡蓉菲
(复旦大学附属华山医院北院宝山分院超声科, 上海 200431)
乳腺癌是常见的女性恶性肿瘤,近年来我国的发病率居高不下[1]。随着分子生物学的迅猛发展,许多与乳腺癌病理及预后有关的分子标志物成为了众多学者研究的重点,如普遍被认知的雌激素受体(Estrogen Receptor,ER)、孕激素受体(Progesterone Receptor,PR)、人表皮生长因子受体2(Human Epidermal Growth Factor Receptor-2,HER-2)和Ki67等[2-5]。由于乳腺癌的发生、发展机制非常复杂,近年来许多研究者也报道了包括血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、特异AT序列结合蛋白1(Special-At Rich Sequence Binding Protein 1,SATB1)和CK5/6等在内的其他分子标志物与乳腺癌病理和预后密切相关[6-8]。然而,目前这些分子标志物的检测都是有创性的,需通过获得活体组织标本,结合病理诊断结果才能完成。常规超声、剪切波弹性成像(Shear Wave Elastography,SWE)和超声造影(Contrast-Enhanced Ultrasonography,CEUS)都是常用的乳腺病变临床检测方式。已有研究报道,常规超声、SWE和CEUS特征与乳腺癌ER、PR、HER-2和Ki67表达有关[9-10],而目前还未有研究探讨多模态超声特征与VEGF、SATB1和CK5/6这些已被报道的乳腺癌相关分子标志物的相关性。因此,本研究旨在通过描述不同VEGF、SATB1和CK5/6表达状态乳腺癌的多模态超声特征,探讨两者的的相关性,以期术前无创评估乳腺癌预后,从而为疾病的临床诊治提供影像学新思路。
1 材料与方法
1.1 一般资料 选取2018年8月~2020年8月于复旦大学附属华山医院宝山分院和西北妇女儿童医院行手术治疗的216例女性乳腺癌患者为研究对象,共216个病灶。患者年龄21~79岁,平均(46.33±7.48)岁。纳入标准:①术前均行常规超声、SWE和超声造影检查,检查前未行穿刺及切检操作。②检查前未进行放、化疗和内分泌治疗。③术后切除标本组织行病理和免疫组化分析,检测VEGF、SATB1和CK5/6表达情况。④自愿参加研究。排除标准:①复发、多灶及双侧乳腺病灶。②超声特征或免疫组化资料不完整。本研究获得了医院伦理委员会审核并通过,并且患者签署了知情同意书。
1.2 方法
1.2.1 仪器和检查方法 采用超声科Supersonic Imagine Aixplorer型超声诊断仪,常规超声及SWE成像使用L15-4线阵探头,频率4~15 MHz; CEUS使用L10-2线阵探头,频率2~10 MHz。根据ACR第五版BI-RADS分级标准对病灶大小、内部回声、后方回声、肿块边缘、有无微钙化以及血流程度等常规超声特征进行观察描述。然后切换至SWE模式,当发现病灶周围高弹性模量的“硬环征”或病灶中心弹性模量缺失的“黑洞征”时,进行记录。更换探头,调至造影模式,选择病灶区与周围正常乳腺组织为感兴趣区,得到时间强度曲线,分析病灶的增强强度、以及是否早于周边正常组织增强或消退。
1.2.2 免疫组织化学方法及判定标准 取手术切除乳腺癌标本,采用免疫组织化学SP法检测乳腺癌组织中的VEGF、SATB1和CK5/6。评估时采用双盲法,当结果不一致时,可由2名以上主任医师进行商讨,最终确定评定结果。判定标准为:VEGF主要定位在细胞质,呈棕黄色,阳性细胞百分比计分如下:无阳性细胞为0分,1%~10%为1分,11%~25%为2分,26%~50%为3分,51%~75%为4分,≥76%为5分;染色强度计分如下:无着色为0分,淡黄色或黄色为1 分,棕黄色为2分,棕褐色为3分,取两项乘积作为最终得分,其中分数>3分为阳性,≤3分为阴性[11]。SATB1定位于细胞核,颗粒为棕黄色且阳性细胞百分比≥50%,或颗粒为棕褐色且阳性细胞百分比≥25% 即为表达阳性,否则认为表达阴性[12]。CK5/6 定位于细胞质,有棕黄色颗粒出现即为阳性细胞,若阳性细胞百分比<10%,则为CK5/6阴性;若≥10%,则为 CK5/6 阳性[13]。

2 结果
2.1 病理及免疫组化结果 216例乳腺癌中,浸润性导管癌176例、导管内原位癌20例、黏液腺癌12例、髓样癌4例、2例恶性叶状肿瘤、2例多形性癌。肿瘤直径0.5~4.0 cm,平均(2.19±0.88) cm。VEGF阳性128例(59.3%),阴性88例(40.7%);SATB1阳性144例(66.7%),阴性72例(33.3%);CK5/6阳性156例(72.2%),阴性60例(27.8%)。
2.2 常规超声特征与VEGF、SATB1和CK5/6表达水平的关系 常规超声特征中有无微钙化与VEGF表达水平有关,VEGF阳性者出现微钙化的比例均显著高于阴性者,差异有统计学意义(P<0.05),见表1。肿块边缘状态和有无微钙化与SATB1表达水平有关,SATB1阳性者出现肿块边缘不光整和钙化的比例均显著高于阴性者,差异有统计学意义(P<0.05),见表2。有无微钙化与CK5/6表达水平有关,CK5/6阳性者出现微钙化钙化的比例显著高于阴性者,差异有统计学意义(P<0.05),见表3。
VEGF、SATB1和CK5/6表达阳性的患者常规超声多表现为边缘不光整和微钙化,见图1A; VEGF、SATB1和CK5/6表达阴性的患者常规超声多表现为边缘光整和无微钙化,见图1B。

表1 常规超声特征与VEGF表达水平的关系

表2 常规超声特征与SATB1表达水平的关系

表3 常规超声特征与CK5/6表达水平的关系
2.3 SWE征象与VEGF、SATB1和CK5/6表达水平的关系 VEGF阳性和阴性者出现硬环征、黑洞征的比例比较,差异无统计学意义(P>0.05);SATB1和CK5/6阳性者出现硬环征的比例均显著高于阴性者(P<0.05),而出现黑洞征的比例在各组阳性和阴性者间差异无统计学意义(P>0.05),见表4。SWE典型征象硬环征和黑洞征,见图2。

图1 乳腺癌常规超声典型特征

表4 SWE征象与VEGF、SATB1和CK5/6表达水平的关系

图2 乳腺癌SWE典型特征
2.4 CEUS特征与VEGF、SATB1和CK5/6表达水平的关系 CEUS的增强程度、增强方式和消退方式均与VEGF表达水平有关,VEGF阳性表达者出现高增强、晚增强和晚消退的比例显著高于阴性者(均P<0.05),见表5。消退方式与SATB1表达水平有关,SATB1阳性者出现晚消退的比例显著高于阴性者(P<0.05),见表6。增强程度和消退方式均与CK5/6表达水平有关,CK5/6阳性表达者出现高增强和晚消退的比例均显著高于阴性者(P<0.05),见表7。
VEGF、SATB1和CK5/6表达阳性的患者CEUS多表现为高增强,见图3A。VEGF、SATB1和CK5/6表达阴性的患者CEUS多表现为无增强,见图3B。

表5 CEUS特征与VEGF表达水平的关系

表6 CEUS特征与SATB1表达水平的关系
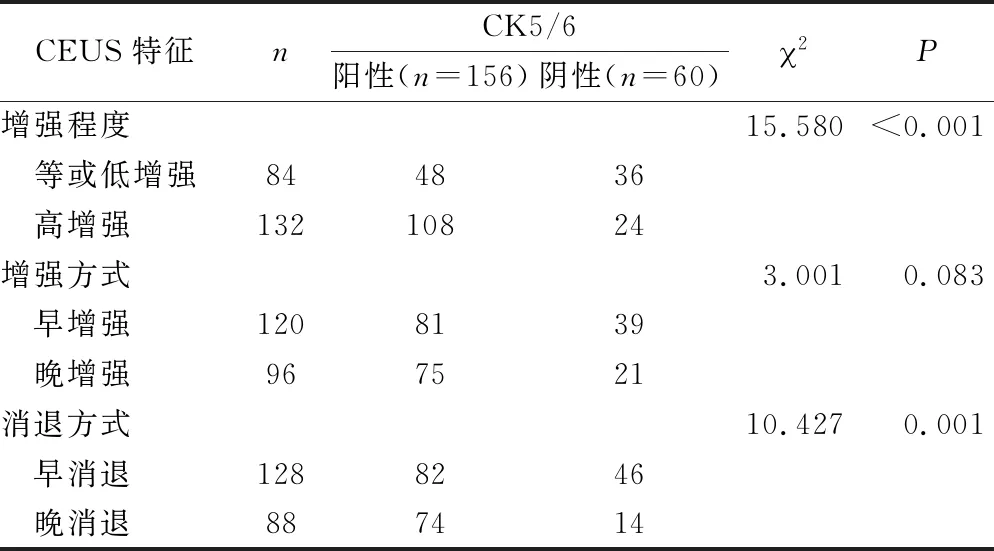
表7 CEUS特征与CK5/6表达水平的关系
2.5 二元Logistic回归分析 对单因素分析中的变量赋值,见表8。分别以VEGF、SATB1和CK5/6表达水平为因变量(阴性=0;阳性=1),以各自单因素分析结果中有意义的变量作为自变量,进行二元Logistic分析。结果显示,CEUS表现高增强、晚消退是乳腺癌VEGF表达阳性的独立危险因素(P<0.05);出现微钙化、硬环征和CEUS表现晚消退是SATB1表达阳性的独立危险因素(P<0.05);出现微钙化,CEUS表现高增强、晚消退是乳腺癌CK5/6表达阳性的独立危险因素(P<0.05),见表9。

图3 乳腺癌CEUS典型特征

表8 多模态超声特征各变量的赋值

表9 Logistic回归分析结果
3 讨论
目前乳腺癌位居我国女性主要癌症发病率的首位,严重影响患者身心健康。由于乳腺癌的发生、发展机制十分复杂,并且尚不明确,随着分子生物学的发生,近年来许多学者都致力于对乳腺癌分子标志物的研究,以期找到分子靶向乳腺癌治疗的突破点[14-15]。VEGF在肿瘤血管形成及转移中起重要作用,VEGF对乳腺癌的预后有明显影响,VEGF表达阳性的乳腺癌患者的无进展生存期及生存率往往较短,且对放、化疗及内分泌治疗等敏感性下降[16]。SATB1是一种组织特异性表达的核基质结合区结合蛋白,可参与T细胞的发育和成熟,研究显示SATB1与乳腺癌发展的恶性进程有关,其高表达可能提示乳腺癌的预后不良[7]。CK5/6属于细胞角蛋白家族中的一员,主要表达于上皮组织的基底细胞层,CK5/6阳性是三阴性乳腺癌患者预后的重要危险因素,与CK5/6 阴性患者相比,CK5/6阳性的患者可以更多地从蒽环联合紫杉类化疗中获益[17]。因此,这些分子标志物都是乳腺癌相关的预后分子标志,术前通过无创的超声检测方式鉴别其在乳腺癌中的表达状态对临床诊治可提供一定参考价值。
超声检查是目前乳腺检查中应用最广泛的一种检查手段,可用来判断肿块部位、大小及性质[18]。本研究结果显示,常规超声特征中是否有微钙化与VEGF、CK5/6表达水平有关,肿块边缘状态和是否有微钙化与SATB1表达水平有关,可见微钙化的发生对判断乳腺癌预后因子的表达至关重要。微钙化是由于肿瘤细胞生长过快,癌细胞氧耗增加导致营养供应不足,从而发生变性溶解,引起钙盐沉积而形成的。肿瘤的恶性程度越高越容易发生微钙化,而恶性程度高的肿瘤往往也预后较差[19]。此外,肿块边缘状态也可能是乳腺癌预后因子SATB1阳性表达的预测因素,相对于SATB1阴性者,阳性者可能更成“侵袭性”生长,对周围组织有浸润,并且存在炎性反应,故具有上述边缘不规整的征象出现[10]。
SWE能实时采集乳腺正常组织和病灶成像速度方面的变化,亦能通过实时获取局部组织的定性表现来直观反映病变组织的空间分布,为乳腺良恶性病变的鉴别诊断提供了新的依据[20]。本研究中探讨了乳腺癌典型SWE征象 “硬环征”和“黑洞征”与预后分子标志物的相关性,结果显示,SATB1和CK5/6阳性者出现“硬环征”的比例均显著高于阴性者,而出现黑洞征的比例在各组阳性和阴性者中的比例无显著差异。对于“硬环征”的出现,有研究[20]提出了两种解释,一种是促纤维结缔组织增生导致间质组织致密纤维化,或癌细胞浸润间质组织,导致病灶周缘硬度增加,第二种是剪切波在经过乳腺恶性病灶周缘时,能量发生衰减,以致进入病灶内部时振幅和/或噪声减少,而导致硬环征的产生。张美恋[20]的研究显示,“硬环征”对乳腺癌的恶性病灶具有预测作用,也在一定程度上反映了疾病的预后不良,因此是乳腺癌预后因子阳性表达的危险因素。
CEUS能够充分显示肿瘤新生血管,从而为评价乳腺肿瘤的微血管灌注提供了可能。本研究中只分析了病灶的CEUS增强强度以及病灶是否早于周边正常组织增强或消退。结果显示,CEUS表现高增强、晚消退与VEGF和CK5/6阳性表达有关,晚消退与SATB1阳性表达有关。乳腺癌是一种血管依赖性病变,新生血管由于缺乏肌层,管壁较薄且走形扭曲,容易形成动静脉瘘,这可能会导致乳腺癌CEUS的高增强,此外,而新生血管扭曲,狭窄,并且内部易有癌栓形成,阻塞出路,这可能是出现晚消退的原因。本研究结果提示,CEUS表现高增强和晚消退可以预测乳腺癌预后因子的表达。
4 结论
本研究结果显示,乳腺癌多模态超声特征可用于预测VEGF、SATB1和CK5/6的表达状态,从而为疾病的临床诊治提供重要参考依据。
