木质素磺酸钠-十六烷基三甲基溴化铵复合物的制备及其对Cu2+的吸附性能1)
2021-04-27倪佳馨韩有奇周军丹李泓漪姜宇刘志明韩世岩
倪佳馨 韩有奇 周军丹 李泓漪 姜宇 刘志明 韩世岩
(生物质材料科学与技术教育部重点实验室(东北林业大学),哈尔滨,150040)
铜是一种广泛应用于工业、农业、医疗等领域的重要过渡金属,然而高浓度Cu2+的存在对多种生物活性成分具有潜在的毒性,并可导致多种器官(肝脏、大脑)的功能紊乱[1]。吸附法是一种除去水体中Cu2+的常用方法,已报道的Cu2+吸附剂有活性炭[2]、微晶纤维素[3]和SiO2[4]等,然而这些吸附剂的制备方法相对复杂。木质素磺酸钠(SLS)是木质素常见的衍生物之一,可通过纸浆和造纸工业分离出来,它具有木质素苯丙烷单元构成的近球状三维网状结构。木质素磺酸钠分子中有大量的羟基存在,可以与金属离子发生螯合作用,同时将其用作制备交联聚合物和水凝胶等吸附材料[5-6]。木质素磺酸钠在极性溶剂中具有聚阴离子电解质的性质,聚电解质是一种单体上带有可电离基团的聚合物,可在极性溶剂中释放出反离子。聚电解质复合物主要是由两种相反电荷聚电解质经复合和分离等过程制备得到,它具有溶液、凝胶、固态等不同的相态形式,在药学、工程、食品科学等领域有潜在的应用价值[7-9]。十六烷基三甲基溴化铵(CTAB)是一种常用的阳离子表面活性剂,因低毒性、良好的生物相容性而被广泛应用[10-11]。由于聚阴离子电解质——木质磺酸钠极易溶于水,从而破坏了其与金属离子的吸附分离效果,因此,本研究以木质素磺酸钠为阴离子基体,CTAB为阳离子源,通过正负电荷静电吸附作用,制备出SLS-CTAB复合物,并分析了该复合物在水中的溶胀性、溶解性及对金属Cu2+的吸附性能。
1 材料与方法
1.1 材料
木质素磺酸钠(SLS)(平均相对分子质量4 500,≥98%,AR)购于曼林生物技术有限公司;十六烷基三甲基溴化铵(99.0%,AR)购于天津市光复精细化工研究所;乙二胺四乙酸二钠(99.0%,AR)购于天津市致远化学试剂有限公司;无水硫酸铜(99.0%,AR)购于天津市永大化学试剂有限公司;氢氧化钠(96.0%,AR)购于天津市大陆化学试剂厂;浓盐酸(36-38%,AR)购于天津市天力化学试剂有限公司;去离子水为实验室自制。
1.2 SLS-CTAB复合物的制备
量取20 mL质量分数为1%的木质素磺酸钠(SLS)水溶液为底液,在室温和磁力搅拌(300 r/min)条件下缓慢滴加20 mL质量分数为1%的十六烷基三甲基溴化铵(CTAB)溶液,反应溶液中慢慢出现絮状沉淀。滴加结束后,继续搅拌反应0.5 h,静置1 h,将所得产物离心分离,并用去离子水洗涤沉淀物3次,在40 ℃的真空干燥箱中干燥得到SLS-CTAB复合物固体。
1.3 SLS-CTAB复合物的结构表征
采用Magna-560型傅立叶变换红外光谱仪(FTIR)对原料及目标产物的结构进行表征分析;采用XPS对SLS-CTAB复合物的元素组成进行分析。采用Malvern-ZEN3700型Zeta电位分析仪对SLS、CTAB和复合后溶液的Zeta电势进行分析;采用TAS 990型原子吸收分光光度计对金属Cu2+的吸附性能进行分析。
1.4 SLS-CTAB复合物的溶解性测定
称取SLS、CTAB和SLS-CATB复合物各0.1 g放入3个烧杯中,并向烧杯中分别缓慢加入去离子水、NaOH溶液(0.01 mol·L-1)、HCl溶液(0.01 mol·L-1)各100 mL,观察固体的溶解性。
1.5 SLS-CTAB复合物对Cu2+吸附性能测定
Cu2+标准曲线:用无水硫酸铜配制1、2、3、4、5 μg·mL-1的Cu2+溶液,用原子吸收法测定其在325 nm处的吸光度值,得到硫酸铜溶液质量浓度与吸光度的标准曲线。
吸附时间对Cu2+吸附性能:配制100 μg·mL-1的硫酸铜溶液,准确称量5 mg的SLS-CTAB复合物7份,分别加入到7个烧杯中。移取25 mL硫酸铜溶液注入每个烧杯中,在25.0 ℃条件下进行振荡吸附,分别在吸附1、3、5、8、10、11、12 h的溶液中取上清液20 mL,用去离子水定容至100 mL,测定SLS-CTAB复合物对硫酸铜的吸附容量。
SLS-CTAB复合物对Cu2+吸附容量测定:采用原子吸收火焰法测定SLS-CTAB复合物对Cu2+的吸附性能。分别配制20、30、40、50、60、70、80 μg·mL-1的硫酸铜溶液。精确称量5 mg SLS-CTAB复合物7份放入烧杯中,并分别加入上述配制的不同质量浓度的硫酸铜溶液各25 mL。25 ℃条件下振荡12 h,取上清液20 mL,用去离子水定容至100 mL,并分析25 ℃时SLS-CTAB复合物对Cu2+的吸附容量。
2 结果与分析
2.1 FTIR分析结果
采用FTIR对SLS、CTAB和SLS-CTAB复合物的化学结构进行分析(见图1)。可知,SLS-CTAB复合物在3 370 cm-1处存在—OH伸缩振动吸收特征峰,2 920、2 855 cm-1处甲基(—CH3)和亚甲基(—CH2)的伸缩振动吸收峰增强;1 600~1 400 cm-1处保留了苯环吸收峰[12];季铵盐的引入,使其在1 464 cm-1处的吸收峰增强[13];在1 039、1 162 cm-1处的两个强吸收峰,分别对应SO的反对称伸缩振动和—SO3—的非对称伸缩振动。通过FTIR分析证实了SLS-CTAB复合物的成功制备。

图1 SLS、CTAB和SLS-CTAB的FTIR谱图
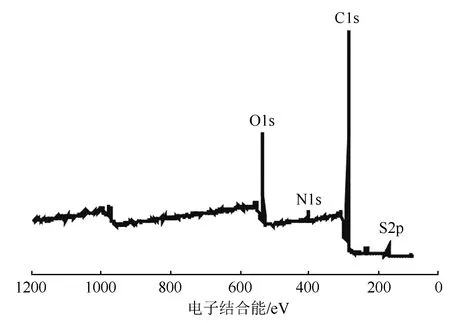
图2 SLS-CTAB的XPS谱图
2.2 SLS-CTAB复合物的XPS分析结果
图2为SLS-CTAB复合物的XPS谱图,可知,SLS-CTAB复合物主要存在C、N、O、S元素,其原子数量百分比分别为79.35%、2.59%、15.41%、2.65%。而复合后产物中未检测到Na和Br元素,这是因为Br-与Na+在复合过程中通过正负离子作用生成易溶于水的NaBr被分离除去。XPS分析结果进一步证实了SLS-CTAB复合物的成功制备。
2.3 SLS-CTAB复合物的溶解性能
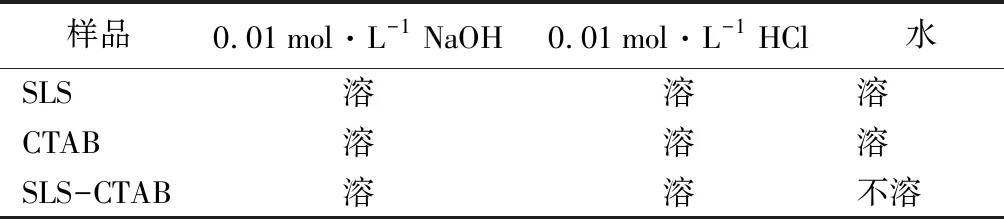
表1 SLS、CTAB和SLS-CTAB的溶解性能
2.4 SLS-CTAB复合物的溶胀性
溶胀率依赖于材料的聚集态结构,微孔大小及其分布,SLS和CTAB在中性溶液中溶解性很好,而SLS-CTAB复合物由于分子间存在着较强的离子静电吸引作用,促进其吸水作用而不溶解,并在水溶液中以胶体形式产生溶胀。SLS-CTAB复合物在水中的溶胀率随着溶胀时间的延长而不断增加,当溶胀时间为7 h时吸附溶胀达到平衡,此时SLS-CTAB的吸水溶胀率为282.8%。
2.5 SLS-CTAB对Cu2+的吸附性能
2.5.1吸附时间对Cu2+吸附性能的影响
SLS-CTAB复合物对Cu2+溶液的吸附研究显示,随着吸附时间的延长复合物对Cu2+的吸附容量增长较快,吸附从1 h延长到12 h时,复合物对Cu2+的吸附容量分别为422.69、424.84、426.45、431.41、439.18、440.23、440.45 mg·g-1。由吸附结果可以看出当吸附10 h后,吸附速率随时间延长逐渐减缓。因此,复合物对Cu2+的吸附平衡时间约为10 h,计算其饱和吸附容量为439.18 mg·g-1,相对于已报道的Cu2+吸附剂有着较大的优势[2-4]。使用浓度为0.1 mol·L-1的EDTA-2Na溶液和去离子水分别对复合物吸附剂洗涤3次进行解吸附,在吸附Cu2+的一个吸附—个解吸附循环之后,吸附容量仍保持约80%。
2.5.2SLS-CTAB复合物对Cu2+的吸附等温线
绘制Cu2+标准曲线,得到标准曲线方程为y=0.186 5x+0.010 3,相关系数R2=0.998 8。为了研究SLS-CTAB复合物对Cu2+的吸附作用机制,分析了不同质量浓度的硫酸铜溶液中,SLS-CTAB复合物对Cu2+的吸附容量及平衡吸附过程,测定了25 ℃时复合物对Cu2+的等温吸附曲线。结果表明,随着硫酸铜溶液质量浓度的增加,SLS-CTAB复合物对Cu2+的吸附容量逐渐增加,分别为209.45、244.45、286.67、326.22、367.9、406.37、436.12 mg·g-1。结合吸附时间对Cu2+吸附性能的影响,确定硫酸铜质量浓度为80 μg·mL-1可作为复合物吸附的最佳质量浓度。
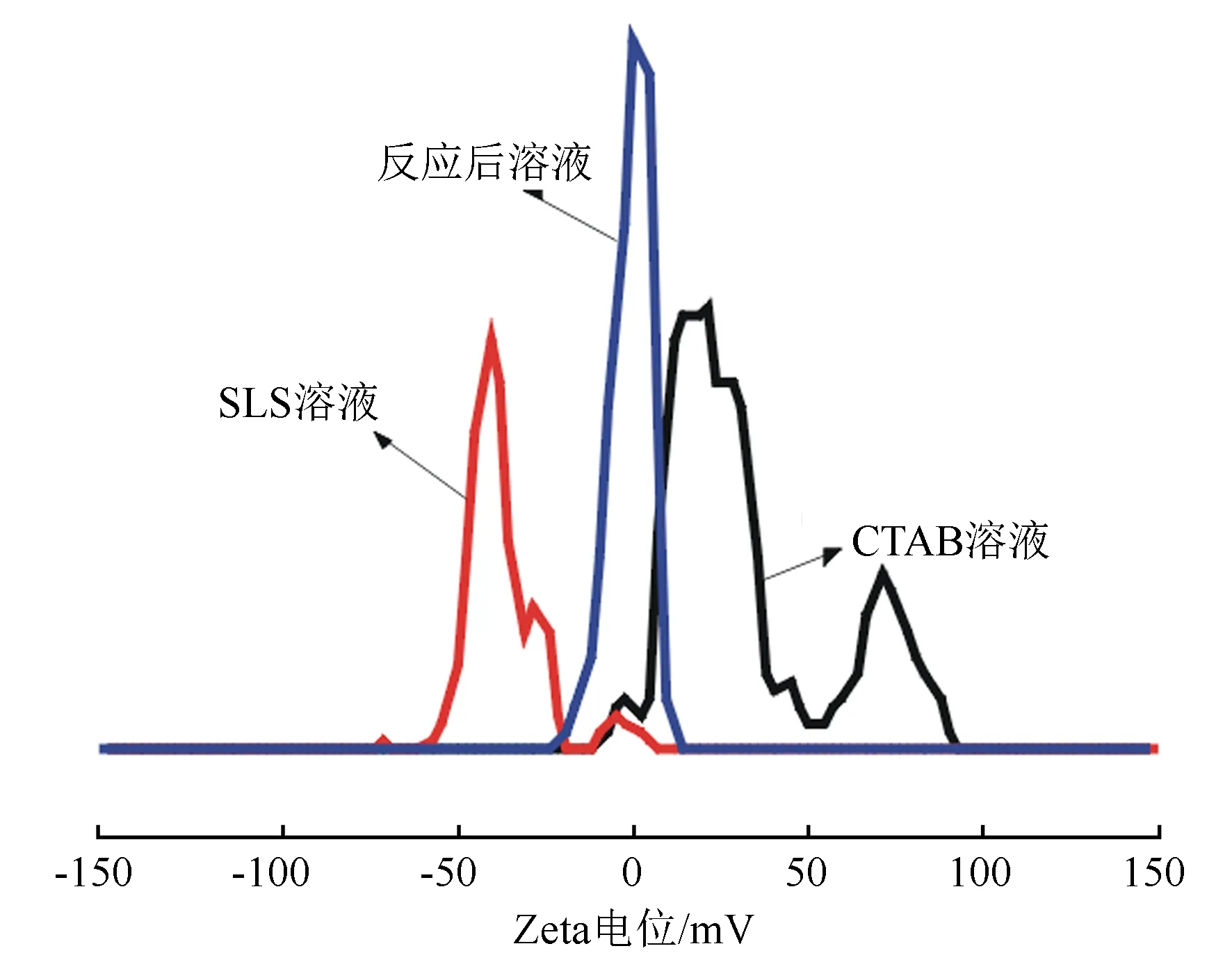
图3 SLS、CTAB和反应后溶液的Zeta电势
2.5.3 SLS-CTAB复合物的形成方式
SLS、CTAB和复合后溶液的Zeta电位分析见图3。可知,带有负电荷的SLS和带有正电荷的CTAB复合反应后溶液的Zeta电位呈中性,证实了SLS-CTAB复合物的作用方式主要是离子间的正负电荷静电复合作用,也可能存在羟基的氢键作用。分子间的束缚力增加,而形成了具有聚电解质特点的复合物。结合该复合物的结构表征及溶解性能分析,模拟其复合形成方式见图4。
2.5.4 SLS-CTAB复合物对铜离子的吸附作用机理
采用等温吸附平衡分析的方法,探讨了SLS-CTAB复合物对金属离子吸附可能的作用方式,利用Langmuir和Freundlich吸附方程对SLS-CTAB复合物的吸附等温线进行线性拟合[14],Langmuir和Freundlich方程拟合的相关系数(R2)分别为0.955 3和0.991 2。因此,SLS-CTAB的吸附符合Freundlich吸附模型,拟合结果和相关数据见图5,得到的拟合方程为lgQ=0.544 8lgc+1.596,其中:Q为吸附平衡时SLS-CTAB复合物对Cu2+的吸附容量(mg·g-1);c为吸附前硫酸铜的初始质量浓度(μg·mL-1)。由于SLS-CTAB复合物对Cu2+的吸附数据符合Freundlich方程,说明SLS-CTAB复合物对Cu2+的吸附不仅存在磺酸基静电作用,与氨基也可能存在配位作用的化学吸附,即阴离子与阳离子均可能与金属Cu2+发生作用。

图4 SLS-CTAB复合物的形成方式模拟图
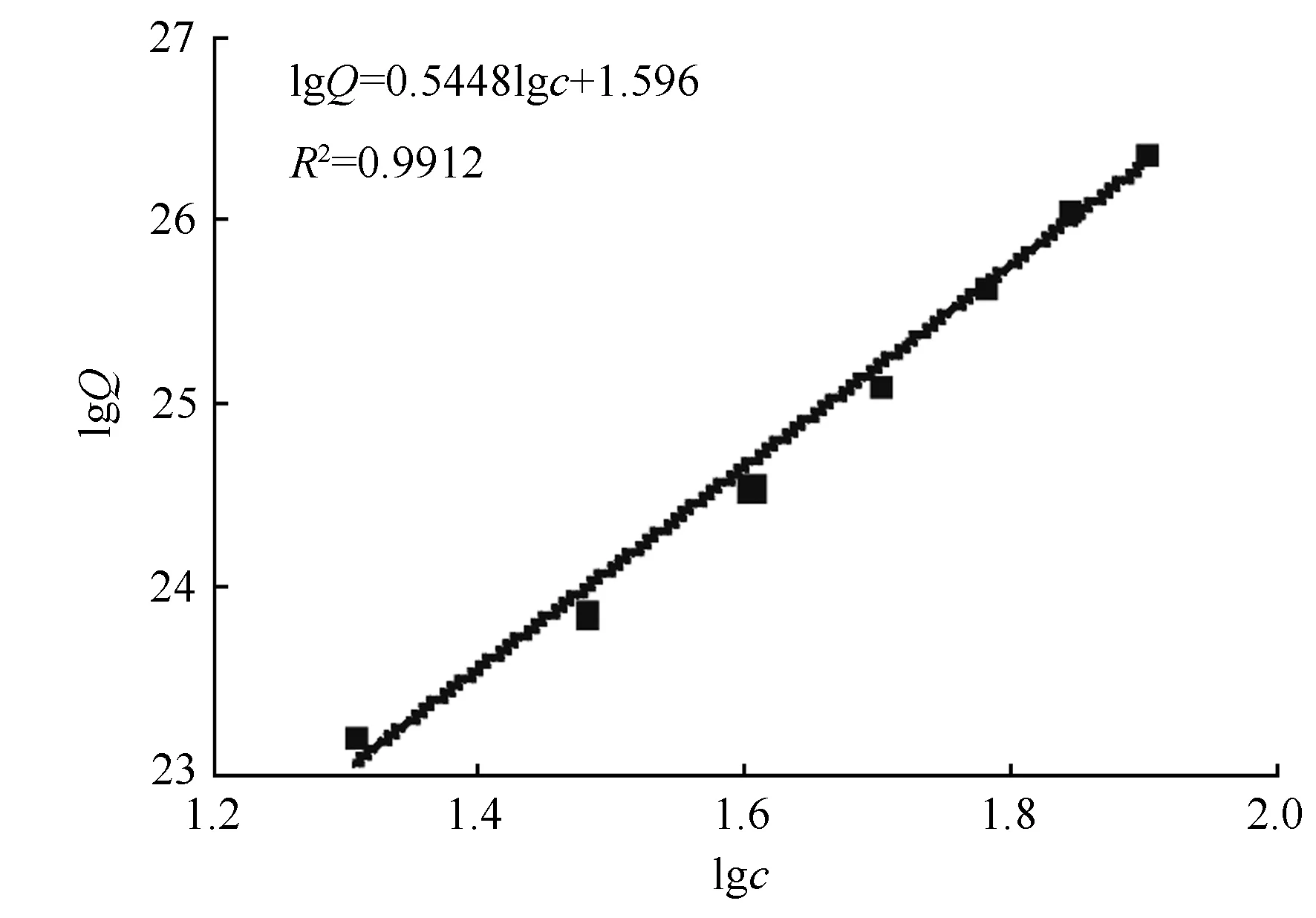
图5 SLS-CTAB对Cu2+吸附的Freundlich方程曲线

图6 SLS-CTAB对Cu2+的二级吸附动力学方程曲线
利用准一级和二级吸附动力学模型对SLS-CTAB复合物在不同时间下的吸附数据进行吸附动力学拟合[15]。一级和二级动力学方程拟合得到的相关系数(R2)分别为0.873 8和0.999 7。结果表明,SLS-CTAB复合物的二级吸附动力学方程能很好地拟合该实验数据,且相关系数接近于1。因此,SLS-CTAB对Cu2+的吸附过程遵循准二级吸附动力学模型,其吸附速率受化学吸附的控制[14]。准二级吸附动力学方程为t/Qt=1/(Q2k)+t/Q,其中Qt和Q分别为t时间和吸附平衡时的吸附量(mg·g-1),k为二级动力学常数。拟合结果和相关数据见图6,计算得到的平衡吸附容量为444.44 mg·g-1,与实验得到的结果439.18 mg·g-1基本一致。
3 结论
以木质素磺酸钠(SLS)和十六烷基三甲基溴化铵(CTAB)原料,通过静电吸附作用制备了SLS-CTAB复合物。采用FTIR对SLS-CTAB复合物的官能团结构进行了确证;利用XPS对SLS-CTAB复合物的元素组成分析,结果表明复合物中主要存在C、N、O、S元素。FTIR和XPS分析结果证实了SLS-CTAB复合物已成功制备。对SLS-CTAB复合物在中性(去离子水)、酸性(0.01 mol·L-1HCl)和碱性(0.01 mol·L-1NaOH)溶液中的溶解和溶胀性能进行分析,结果表明,SLS-CTAB复合物易溶于酸性和碱性溶液,不易溶于水,对水的溶胀率为282.8%。SLS-CTAB复合物对Cu2+的吸附性能分析表明,复合物对Cu2+的吸附平衡时间约为10 h,饱和吸附容量为439.18 mg·g-1,吸附硫酸铜溶液的最佳质量浓度为80 μg·mL-1。循环吸附一次实验,其吸附容量保持约80%。Zeta电位分析表明反应后溶液为中性,SLS-CTAB复合物的形成方式主要为离子间的正负电荷静电复合作用。吸附数据拟合表明,该复合物对Cu2+的吸附符合Freundlich方程和准二级吸附动力学方程,说明SLS-CTAB对Cu2+的吸附可能存在物理吸附和化学吸附两种方式,其吸附速率主要受化学吸附的控制。
