hsa_circ_0003188对人骨髓间充质干细胞成骨分化能力的影响
2021-04-27梁甲武胡巍屈爽袁一方郭斌
梁甲武 胡巍 屈爽 袁一方 郭斌
牙周炎导致的牙槽骨缺损,不仅会影响患者的口颌系统功能,增加义齿修复、种植体修复等临床治疗难度,还影响患者的全身健康及生活质量[1]。因此,牙槽骨再生成为广大患者的需求及医生的研究热点。人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)因具有自我更新和多向分化潜能,成为一类优质的组织再生细胞来源。然而,hBMSCs在牙周炎环境中的骨再生能力是否受到影响及相关机制尚不清楚。为此,本研究体外模拟牙周炎环境,运用芯片技术检测正常环境与炎性环境中hBMSCs的circRNAs差异表达,发现hBMSCs在炎性环境中高表达hsa_circ_0003188。通过hsa_circ_0003188对hBMSCs成骨分化能力的影响,为改善骨组织工程效果提供理论依据,为实现牙槽骨再生提供新的治疗靶点。
1 材料与方法
1.1 主要材料
α-MEM和胎牛血清(Gibco,美国);TNF-α(300-01A, PeproTech,美国);BMSCs成骨诱导液(广州赛业生物科技有限公司);hsa_circ_0005045过表达慢病毒(上海吉凯基因化学技术有限公司);TriZol(Invitgen,美国); PrimeScript RT试剂盒、SYBR PreMixExTaqTMⅡ(Takara,日本); hsa_circ_0003188、GAPDH、ALP、OCN、RUNX2引物(上海生工生物技术有限公司);RIPA缓冲液(Sigma,美国);兔抗人RUNX2、兔抗人ALP、兔抗人OCN、GAPDH(Cell Signal Technology,美国);化学发光试剂盒(amersham Biosciences, 英国);芯片检测(上海康成生物工程有限公司);Western Blot成像系统(Tanon5500,上海天能);倒置荧光显微镜(奥林巴斯,日本)。
1.2 方法
1.2.1 hBMSCs分离和培养 采取健康志愿者的新鲜骨髓10 mL,采用密度梯度离心法分离骨髓间充质干细胞,接种在含α-MEM+10%胎牛血清、2 mmol/L-谷氨酰胺、100 U/mL青霉素和100 mg/mL链霉素的75 mm2培养瓶中,37 ℃,5% CO2培养。隔天换液,观察贴壁细胞的生长情况。细胞生长至单层融合后,胰酶消化后传代培养。所有患者均已知情同意,研究方案通过中国人民解放军总医院医学伦理审查(编号: S2019-066-01)。
1.2.2 实验分组 对照组:常规培养基培养的hBMSCs。炎症组(TNF-α组):取第三代hBMSCs,并向培养液中加入10 ng/mL TNF-α[2],培养1 周,隔天换液。
1.2.3 CircRNA的芯片检测 分别收集炎症组hBMSCs和对照组hBMSCs(每组3 例样本),并利用Trizol一步法提取细胞总RNA。后借助上海康成生物工程有限公司,运用美国ArrayStar公司研发的Human Circular RNA Microarray Version 2.0芯片技术,对2 组样本进行芯片检测及数据分析,筛选两组hBMSCs差异表达的circRNAs,记录circRNAs的上调、下调倍数(log2-Fold Change)。
1.2.4 RNA提取及实时定量聚合酶链反应(RT-qRCR) 用TriZol 提取总RNA,PrimeScript RT试剂盒将总RNA转录成cDNA。CircRNAs和mRNAs的引物序列用Primer Premier 6.0设计,引物序列见表1。用SYBR PreMixExTaqTMII在CFX96型TM实时荧光定量RT-PCR系统(BioRad, 美国)上进行RT-qRCR。CircRNAs和mRNAs的表达数据以GAPDH为内参。用2-ΔΔCt法分析其相对表达量。
1.2.5 成骨诱导 取第三代hBMSCs消化离心后重悬,接种于48 孔板内(2×103个/mL),0.8 mL/孔;和6孔板内(2×104个/mL),2 mL/孔。待细胞生长至约70%时弃原培养基,换成骨诱导液继续培养,换液3 d/次。用加入10 ng/mL TNF-α的成骨诱导液培养hBMSCs 1 周,以体外模拟炎性环境下BMSCs的成骨诱导。隔天换液。在成骨诱导成功后行碱性磷酸酶(ALP)染色和von-kossa染色观察,以及RT-qRCR检测,对BMSCs的成骨分化能力进行评估。

表1 RNA引物
1.2.6 Western blot检测 用RIPA缓冲液裂解hBMSCs,并提取裂解液。用BCA蛋白测定法检测样本的蛋白浓度。将每个样品的40 μg蛋白加到10%SDS-PAGE上,分离后转移到PVDF膜上。将膜用5%牛血清白蛋白封闭2 h,并与兔抗人RUNX2(1∶1 000稀释)、兔抗人ALP(1∶1 000稀释)、兔抗人OCN(1∶1 000稀释) GAPDH(1∶10 000稀释)抗体孵育4 ℃过夜。TBST洗涤3 次后, 加入对应二抗室温孵育1 h。用化学发光试剂盒孵育蛋白条带,并通过成像系统进行显影。
1.2.7 慢病毒转染 hsa_circ_0003188过表达慢病毒委托上海吉凯基因化学技术有限公司构建,取生长状态好的第三代hBMSCs,消化后接种于6 孔板(1×105/孔)中,24 h后更换培养基,并分别加入25.00 μL慢病毒空载体(Lenti-Vector)(MOI=50)和6.62 μL慢病毒hsa_circ_0003188(Lent-hsa_circ_0003188)(MOI=50),以及各孔板加入促转染P液40 μL/mL。转染10 h后更换为完全培养基,72 h后利用倒置荧光显微镜观察绿色荧光蛋白(green fluorescent protein,GFP)表达情况,后提取RNA, 通过RT-qPCR进一步验证转染效果。
1.2.8 生物信息学分析 使用TargetScan,miRDB和miRWalk 3.0生物信息学网站对hsa_circ_0003188的下游miRNAs及其靶基因进行预测,并通过对靶基因的功能分析,初步探讨hsa_circ_0003188参与调控BMSCs成骨分化的机制。
1.3 统计学分析

2 结 果
2.1 炎性环境抑制hBMSCs成骨分化
成骨诱导14 d后的ALP染色结果显示,与未成骨诱导的hBMSCs相比,对照组hBMSCs染色较深,成骨能力较强。而与对照组hBMSCs相比,炎症组hBMSCs的染色明显较浅,成骨能力较弱(图1)。成骨诱导21 d后的von-kossa染色结果显示,对照组hBMSCs有明显的矿化结节形成,而炎症组hBMSCs的矿化结节形成明显少于对照组(图1)。因此,炎症组hBMSCs成骨分化能力明显低于对照组,提示体外模拟的炎性环境抑制hBMSCs成骨分化能力。
2.2 hsa_circ_0003188在炎症组hBMSCs中高表达
对收集自对照组和炎症组hBMSCs的RNA进行Human Circular RNA Microarray Version 2.0芯片检测,结果显示,与对照组相比,炎症组hBMSCs有1 266 个circRNAs表达上调, 1 029 个circRNAs表达下调(|Fold change|>2,P<0.05)(图2)。其中hsa_circ_0003188上调倍数较高,上调倍数为4.39 倍。RT-qPCR结果进一步验证,hsa_circ_0003188在炎症组hBMSCs中的表达水平显著高于对照组(图3)。
2.3 hsa_circ_0003188过表达慢病毒抑制hBMSC成骨分化
hBMSCs分别转染Lenti-Vector和Lent-hsa_circ_0003188 72 h后,于倒置荧光显微镜下观察,转染成功的细胞带有GFP绿色荧光,转染率超过70%(图4)。RT-qPCR结果显示,与转染Lenti-Vector的hBMSCs相比,转染Lent-hsa_circ_0003188的hBMSCs中hsa_circ_0003188的表达水平显著升高(图5)。

图1 3 组的hBMSCs的ALP染色图

图2 2 组hBMSCs的CircRNAs表达的聚类分析和火山图 图3 RT-qPCR检测2 组hBMSCs的hsa_circ_0003188的表达

图4 转染效果观察
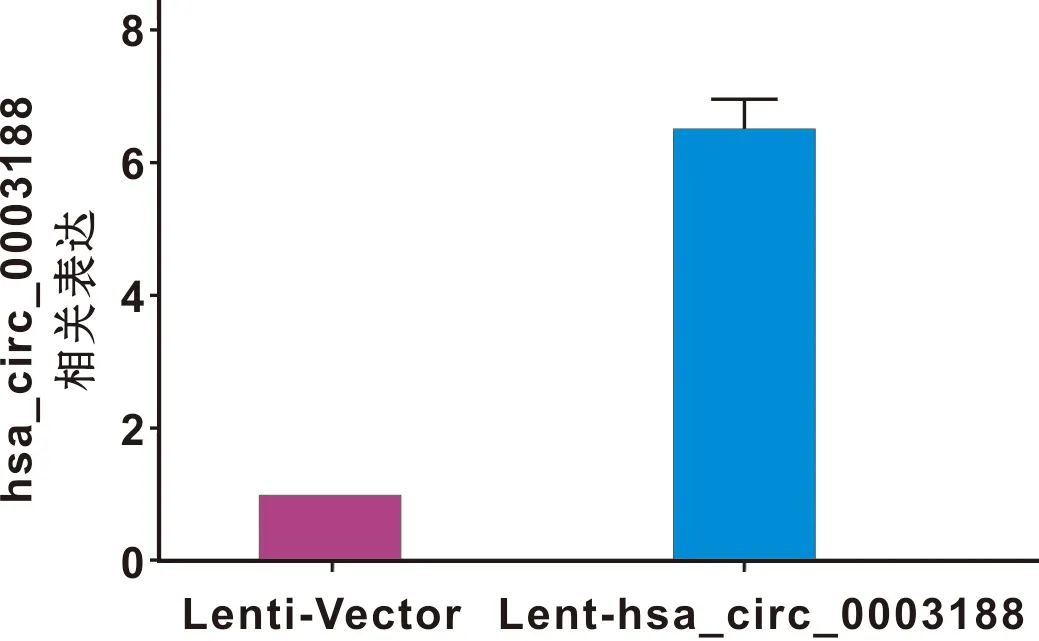
图5 细胞内hsa_circ_0003188的表达水平
将转染Lenti-Vector和Lent-hsa_circ_0003188成功的hBMSCs进行成骨诱导,并在14 d后行ALP染色观察,和21 d后行von-kossa染色观察。结果显示,与转染Lenti-Vector的hBMSCs相比,hBMSCs转染Lent-hsa_circ_0003188后,ALP染色较浅,矿化结节生成较少(图6)。此外,过表达hsa_circ_0003188导致ALP、RUNX2和OCN等成骨相关基因在mRNA水平(图7)及蛋白水平表达下降(图8)。综上所述,hsa_circ_0003188抑制hBMSCs成骨分化能力。
2.4 生物学功能预测
根据上海康成生物工程有限公司对差异表达谱中circRNAs下游miRNAs的预测结果,以及Targetscan,miRDB和miRWalk 3.0的联合运用,得到符合要求的ceRNA关系对。使用Cytoscape v 3.6.1软件将筛选后的ceRNA绘制成circRNA-miRNA-mRNA关系网络图,并对hsa_circ_0003188可能发挥作用的ceRNA通路进行预测。

图6 hBMSCs转染后矿化检测

图7 转染后的hBMSCs ALP,OCN,RUNX2的mRNA表达水平

图8 转染后的hBMSCs RUNX2、OCN、ALP的蛋白水平的表达
3 讨 论
牙周炎是一种由牙菌斑引起的多种因素影响的慢性炎症性疾病。牙周炎若不及时治疗,则会导致牙周支持组织(牙周膜,牙骨质和牙槽骨)发生不可逆损伤,甚至牙齿脱落[3]。牙周炎引起的牙槽骨丧失会严重影响患者的口颌系统功能,增加种植和修复的难度。近年来的基础研究和临床试验表明,组织工程骨有望成为一种理想的骨修复方式,恢复患者骨缺损区的形态结构及功能。干细胞由于具有多向分化及自我更新能力,多种干细胞被用于骨组织工程领域。例如牙周膜干细胞(periodontal ligament stem cells,PDLSCs)、牙髓干细胞(dental pulp stem cells,DPSCs)、牙囊干细胞(dental follicle stem cells,DFSCs)等均有研究报道可诱导骨形成,促进骨再生[4-6],BMSCs更是被认为经典的“多能”种子细胞,以BMSCs为研究对象的骨组织工程研究成果更加丰富且成熟。CircRNAs是一类反向剪接形成的共价闭合环状结构的内源性非编码RNA[7]。根据序列来源circRNAs分为外显子环状RNA、内含子环状RNA以及外显子-内含子环状RNA。由于circRNA的特殊环状结构,其具有高度保守性,组织特异性,且不易被RNA酶降解[8-9]。随着对circRNAs功能的深入研究,研究人员发现某些circRNAs分子可通过表面的miRNA反应原件(miRNA response elements, MREs)选择性吸附miRNAs[10],进而影响下游靶基因表达,以及调控RNA结合蛋白,调控基因转录,参与蛋白质翻译等功能。目前,已有研究报道circRNAs对干细胞的自我更新及多向分化能力具有调控作用。Zhang等[11]发现hBMSCs成骨分化后各阶段与未成骨诱导的hBMSCs之间的circRNAs差异表达谱,且circIGSF11通过调控miR-199b-5p促进hBMSCs成骨分化。Ouyang等[12]利用微阵列分析获得骨不连患者与正常骨折愈合患者的hBMSCs的circRNAs差异表达谱,并筛选鉴定出 hsa_circ_0074834可以促进hBMSCs的成骨分化及骨缺损的修复。但是,由于BMSCs的来源及研究方向不同,不同研究中所报道的BMSCs成骨分化相关的circRNAs存在差异。
为更加符合实际临床需求,本研究以hBMSCs为研究对象,通过Human Circular RNA Microarray Version 2.0芯片检测和生物信息学分析,筛选出正常环境与炎性环境培养的hBMSCs差异表达circRNAs--hsa_circ_0003188。进一步实验得知:hsa_circ_0003188在炎性环境hBMSCs中高表达,且抑制其成骨分化。之后,联合运用TargetScan、miRDB和miWalk 3.0等算法对hsa_circ_0003188的ceRNA机制进行预测。但关于hsa_circ_0003188在hBMSCs成骨过程中的具体作用机制有待后期实验的开展。因此,hsa_circ_0003188的发现为深入研究hBMSCs的成骨分化机制,改善骨组织工程效果提供了新的理论和实验依据,为临床上实现牙槽骨再生提供了治疗新靶点。
