2020年日本胃肠内镜学会(JGES)《早期胃癌ESD和EMR指南》要点
2021-04-23凌世宝王业涛
凌世宝, 王业涛
1.梅州市人民医院(梅州市医学科学院 中山大学附属梅州医院)消化内科,广东 梅州 514031;2.中国科学技术大学附属第一医院消化内科
日本在早期胃癌(early gastric cancer,EGC)内镜治疗的发展和进步中发挥了核心作用。特别是上世纪90年代在日本发展起来的内镜黏膜下剥离(endoscopic submucosal dissection,ESD)技术,在早期胃癌的治疗中得到了广泛应用,手术切除是早期胃癌的标准治疗方法。日本胃肠内镜学会(The Japan Gastroenterological Endoscopy Society, JGES)最近发布了2020年版《早期胃癌ESD和内镜下黏膜切除(endoscopic mucosal resection,EMR)指南》,根据近年来大量新的研究成果,对2014年发布的《早期胃癌ESD及EMR指南》进行更新和充实。据估计,在日本,内镜治疗占所有早期胃癌治疗的60%以上,因此,指南的重要性与日俱增。指南分为以下7个类别:适应证、术前诊断、技术、可治愈性评估、并发症、术后长期监测和组织学。其中组织学部分陈述大多是基于专家的一致意见,该部分描述了处理切除标本和测量病变的具体操作,旨在帮助国外的病理学家以及非胃肠病理学家。2020年版《早期胃癌ESD和EMR指南》涵盖了内镜下早期胃癌日常临床治疗所需的最低限度的基本信息,对我国临床及病理医师具有较大的参考价值和指导意义。现将新版指南的推荐要点及核心内容翻译如下。
1 指征
1.1 基本方法一旦确诊为早期胃癌,建议内镜或手术治疗(证据:中,推荐:强)。目前尚无研究明确表明内镜治疗胃癌有更好的预后或生活质量,或内镜治疗与开放外科手术治疗在预后或生活质量方面存在差异。
一般情况下,当淋巴结转移的可能性极低,且病灶大小和部位可以整块切除时,应行内镜切除(证据:中,推荐:强)。
除了术前诊断,治疗的选择应该基于风险—效益分析和考虑每例患者的情况。肿瘤相关因素的适应证分为绝对适应证、扩大适应证和相对适应证(见图1)。
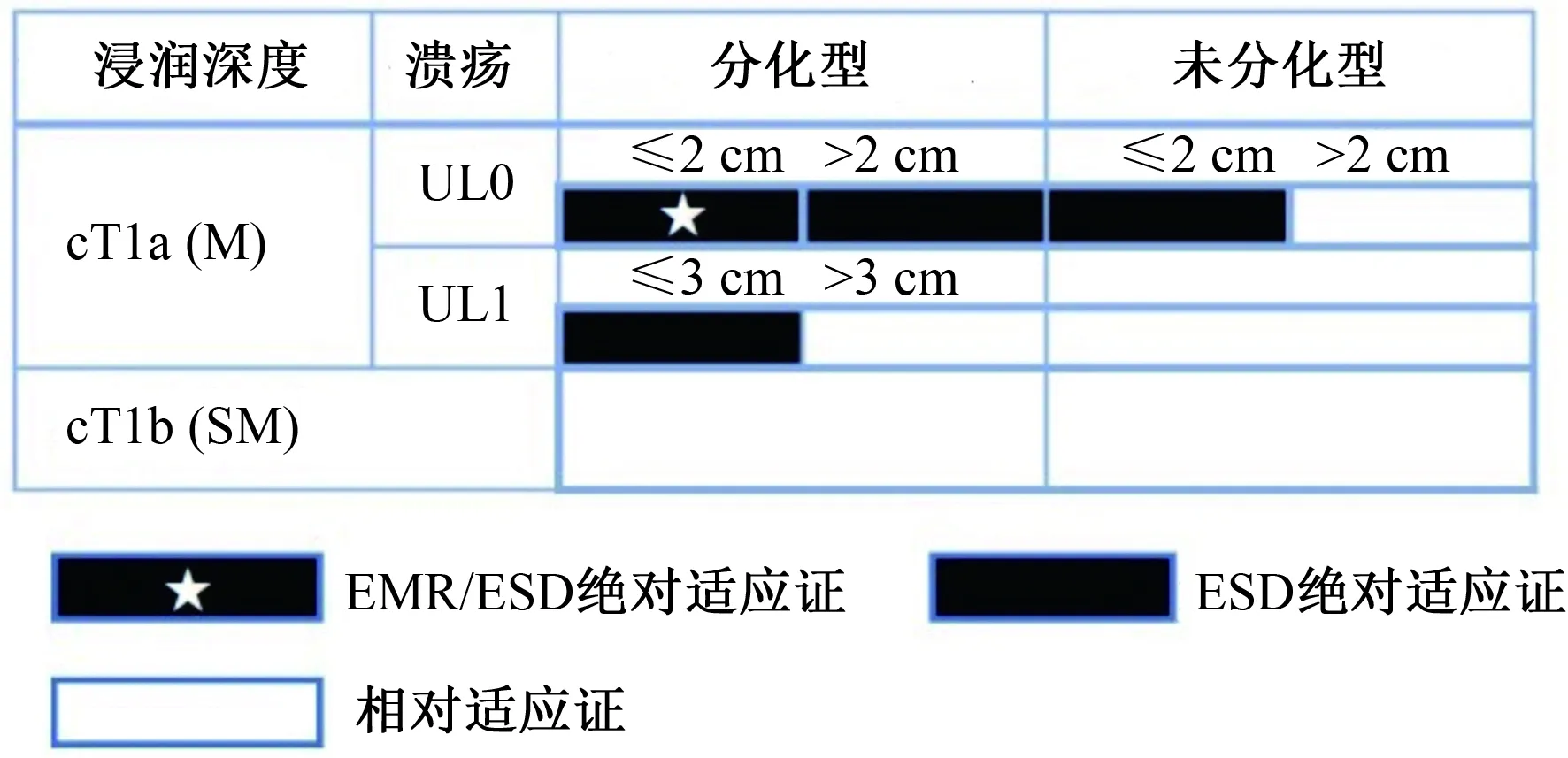
注:cT1a(M):黏膜内癌(术前诊断);cT1b(SM):黏膜下浸润性癌(术前诊断)发现溃疡(或溃疡瘢痕);UL0:无溃疡和溃疡瘢痕;UL1:有溃疡或溃疡疤痕。
1.2 绝对适应证病灶如果病灶被认为是<1%的淋巴结转移风险且与外科胃切除术有相似的长期预后时,则认为病灶是内镜治疗的绝对适应证。EMR/ESD的绝对适应证是“UL0 cT1a分化型癌,长径≤2 cm。”ESD的绝对适应证为“(1)UL0 cT1a分化型癌,长径>2 cm;(2)UL1 cT1a分化型癌,长径≤3 cm;(3)UL0 cT1a未分化型癌,长径≤2 cm”(证据:中,推荐:强)。基于多中心前瞻性研究的结果,早期胃癌ESD和EMR指南(第1版)中ESD扩大适应证(不包括局部复发)的病灶已纳入本指南的ESD绝对适应证(JCOG0607和JCOG1009/1010)。
1.3 扩大适应证病灶在第1版ESD和EMR指南中,根据肿瘤相关因素划分为扩大适应证的病变已纳入本指南的绝对适应证。仅适用于分化型癌,病变可被认为是ESD的扩大适应证,前提是绝对适应证病灶在初次ESD/EMR后局部复发为黏膜内癌,且内镜可治愈性(eCura)为C-1级(证据:低,推荐:弱)。
1.4 相对适应证病变部分早期胃癌病例以外科手术胃切除为标准治疗,内镜治疗虽然预期治愈率较低,但仍可治愈。对于不符合内镜治疗绝对适应证或扩大适应证要求的早期胃癌,应考虑患者不推荐外科手术,或在术前对整个病变建立准确的组织病理学诊断的情况下,建议内镜治疗。
2 术前诊断
2.1 协助确定内镜治疗指征的信息判断是否有ESD或EMR手术指征,需要明确:(1)组织病理类型;(2)大小;(3)浸润深度;(4)是否存在溃疡(证据:极低,推荐:强)。首先,组织病理类型(分化型和未分化型)通常通过活检标本的组织病理学检查来确定。在对切除的标本进行组织病理学检查后,进行研究和处理以进行最终测量。为了确定是否存在溃疡,需检查病变是否有活动性溃疡或溃疡瘢痕。早期胃癌浸润深度的判定一般采用常规内镜,推荐使用靛胭脂染料喷洒。当使用常规内镜难以确定浸润深度时,超声内镜可能是一种有用的补充诊断方法。
2.2 协助确定水平切除边缘的信息一般来说,传统的染色内镜或基于放大内镜的图像增强内镜用于确定水平切缘(证据:中,推荐:强)。传统的染色内镜是用于确定肿瘤范围的一种简单且最广泛使用的方法。在未分化型的早期胃癌和某些分化型的病变中,内镜难以判定边缘。在这种情况下,应该从病变周围取活检并进行组织病理学检查。
3 技术
当EMR用于具有绝对或扩大ESD适应证的病变时,不完全切除的风险较高,因此对于这些病变应采用ESD而不是EMR(证据:中,推荐:强)。
4 可治愈性的评估
内镜下可治愈性的评估基于淋巴结转移的局部因素和危险因素(证据:中,推荐:强)。
4.1 内镜可治愈性A级(eCuraA) 治愈性切除在长期疗效方面,内镜切除被证明与外科手术切除相同或优于外科切除。当病灶整块切除时,以下情况考虑为eCuraA:(1)分化型为主,pT1a、UL0、HM0、VM0、Ly0、V0,与大小无关;(2)长径≤2 cm,未分化型为主,pT1a、UL0、HM0、VM0、Ly0、V0;或(3)长径≤3 cm,分化型为主,pT1a、UL1、HM0、VM0、Ly0、V0。然而,具有未分化成分的分化型癌病例仍缺乏证据。上述类型(1)病变中含有未分化成分的长径>2 cm时定义为eCuraC-2(见图2中的测量方法)。
4.2 内镜可治愈性B级(eCuraB)虽然尚未获得足够的长期结果,可治愈性是可以期待的。当病灶整块切除时,直径≤3 cm,主要是分化型,且满足以下标准:pT1b1(SM1)(距黏膜肌层<500 μm)、HM0、VM0、Ly0和V0,即为eCuraB。但是,如果病变的黏膜下浸润部分存在未分化成分,则认为病变为eCuraC-2。
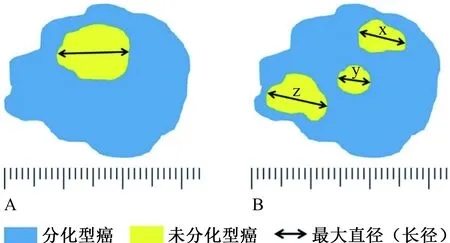
注:A:重建未分化型癌的区域,并测量该区域的长径;B:如果在多个区域存在未分化型癌,测量所有这些区域的长径(x,y,z),并记录这些值的总和。
4.3 内镜可治愈性C级(eCuraC)这一可治愈性水平与早期胃癌的ESD和EMR指南(第1版)中描述的非治愈性切除概念相一致。当病变不符合上述eCura A和eCura B条件时,则认为是eCuraC,有肿瘤残余的可能。当eCuraC病变为分化型病变并符合eCuraA或eCuraB的其他标准,但未整块切除或水平切缘阳性时,则认为是eCuraC-1。所有其他eCuraC病变都认为是eCuraC-2。
eCuraC-1病灶的转移风险较低。除手术切除外,在患者知情同意的情况下,根据治疗机构的政策,重复ESD、热透疗法和随访也是可能的选择。但是,一般情况下,开放或腹腔镜手术切除的情况如下:(1)长径≤3 cm,分化型为主,pT1a、UL1;或(2)长径≤3 cm,分化型为主和pT1b1(SM1)病变,如果内镜下确定的残余病变与切除标本中病变的整体大小>3 cm,或病变的黏膜下浸润部分是分片切除或切缘阳性(见图3~4)。
考虑到eCuraC-2有转移和复发的风险(证据:极低,推荐:强),一般应采取开放或腹腔镜手术切除。通过对1 101例胃黏膜剥离术后开放或腹腔镜手术切除的病例分析,我们发现可以通过评分系统对淋巴结转移的风险进行分层。即是病灶长径>3 cm,垂直切缘阳性,静脉浸润阳性,pT1b2(SM2)或更深各加1分,淋巴浸润阳性各加3分。
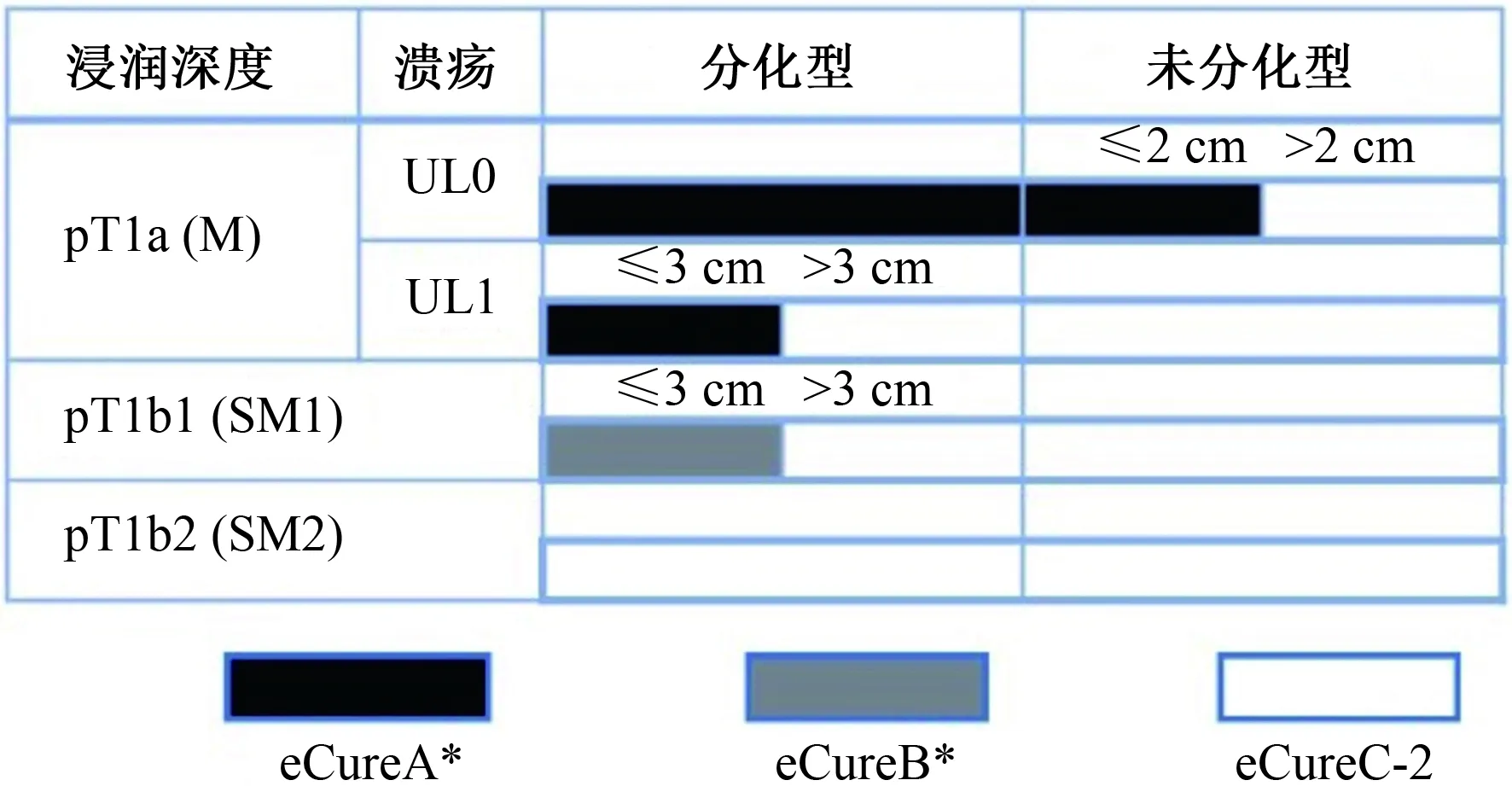
注:*:仅限于整块切除和HM0、VM0、Ly0、V0。pT1a(M):黏膜内癌(组织病理学诊断),pT1b(SM):黏膜下浸润性癌(组织病理学诊断)发现溃疡(或溃疡瘢痕),UL0:无溃疡和溃疡瘢痕,UL1:有溃疡或溃疡疤痕。
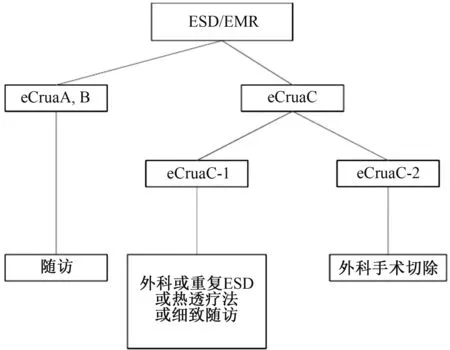
图4 ESD或EMR术后治疗流程图
5 并发症
主要的并发症是出血和穿孔。一项覆盖约1万例病例的多中心前瞻性研究发现,并发症为术后出血(4.4%)、输血(0.7%)、术中穿孔(2.3%)、迟发性穿孔(0.4%)和紧急外科手术并发症(0.2%)。其他值得注意的并发症包括狭窄、肺炎和空气栓塞,尽管它们的发生率很低。在对胃癌进行ESD或EMR时,应时刻注意并发症的风险。
5.1 术中出血的管理在ESD和EMR操作过程中出血几乎是不可避免的,术中出血的正确处理对ESD和EMR的安全进行至关重要。特别是在ESD操作中,使用止血钳电凝出血的血管,不影响后续切除,是首选技术。根据具体情况,也可以使用夹子和注射。
5.2 术后出血的预防对术后溃疡表面可见的残余血管应采取适当的预防措施(证据:极低,推荐:强)。在ESD或EMR后需要使用胃酸分泌抑制剂(证据:中,推荐:强)。
从预防术后出血的角度看,ESD或EMR术后复查内镜是不必要的(证据:中,推荐:强)。
5.3 穿孔的管理当ESD或EMR发生穿孔时,应首先考虑内镜下闭合(证据:中,推荐:强)。
6 术后长期随访
6.1 治疗后随访如可治愈性评估部分所述,ESD或EMR术后可治愈性的评估是通过对被切除标本进行组织学检查,并在此基础上决定后续的治疗。ESD或EMR术后存在发生异时性胃癌的风险。即使组织学检查显示内镜下eCuraA,食管胃十二指肠镜检查的主要目的仍应是发现异时性胃癌(证据:中,推荐:强)。JGCA日本胃癌治疗指南第5版建议在eCuraA切除术后,每年进行1次或2次食管胃十二指肠镜检查。
当组织学检查提示内镜eCuraB切除时,食管胃十二指肠镜的随访,以及超声或计算机断层扫描(CT)检查监测转移是可行的(证据:极低,推荐:弱)。
水平切缘阳性或分片切除可导致局部复发。特别是当阳性水平切缘≥6 mm,肿瘤长径≥2 cm时,局部复发的风险较高。当组织学检查提示内镜eCuraC-1而不要求追加外科手术,选择观察而不进一步治疗作为后续管理时,应行食管胃十二指肠镜检查仔细随访(证据:极低,推荐:弱)。
6.2 幽门螺杆菌的根除幽门螺杆菌根除可显著降低早期胃癌内镜治疗术后患者异时性胃癌的发病率。因此,建议对幽门螺杆菌阳性患者进行根除治疗(证据:高,推荐:弱)。
7 组织学
切除标本的处理和组织学表现的记录按照日本胃癌分类(第3版英文版)(推荐:强)。
7.1 处理切除的标本(1)将新鲜标本展平并固定在一个平板上,将新鲜标本展平,黏膜面朝上,固定在平板(泡沫聚苯乙烯、橡胶板或软木板)上,用固定钉固定,以获得与内镜观察一致的肿瘤大小(见图5)。(2)在甲醛溶液中固定,新鲜标本固定的区域应迅速浸入10%中性缓冲甲醛溶液中,在室温下固定24~48 h。(3)固定标本的切片,以病灶边缘与标本外侧边缘之间的最小距离进行第一个切口,以对病灶部分进行组织病理学检查。随后的切口与第一个切口平行,间隔2.0~3.0 mm(推荐:强)(见图6A~6B)。(4)拍照,为了复原肿瘤的浸润范围和深度以及含有混合未分化成分的部分,需要对固定标本和切口进行宏观的拍照(见图6C)。拍照时,应将有明显标记的标尺放在标本旁边。切开后的照片用于肿瘤展平后的复原。
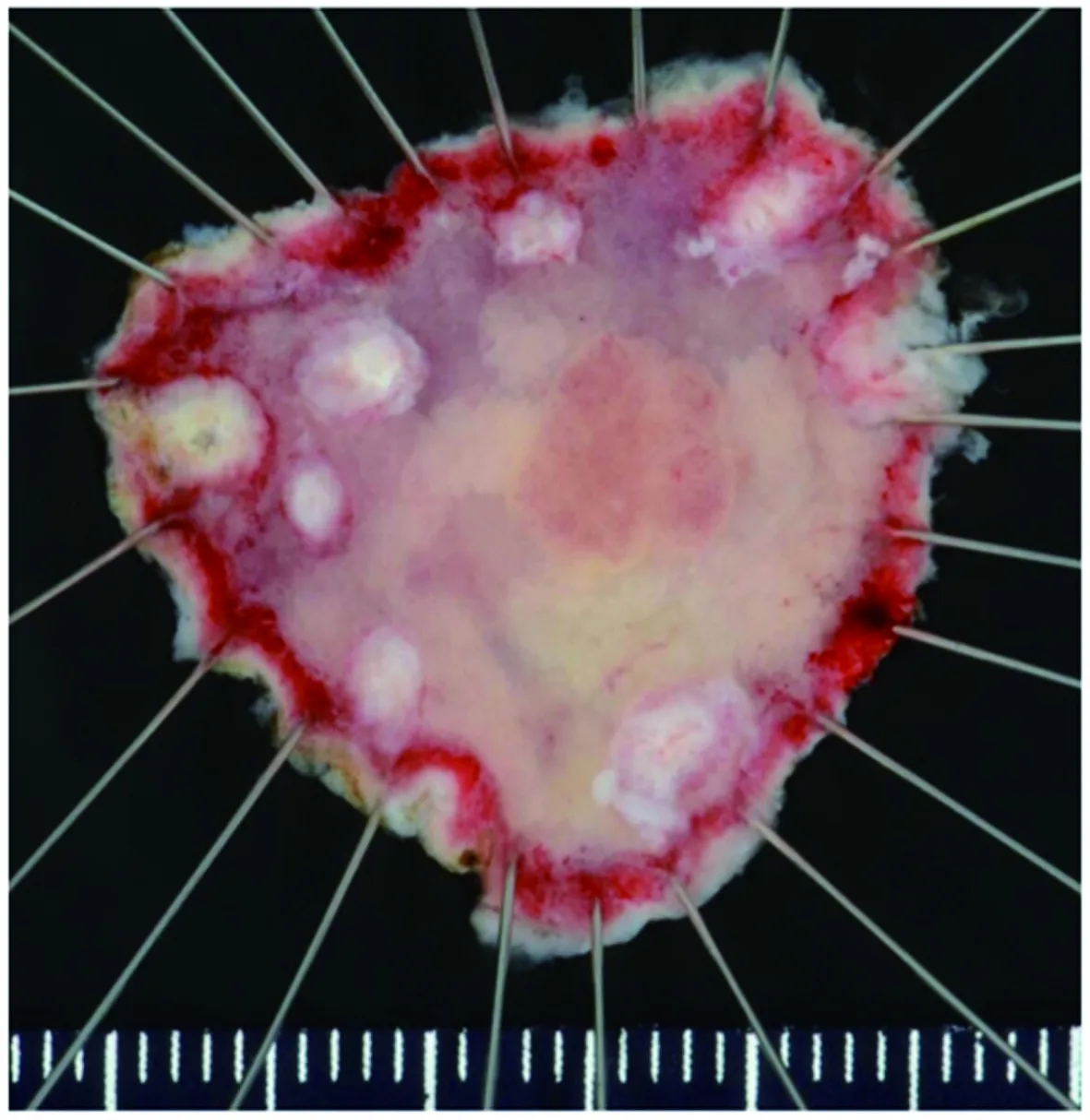
图5 展平标本
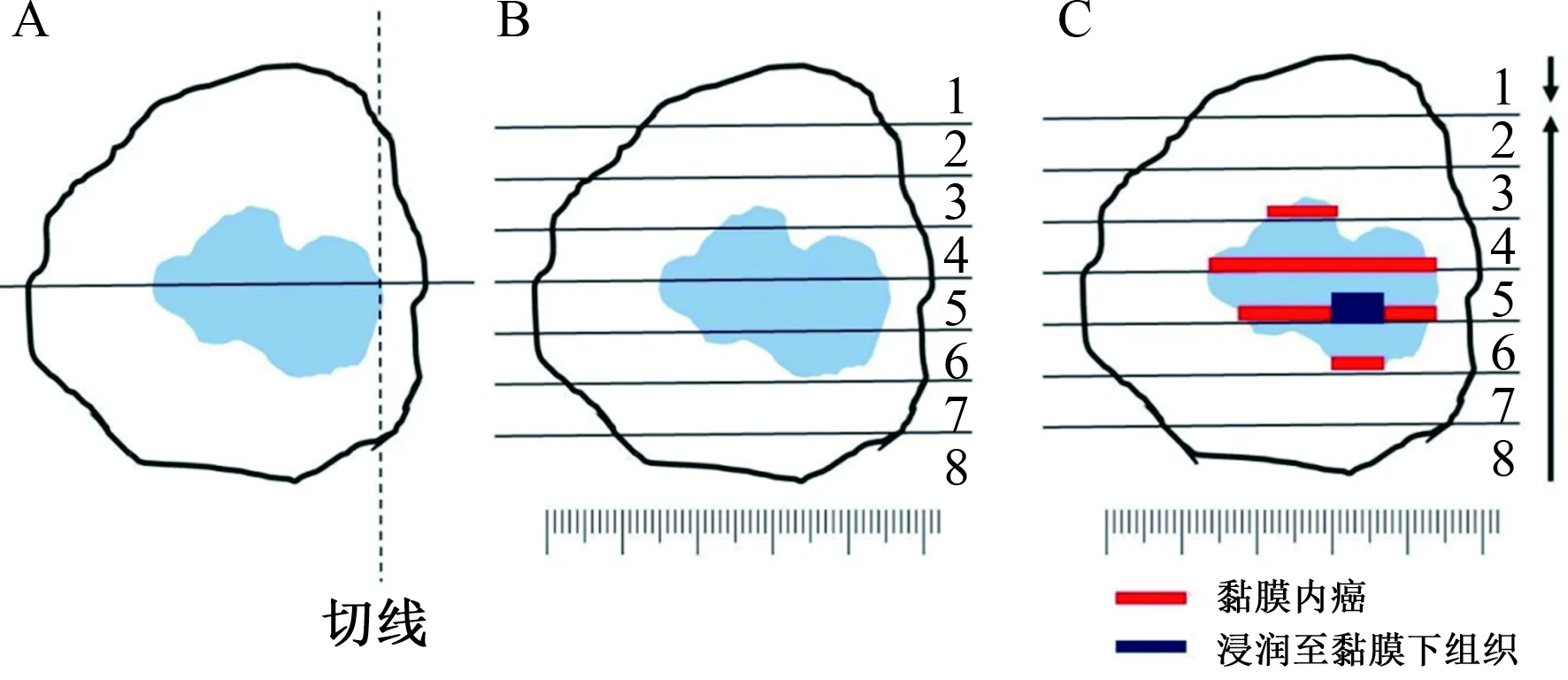
图6 固定标本的切片及肿瘤的复原(示例)
7.2 组织病理学检查记录组织病理学报告中需要记录的项目包括肿瘤位置、肉眼类型、大小、组织学类型、未分化型癌的分布、浸润深度、病变内有无溃疡、有无脉管的浸润和切缘的评估。
7.2.1 肿瘤部位和肉眼类型:参照日本胃癌分类(英文版第3版)。
7.2.2 肿瘤大小:对应于“复原图上肿瘤的最大直径(长径)和与长径垂直的短直径”。
7.2.3 肿瘤组织病理类型:根据日本胃癌分类(第3版)进行分类。当肿瘤病灶内存在多种组织病理类型时,应记录每种组织病理类型,按病灶内相对表面积由大到小依次记录(如tub1>pap>por)(推荐:强)。在这些指南中,高分化或中分化管状腺癌、乳头状腺癌被归类为分化型癌,而低分化腺癌、印戒细胞癌、黏液腺癌分类为未分化型癌。
7.2.4 组织学类型的异质性:当分化型癌与未分化型癌在各自局限的区域内共同存在时,还应复原未分化型癌的范围,测量并记录该区域的长径(见图2A)。如果未分化型癌存在于肿瘤病灶内多个区域,则应测量每个区域的长径,并记录其值之和(见图2B)。然而,如果未分化型癌的面积太小,在复原图像上无法测量其长径,则应详细说明。分化型癌和未分化型癌可以不同程度的混合,也可以是分化型癌以表面层为主,深部由未分化型癌组成。在这种情况下,整个病变区域被认为是一个未分化型癌,并测量和记录其长径。
7.2.5 测量浸润深度:在本指南中,Tis记录为pT1a(M)。当在肿瘤病灶连续浸润的组织最深处发现有脉管浸润时,以脉管浸润的浸润层为浸润深度。
对于浸润黏膜下层的肿瘤,应测量从黏膜肌层下缘到浸润肿瘤最深部分的距离(以μm为单位)。如果测量深度<500 μm,则对病变进行评估并记录为pT1b1(SM1)。若测量深度≥500 μm,病变分为pT1b2(SM2)。
如果黏膜肌层因肿瘤浸润而断裂或消失,则应测量最浅层至最深部分的距离。即使由于病变内的溃疡瘢痕而无法识别黏膜肌层,但只要肿瘤定位于覆盖溃疡瘢痕的再生黏膜内,且无明显的黏膜下浸润,病变也可归类为pT1a(M)。另一方面,如果癌细胞浸润黏膜下组织溃疡疤痕,画出与相邻黏膜完整的黏膜肌层连续的虚线,从该线到垂直浸润深度的距离用于确定病变是pT1b1(SM1)还是pT1b2(SM2)。
7.2.6 评估病变内的溃疡或溃疡瘢痕:在病变内发现溃疡或溃疡瘢痕,病变被划分为pUL1,而当无溃疡和溃疡瘢痕时被划分为pUL0。活检产生的疤痕可以被识别为局限在黏膜肌层下的一小块区域内的纤维化病灶。
7.2.7 脉管浸润评估:内镜切除标本的组织病理学检查确定是否有脉管浸润,这是评估追加手术切除必要性的标准。因此,评估脉管浸润应采用特定的染色策略(推荐:弱)。即使是黏膜内癌的情况下,如果怀疑有脉管浸润,最好进行这些特殊染色(特别是当同时存在未分化型癌时)。淋巴浸润阳性记录为Ly1,阴性记录为Ly0,静脉浸润阳性记录为V1,阴性记录为V0。
7.2.8 评估切缘:手术缘分为水平切缘(HM)和垂直切缘(VM)。如果切除边缘有肿瘤组织,阳性HM和VM分别记录为pHM1和pVM1。如无肿瘤组织,则分别记录为pHM0和pVM0。如果不能评估切除边缘肿瘤组织暴露情况,则分别记录为pHMX和pVMX。
本文译自Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition) [J]. Dig Endosc, 2021, 33(1): 4-20. DOI: 10.1111/den.13883.
