胰高血糖素样肽-1蛋白对帕金森病氧化应激损伤的保护作用及机制研究
2021-04-21弥婉军王晓娟
弥婉军,王晓娟
(1.渭南市中心医院神经内科,陕西 渭南 714000;2.宝鸡市中医医院脑病二科,陕西 宝鸡 721000)
帕金森病是临床上常见的神经中枢神经系统变性疾病,好发于中老年人[1]。该病在临床上主要表现为姿势步态障碍、肢体僵直、静止性震颤、运动迟缓,病理特征为中脑黑质致密部多巴胺能神经元的缺失,可导致纹状体多巴胺含量减少[2]。帕金森病的发病机制还不明确,但2型糖尿病与帕金森病互为发病的风险因子,各自发病存在共同的病理变化[3-4]。肠促胰岛素是可以使胰岛素增敏的生长因子家族,其中胰高血糖素样肽-1(Glucagon-like peptide 1,GLP-1)可通过增敏脑内的胰岛素信号受体实现神经保护作用,其也可产生神经营养作用,促进神经细胞保护、增殖,并且有利于前体细胞向神经元分化[5]。有研究显示GLP-1蛋白经腹腔给药后可穿过血脑屏障进入脑组织,在神经元表面与相应受体结合后,可激活下游信号的表达,从而诱导神经元分化与促进神经元突触生长[6]。Chi3l1基因在大肠、子宫、软骨、脑组织、骨骼中都有广泛表达,也为一种防御病原体结构中的几丁质[7]。现代研究表明Chi3l1具有双重作用[8],可在各种微生物引起的免疫应答中发挥重要作用。本文具体探讨了GLP-1蛋白对帕金森病小鼠氧化应激损伤的保护作用及机制,现总结报告如下。
1 材料与方法
1.1 实验材料 36只8 周龄C57BL/6 雄性小鼠(15~20 g)购自北京维通利华实验动物技术有限公司,饲养环境:12 h昼夜循环光照,清洁动物房环境安静、温度恒定(22±3)℃、湿度适宜(50%~55%),自由饮食与饮水,每5 只小鼠居于1个笼内。为使小鼠适应环境,每只小鼠实验前均有1周适应期。动物实验得到了本院动物伦理委员会的批准,并严格按照动物伦理学要求进行操作。GLP-1/GIP双受体激动剂(DA3-CH)购自美国BD公司,1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)购自武汉博士德公司,一抗与二抗购自武汉三鹰公司,Chi3l1酶联免疫检测试剂盒购自上海生工公司,利拉鲁肽购自国药集团。
1.2 动物分组 将所有小鼠随机平分为三组:模型组、利拉鲁肽组与GLP-1组。所有小鼠都给予建立帕金森病模型,通过腹腔给药将20 mg/kg的MPTP 溶液注入小鼠体内。30 min后模型组在建模过程中给予0.1 ml 0.9%氯化钠溶液注射,连续7 d。利拉鲁肽组在建模过程中给予利拉鲁肽腹腔注射25 nmol/(kg·d),连续7 d。GLP-1组在建模过程中给予DA3-CH 腹腔注射25 nmol/(kg·d),连续7 d。
1.3 观察指标 ①在建模第1天与第7天进行转棒实验,测定小鼠的运动平衡能力,将小鼠放置于运转时间为180 s、转速20 r/min的滚轮上,记录从转轴开始转动到小鼠掉落所持续的时间。②在建模第1天与第7天进行牵拉实验,将小鼠双前肢置于水平细绳上,可评定小鼠的四肢肌力。3分:四肢全都能够抓紧细绳;2分:只有一个后肢可以抓紧细绳;1分:没有后肢可以抓紧细绳;0分:无法抓紧细绳而掉落。③在建模后第7天处死小鼠,取眼球血1 ml左右,静置30 min后4℃ 3000 r/min离心10 min,分离上层血清,采用酶联免疫法检测血清Chi3l1含量。④取处死大鼠的脑组织,称重后进行裂解,置于组织研磨器内,进行充分研磨,12000 r/min离心10 min,取上清,进行SDS-PAGE电泳,转膜后在室温下封闭2 h,在4 ℃温育过夜的一抗(抗IBA-1抗体、抗GFAP抗体,1∶1000;抗β-actin抗体,1∶2000),洗涤后进行二抗(1∶5000)室温孵育1 h,洗涤后用Molecular Imager 显现印迹,记录目的蛋白相对表达水平。

2 结 果
2.1 三组建模不同时间点转棒实验结果对比 三组建模第7天的转棒停留时间都低于建模第1天(P<0.05),利拉鲁肽组与GLP-1组高于模型组(P<0.05),GLP-1组高于利拉鲁肽组(P<0.05)。见表1。

表1 三组建模不同时间点转棒实验结果对比(s)
2.2 三组建模不同时间点牵拉实验结果对比 三组建模第7天的转棒停留时间牵拉肌张力评分都低于建模第1天(P<0.05),利拉鲁肽组与GLP-1组高于模型组(P<0.05),GLP-1组高于利拉鲁肽组(P<0.05)。见表2。

表2 三组建模不同时间点牵拉实验结果对比(分)
2.3 三组建模第7天血清Chi3l1含量对比 利拉鲁肽组与GLP-1组建模第7天的血清Chi3l1含量低于模型组(P<0.05),GLP-1组低于利拉鲁肽组(P<0.05)。见表3。

表3 三组建模第7天血清Chi3l1含量对比(pg/ml)
2.4 三组建模第7天脑组织IBA-1、GFAP蛋白相对表达水平对比 利拉鲁肽组与GLP-1组建模第7天的脑组织IBA-1、GFAP蛋白相对表达水平低于模型组(P<0.05),GLP-1组低于利拉鲁肽组(P<0.05)。见表4。
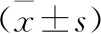
表4 三组建模第7天脑组织IBA-1、GFAP蛋白相对表达水平对比
3 讨 论
帕金森病为临床上的神经退行性疾病之一,以黑质多巴胺能神经元变性缺失和路易小体形成为病理特征,在临床上主要表现为姿势平衡障碍、肌强直、运动迟缓等运动症状[9]。同时很多患者伴随有抑郁、认知功能障碍、睡眠障碍等非运动症状,从而严重影响患者的身心健康[10]。MPTP是一种亲脂性化合物,可以穿过血脑屏障;腹腔内注射MPTP可建立帕金森病小鼠模型,也是基础研究中广泛应用的小鼠模型。GLP-1是由小肠L细胞分泌的一种多肽激素,可以高效地通过血-脑屏障,可通过多环节机制发挥降糖作用,从而具有一定的神经保护作用[11-12]。本研究显示三组建模第7天的转棒停留时间、牵拉肌张力评分都低于建模第1天(P<0.05),利拉鲁肽组与GLP-1组高于模型组(P<0.05),GLP-1组高于利拉鲁肽组(P<0.05)。从机制上分析,DA3-CH是GLP-1/GIP 双受体激动剂的一种,可介导神经细胞的增殖,能促进小鼠齿状回神经母细胞分化和神经再生[13]。有研究给予野生型Sprague-Dawley大鼠GLP-1类似物,发现其可改善大鼠的Morris水迷宫实验行为能力,但此现象可以被GLP-1拮抗剂逆转[14]。
Chi3l1基因位于染色体1q32.1上一个高度保守的区域,含有10个外显子,与IL-6受体基因(1q21),与CRP基因(1q21-1q23)位于1号染色体的同一臂上。Chi3l1基因启动子序列包括多种调节因子的结合位点,但是也具有多个突变位点。已有研究显示Chi3l1基因启动子区域的三个单核苷酸多态性与机体的氧化应激水平相关,基因突变位点发生变化时,可增强Chi3l1基因与CCATT 序列增强子结合蛋白的结合力,而后者具有转录活化作用,从而调节下游基因的表达[15]。本研究显示利拉鲁肽组与GLP-1组建模第7天的血清Chi3l1含量低于模型组(P<0.05),GLP-1组低于利拉鲁肽组(P<0.05)。从机制上分析,帕金森病能够造成小鼠氧化应激损伤,GLP-1蛋白治疗能够抑制Chi3l1的释放,从而具有预防氧化应激损伤的作用[16]。当前有研究也显示DA3-CH可呈剂量依赖性保护神经细胞过氧化氢介导的细胞凋亡,减少自由基的释放[17]。
IBA-1 特异性表达于小胶质细胞,其也属于一种钙结合蛋白,是小胶质细胞的标记蛋白。GFAP 参与细胞骨架构成,其作为一种中间丝状蛋白,要存在于星型胶质细胞胞浆内[18]。帕金森病可导致小鼠运动障碍,导致IBA-1 与BDNF 的广泛释放,也使得胶质细胞及星型胶质细胞增殖程度降低,可激活神经炎症反应[19-20]。本研究显示利拉鲁肽组与GLP-1组建模第7天的脑组织IBA-1、GFAP蛋白相对表达水平低于模型组(P<0.05),GLP-1组低于利拉鲁肽组(P<0.05)。从机制上分析,DA3-CH能神经元的损伤程度降低,间接减少小胶质细胞及星型胶质细胞增殖,从而抑制IBA-1、GFAP蛋白的表达。本研究也存在一定不足,没有进行细胞学研究,也没有进行剂量学分析,将在后续研究中进行探讨。
总之,GLP-1蛋白在帕金森病小鼠的应用能缓解氧化应激损伤,抑制血清Chi3l1与脑组织IBA-1、GFAP蛋白的表达,从而发挥神经保护作用。
