魔芋多糖膳食纤维特性及其对糖代谢作用研究
2021-04-20张乐乐陈江湖
张乐乐, 张 雯, 陈 合, 陈江湖
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
糖尿病(diabetes mellitus,DM)是一组以血糖水平持续升高为特征的慢性代谢紊乱性疾病,常见为2型糖尿病[1].2型糖尿病的发病原因包括β细胞功能受损和胰岛素抵抗,最终导致高血糖等症状[2,3].因此,降血糖成为干预和治疗2型糖尿病的主要医学手段[1,4,5].研究表明膳食纤维对降血糖,预防2型糖尿病有积极作用[6].S.Ou等[6]研究了水溶性和水不溶性膳食纤维对葡萄的吸附、扩散和对淀粉水解的抑制作用,认为膳食纤维可以降低血糖,并提出了膳食纤维的体外降糖机理.
魔芋是天南星科魔芋属植物的泛称,种类繁多[7].魔芋块茎中不仅含有丰富的魔芋葡甘聚糖(konjac glucomannan,KGM),其含量高达50%,还含有少量的淀粉、蛋白质及纤维素等[8]营养物质.KGM是一种从魔芋的块茎中提取的天然大分子杂多糖,具有诸多有利于抑制机体血糖升高的理化特性,如持水性、增稠性、流变性、乳化性、凝胶性和成膜性等[9].李宁等[10]研究了复合膳食纤维如魔芋膳食纤维、玉米膳食纤维等对非糖尿病者的血糖影响,结果显示健康受试者在复合膳食纤维作用下,餐后血糖峰值降低且血糖变化更加平缓.向明等[11]通过实验发现KGM预防给药可以防止链脲霉素诱导的大鼠糖尿病发生;V.Vuksan等[12]研究了KGM和西洋参联合治疗Ⅱ型糖尿病的效果,结果发现KGM可以增加胰岛素敏感性,西洋参增加胰岛素分泌,两者互补,具有治疗Ⅱ型糖尿病的潜力,可以作为糖尿病患者新的膳食选择;R.D.Deuaraj等[13]证实KGM不仅可以降低糖尿病患者的血糖,还可以降低非糖尿病患者的血糖.刘红[14]通过建立糖尿病小鼠模型,研究了KGM对糖尿病小鼠血糖的影响,结果证明KGM有明显降低糖尿病小鼠血糖的作用,并能减少糖尿病小鼠饮水量.
本文基于魔芋多糖的膳食纤维特性,研究魔芋多糖的理化性质及其对糖代谢影响作用机制.模拟体外肠道环境研究魔芋多糖对葡萄糖扩散的影响,建立葡萄糖在魔芋多糖体系中的扩散动力学模型,阐明魔芋多糖对机体糖代谢的影响作用机制,探索魔芋多糖降糖机理,为Ⅱ型糖尿病的预防、改善和膳食支持提供新的思路和理论依据.
1 材料与方法
1.1 实验材料
魔芋纤维粉,湖北一致魔芋生物有限公司;乙二胺四乙酸二钠,天津市天力化学试剂有限公司;α-淀粉酶(3 700 U/g),可溶性淀粉,阿卡波糖(Acarbose),大连美仑生物技术有限公司;葡萄糖测定试剂盒(葡萄糖氧化酶法),上海荣盛生物药业有限公司.
1.2 实验仪器
UV-5100紫外分光光度,上海元析仪器有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;HWS-12电热恒温水浴锅,上海一恒科学仪器有限公司;HAAKE MARS 60动态流变仪,德国Thermo Scientific公司;Varioskan flash全波长扫描式多功能读数仪,赛默飞世尔科技有限公司(芬兰).
1.3 实验方法
1.3.1 增稠性和流变性
参照文献[15]的方法并适当改进,用50 mL去离子水将一定质量的KGM溶解,搅拌均匀,配制浓度为1%、2%、4%和6%的KGM溶液.采用动态流变仪测量KGM的增稠特性与剪切流变性质.吸取一定量的KGM溶液与锥板中,设置频率1 Hz.设置温度为25 ℃,剪切速率为100 s-1,测量各浓度KGM溶液的粘度,收集KGM溶液表观粘度随浓度变化数据;设置温度为25 ℃,剪切速率为0.01~200 s-1,收集KGM溶液粘度与剪切应力随剪切速率变化数据.
1.3.2 溶胀性
参照文献[16]的方法并适当改进.称取0.100 g样品(m0)于10 mL离心管中,加入10 mL去离子水,样品放在37 ℃的恒温环境中,每隔一段时间将样品取出,离心、倒掉上清液,称重(m1).离心条件:4 000 r/min,10 min,平行三次实验.
(1)
式(1)中:SD-KGM的溶胀率(%);m0-样品吸水前重量(g);m1-样品吸水后重量(g).
1.3.3 KGM对葡萄糖的扩散行为研究
参照文献[4]的方法,分别在水分散液和人工肠液分散液中研究KGM对葡萄糖扩散的影响.
(1) KGM水分散液对葡萄糖扩散的影响
量取50 mL,100 mmol/L葡萄糖溶液置于四个烧杯中,分别加入2 mg/mL、4 mg/mL、6 mg/mL KGM,制成混悬液,装入透析袋中,以500 mL水溶液作为扩散体系,并加入转子控制一定的转速,室温条件下进行扩散,以未加KGM为对照组.扩散过程中,分别于5 min、10 min、20 min、30 min、50 min、70 min、90 min、120 min、150 min、180 min、240 min、300 min、360 min、480 min、600 min、780 min等时间取样测定透析液中葡萄糖浓度,计算不同质量分数KGM水分散液中葡萄糖扩散率Qt,以扩散时间t为横坐标,以葡萄糖扩散率Qt为纵坐标,绘制不同质量分数KGM水分散液中葡萄糖扩散曲线(Qt-t)及葡萄糖扩散速率曲线((dQt/dt)-t).
(2)
式(2)中:Qt-t时间不同质量分数KGM分散液中葡萄扩散率(%);Ct-扩散t时间透析液(水)中的葡萄浓度(mmol/L);C1-扩散前透析袋中葡萄糖溶液浓度(mmol/L);V1-扩散前透析袋中葡萄糖溶液的体积(mL);V2-透析液(水)的体积(mL).
(3)
式(3)中: dQt/dt-不同质量分数KGM中葡萄糖扩散速率(%/min);t-扩散时间(min).
(2) KGM肠液分散液对葡萄糖扩散的影响
用人工肠液配制100 mmol/L 葡萄糖溶液50 mL置于四个烧杯中,分别加入2 mg/mL、4 mg/mL、6 mg/mL KGM制成混悬液,分别装入透析袋中,以500 mL 人工肠液作为扩散体系,并加入转子控制一定的转速,室温条件下扩散,以未加KGM为对照组.扩散过程中,分别于5 min、10 min、20 min、30 min、50 min、70 min、90 min、120 min、150 min、180 min、240 min、300 min、360 min、480 min、600 min、780 min等时间取样测定透析液中葡萄糖浓度,计算不同质量分数KGM肠液分散液中葡萄糖扩散率Qt,以吸附时间t为横坐标,以KGM肠液分散液中葡萄糖扩散率Qt为纵坐标,绘制葡萄糖扩散曲线(Qt-t)及葡萄糖扩散速率曲线((dQt/dt)-t).
(4)
式(4)中:Qt-t时间不同质量分数KGM分散液中葡萄扩散率(%);Ct-扩散t时间透析液(人工肠液)中的葡萄浓度(mmol/L);C1-扩散前透析袋中葡萄糖溶液浓度(mmol/L);V1-扩散前透析袋中葡萄糖溶液的体积(mL);V2-透析液(人工肠液)的体积(mL).
(5)
式(5)中:dQt/dt-不同质量分数KGM中葡萄糖扩散速率(%/min);t-扩散时间(min).
1.3.4 葡萄糖的扩散动力学拟合
根据上述扩散曲线,分别按照零级释放模型Qt=K0t+b0,一级释放动力学Qt=K1·eαt+b1,Higuchi模型Qt=KH·t1/2+bH及Korsmeyer-Peppas模型Qt=K·tn对其进行拟合[17],研究葡萄糖在KGM水分散液和肠液分散液中的扩散行为,建立扩散动力学模型.
1.3.5 KGM对α-淀粉酶的抑制作用
参照GB/T 24401-2009[18]测定方法,将质量分数分别为8 mg/mL、10 mg/mL、12 mg/mL、14 mg/mL、16 mg/mL、18 mg/mL的KGM加入20 mL,20.0 mg/mL的淀粉溶液中,搅拌制成KGM淀粉溶液.分别加入pH6.0的磷酸缓冲液5 mL,60 ℃水浴条件下预热8 min.预热完成后立即加入0.1 mg/mL的α-淀粉酶溶液1 mL,摇匀,准确反应5 min.反应结束后立即吸取1 mL反应液,加入预先盛有0.5 mL,0.1 mol/L盐酸溶液和5 mL,0.70 mmol/L稀碘液的试管中,摇匀.观察并记录溶液颜色反应.随后在全波长扫描式多功能读数仪中660 nm波长下测定吸光值,由吸光值查找对应的α-淀粉酶活力,计算KGM对α-淀粉酶的抑制率,绘制KGM对α-淀粉酶的抑制率曲线并根据拟合方程计算IC50值.用相同的方法以阿卡波糖进行实验,作为阳性对照,阿卡波糖浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL,以去离子水代替KGM做空白对照.

(6)
式(6)中:c1-未加抑制剂时,α-淀粉酶活力(u/mL);c2-加入抑制剂后,α-淀粉酶活力(u/mL).
1.3.6 KGM动态流变学研究
将KGM与50 mL去离子水搅拌溶解,制备成2.0 mg/mL、4.0 mg/mL、6.0 mg/mL的KGM溶液.参照文献[19]的方法,采用HAAKE MARS 60旋转流变仪平板测量系统(直径35 mm,间隙1 mm)测定KGM溶胶的动态流变学性质.吸取5 mL样品置于平板中.设置温度25 ℃,频率1 Hz,应变范围为0.001%~100%并以对数方式递增,确定KGM溶液的线性粘弹区,经实验确定应变为4%.固定温度为25 ℃,剪切速率0.01~80 s-1,采集不同质量分数KGM溶液的表观黏度变化数据.固定温度25 ℃,在应变4%的线性粘弹区范围内进行频率扫描,扫描频率为0.01~100 rad/s,测定KGM溶液的贮藏模量G′与损耗模量G″.
1.4 数据处理与分析
所有实验采取三次平行实验,结果以平均值±标准差的形式表现,利用Origin 8.0软件对数据进行分析和绘图.
2 结果与讨论
2.1 KGM的流变性
由图1可知,在高浓度条件下,随着剪切速率增加,粘度逐渐降低,最后慢慢变平缓,在相同剪切速率下,KGM浓度越高,粘度越大,其粘度下降越快,这种现象反映了KGM具有典型的假塑性流体特征.由图2知,剪切应力随着剪切速率的增加而增加,且KGM浓度越大,剪切应力越大,呈现出非线性变化趋势,该现象也说明了KGM具有典型的假塑性流体特征.
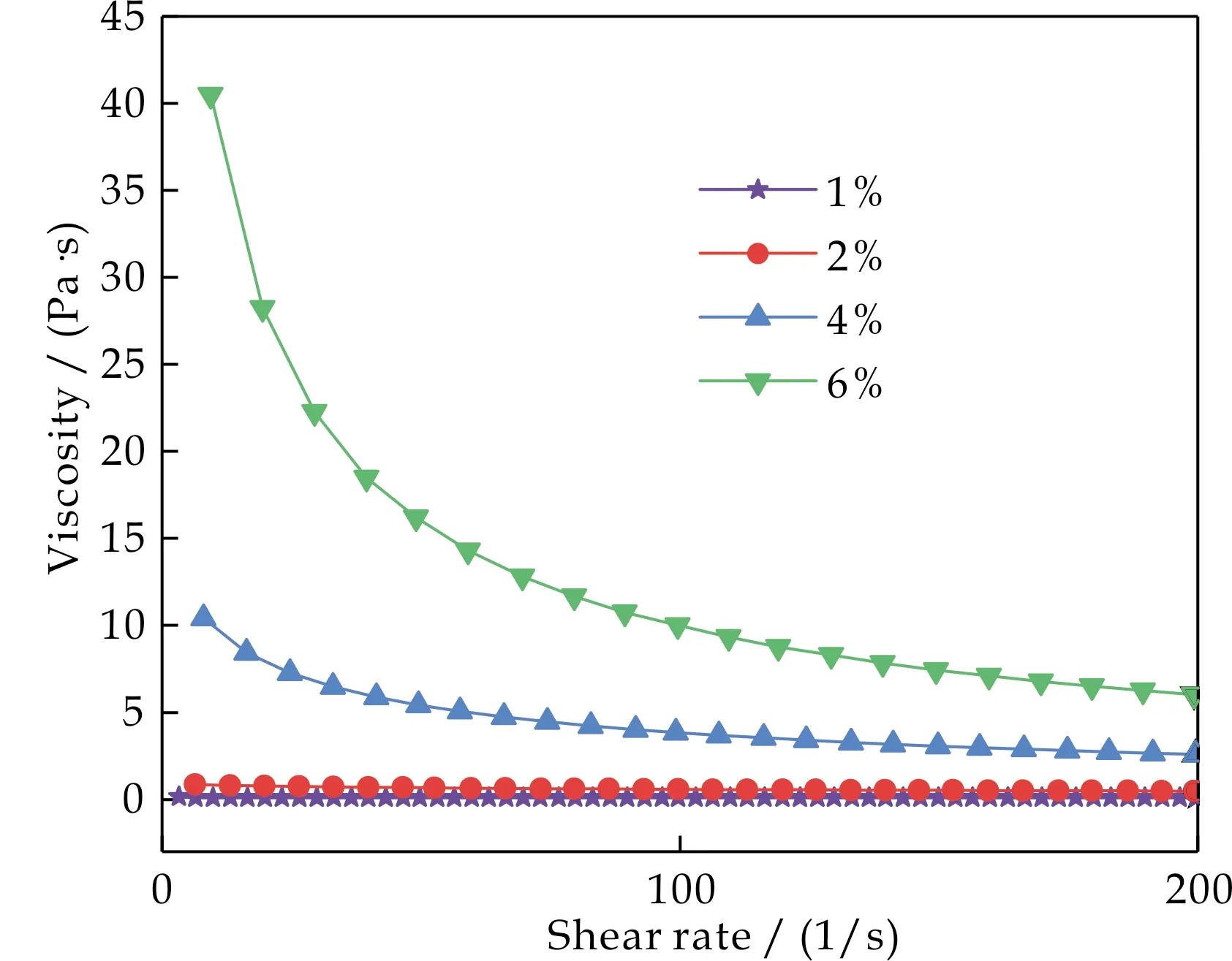
图1 剪切速率对不同浓度KGM溶胶 粘度的影响
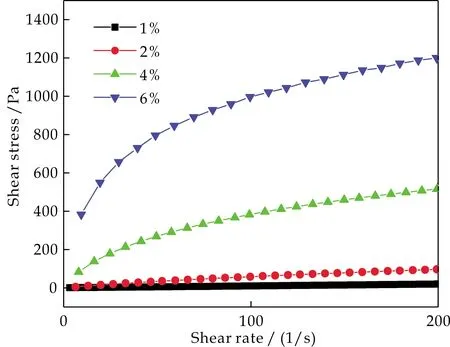
图2 不同浓度KGM溶胶流变曲线
可以发现,当KGM浓度越大,则KGM粘度度与剪切应力随剪切速率变化的关系越明显,此时KGM剪切稀化特性越显著,假塑性流体特征越明显.这是因为随着KGM浓度的增加,使溶液中KGM分子密度增加,溶液中会形成大量氢键.由于非化学键的键能小,在剪切外力的作用下,KGM分子链或分子链段沿剪切力的方向伸展,氢键会受到破坏,因而表现出剪切变稀的现象,KGM也就具有了假塑性流体特征.
2.2 增稠性
由图3可知,KGM的粘度随着浓度的增加而呈现出逐渐上升的趋势,且浓度越大,其粘度也就越大,该结果说明,KGM具有很好的增稠效果.这是由于KGM是一种非离子型水溶性高分子多糖,含有丰富的羟基(-OH),易溶于水,吸水后体积可膨胀80~100倍,以及电中性等特性决定了其具有良好的增稠性.

图3 KGM溶胶粘度随浓度的变化曲线
2.3 溶胀性
由图4可知,随着时间的延长,KGM的溶胀性能越好,溶胀体积也越大,因其良好的吸水性,使得KGM能够结合大量的水[20],吸水量可达其自身体积的40陪以上.这也使得KGM有了很好的延迟人体胃排空的作用,减少人体摄食量及摄食次数,从而抑制机体血糖水平升高.

图4 KGM溶胀曲线
2.4 KGM对葡萄糖扩散的影响
2.4.1 葡萄糖在KGM水分散液和肠液中的扩散
由图5和图6可知,一定质量分数的KGM有抑制葡萄糖扩散的作用,且KGM的浓度越大其抑制效果越好,这是因为KGM中富含大量氢键,使其极易与水分子结合,从而具有很强的亲水性和持水力[16].当人体食用了KGM后,与水充分结合后膨胀,形成粘度大、流动性差的胶状物质,从而可以增加食糜体系的体积,增加肠液的黏度,增大葡萄糖扩散阻力,同时氢键束缚葡萄糖分子,阻碍葡萄糖的扩散,从而减缓机体对葡萄糖的吸收,稳定餐后血糖.
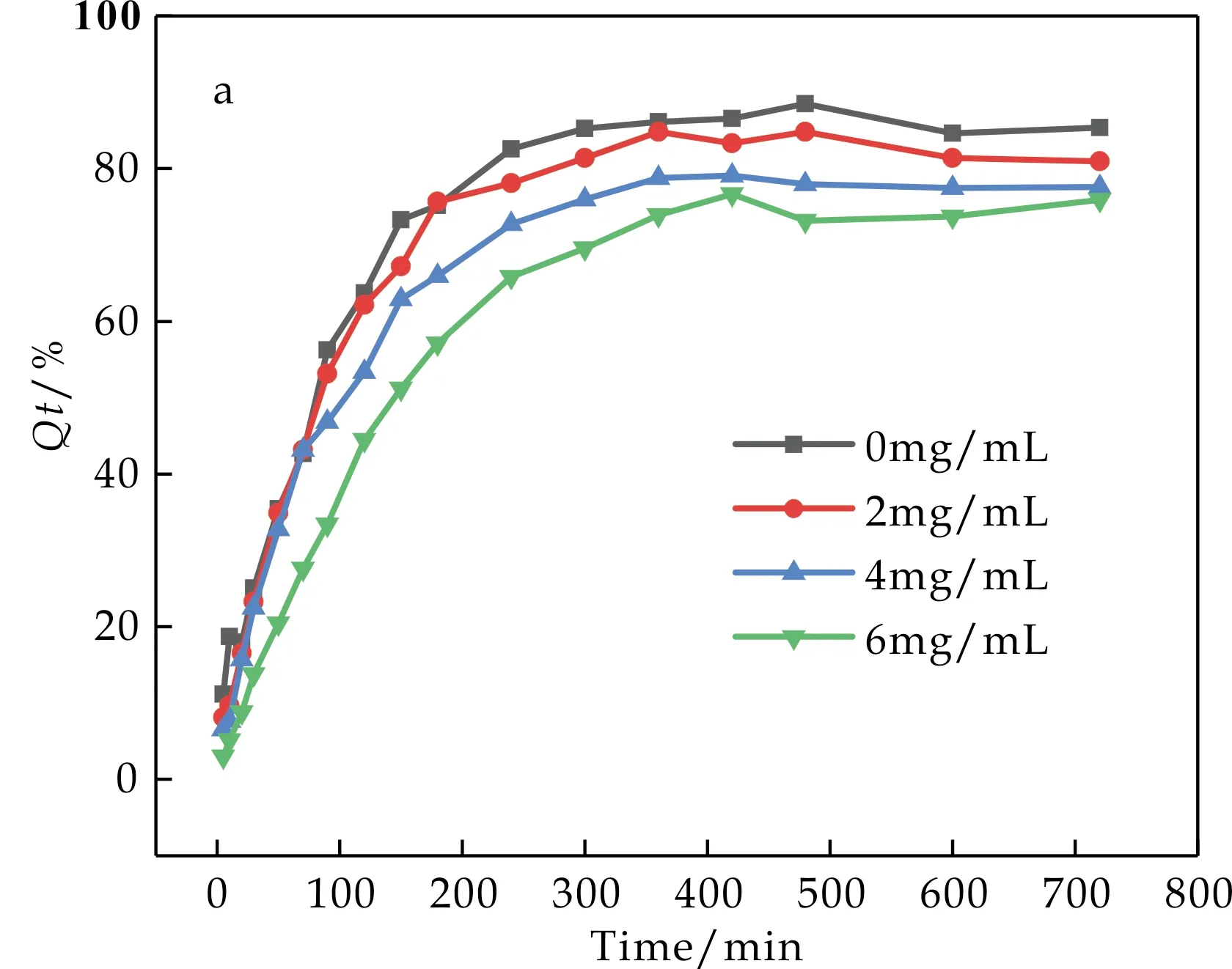
(a)葡萄糖在KGM水分散液中的扩散曲线Qt-t
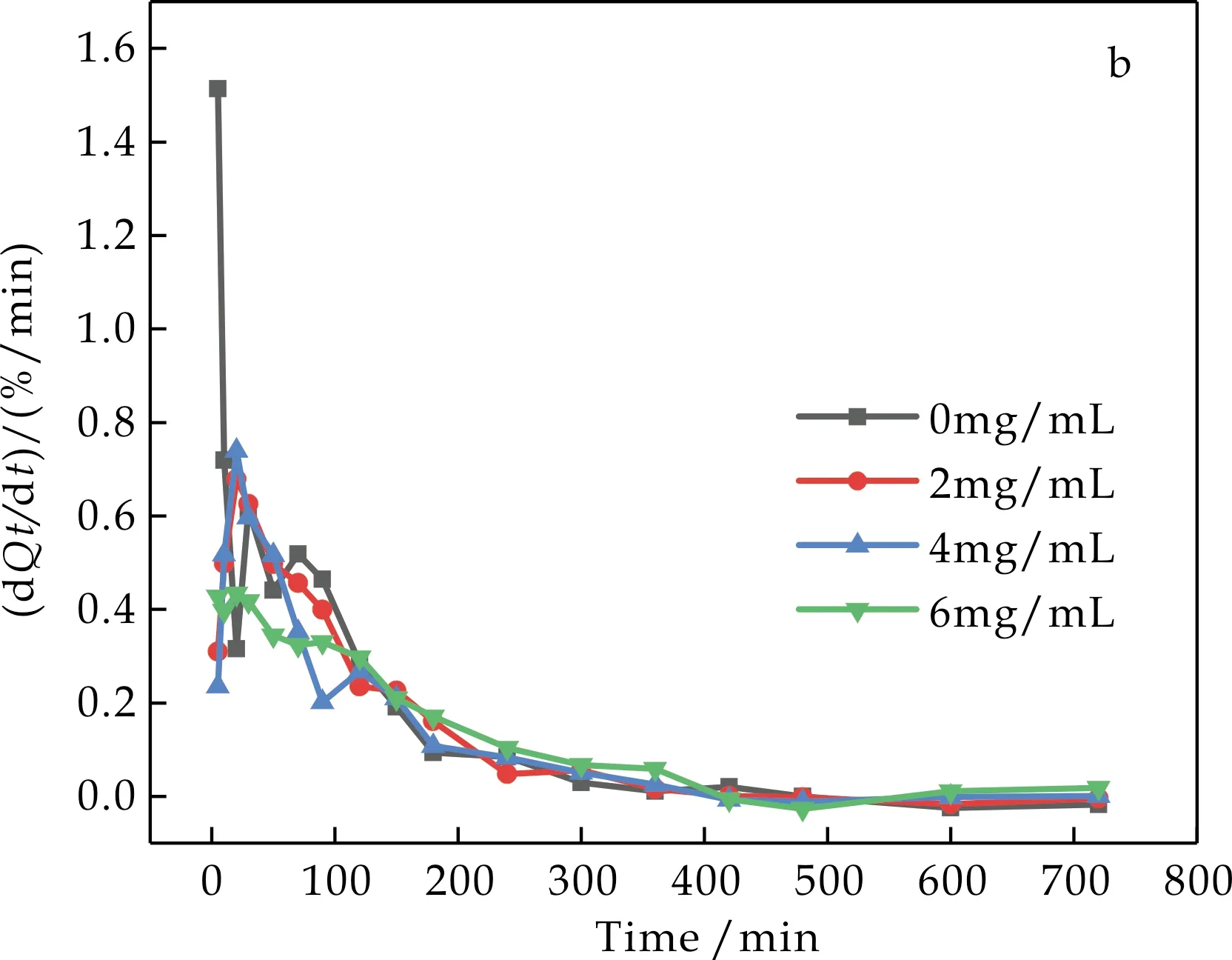
(b)葡萄糖在KGM水分散液中的扩散速率曲线d(Qt-t)图5 葡萄糖在KGM水分散液中的 扩散曲线和扩散速率曲线

(a)葡萄糖在KGM肠液分散液中的扩散曲线Qt-t

(b)葡萄糖在KGM肠液分散液中的扩散速率曲线d(Qt-t)图6 葡萄糖在KGM肠液分散液中的 扩散曲线与扩散速率曲线
2.4.2 KGM在水分散液和肠液分散液中的动力学模型拟合
由图7和图8可知,葡萄糖无论是在水分散液中还是肠分散液中,其扩散行为均符合一级释放动力学模型.动力学结果说明,KGM因其良好的吸水溶胀性使得葡萄糖在扩散过程中扩散阻力增加,扩散速率减小,形成粘度大、流动性差的混悬液还会包裹葡萄糖分子,从而阻碍了葡萄糖在人体肠道内的扩散.
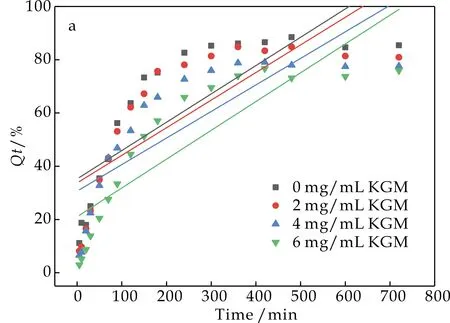
(a)葡萄糖在KGM水分散液中零级释放动力学拟合曲线

(b)葡萄糖在KGM水分散液中一级释放动力学拟合曲线

(c)葡萄糖在KGM水分散液中Higuchi模型拟合曲线
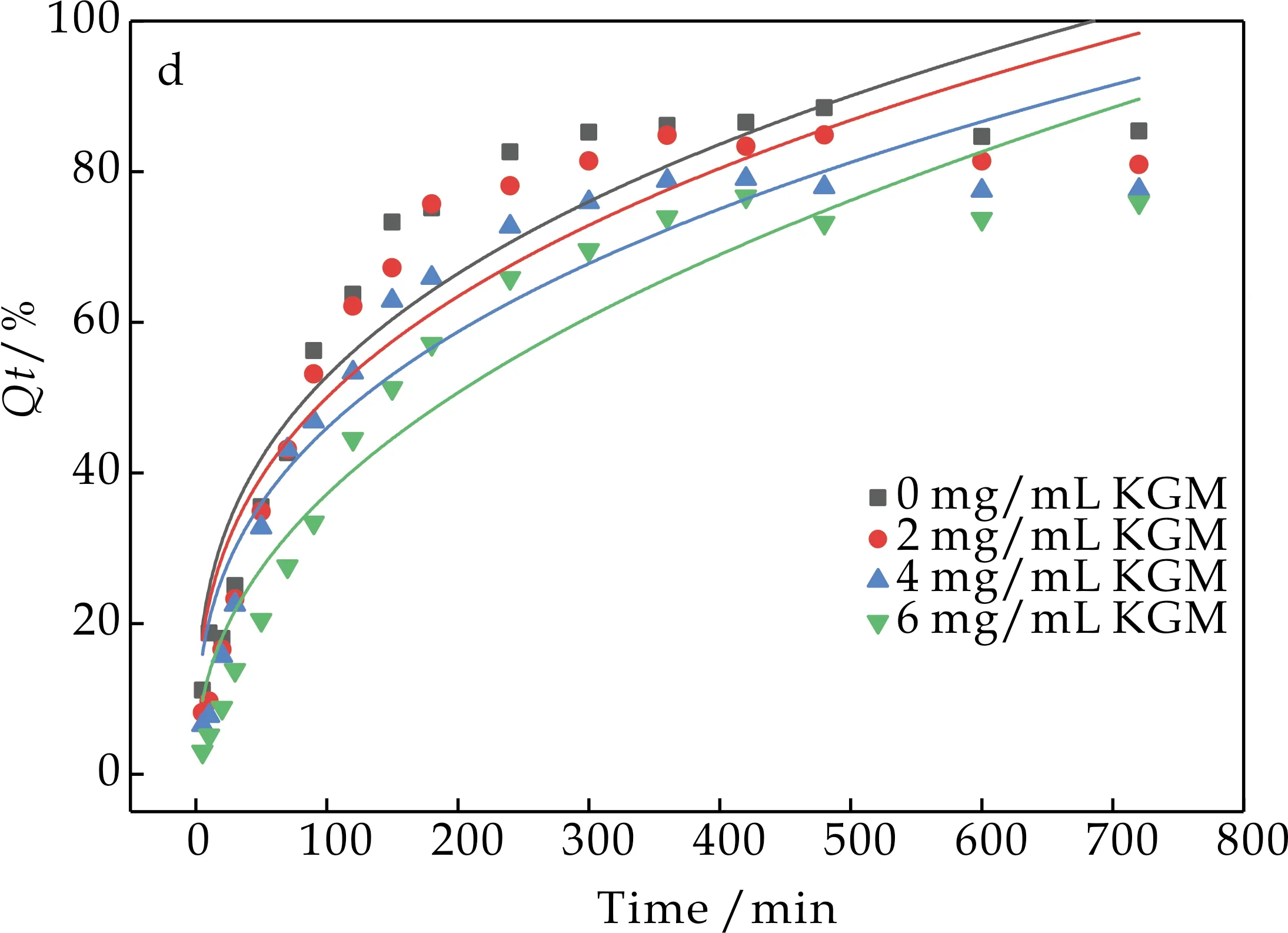
(d)葡萄糖在KGM水分散液中Korsmeyer-Peppas 模型拟合曲线图7 葡萄糖在KGM水分散液中 扩散拟合曲线

(a)葡萄糖在KGM肠液分散液中零级释放动力学拟合曲线

(b)葡萄糖在KGM肠液分散液中一级释放动力学拟合曲线
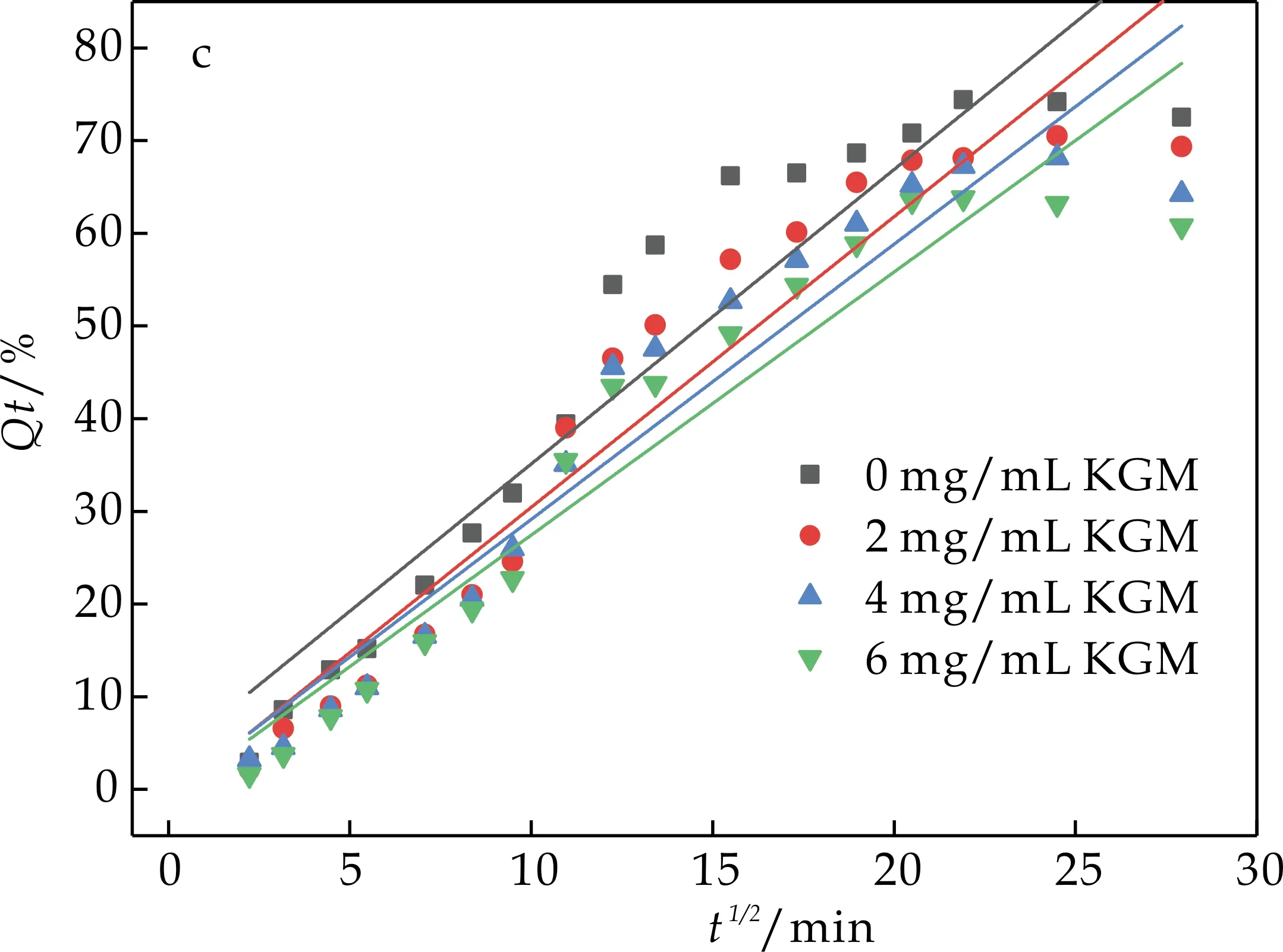
(c)葡萄糖在KGM肠液分散液中Higuchi模型拟合曲线
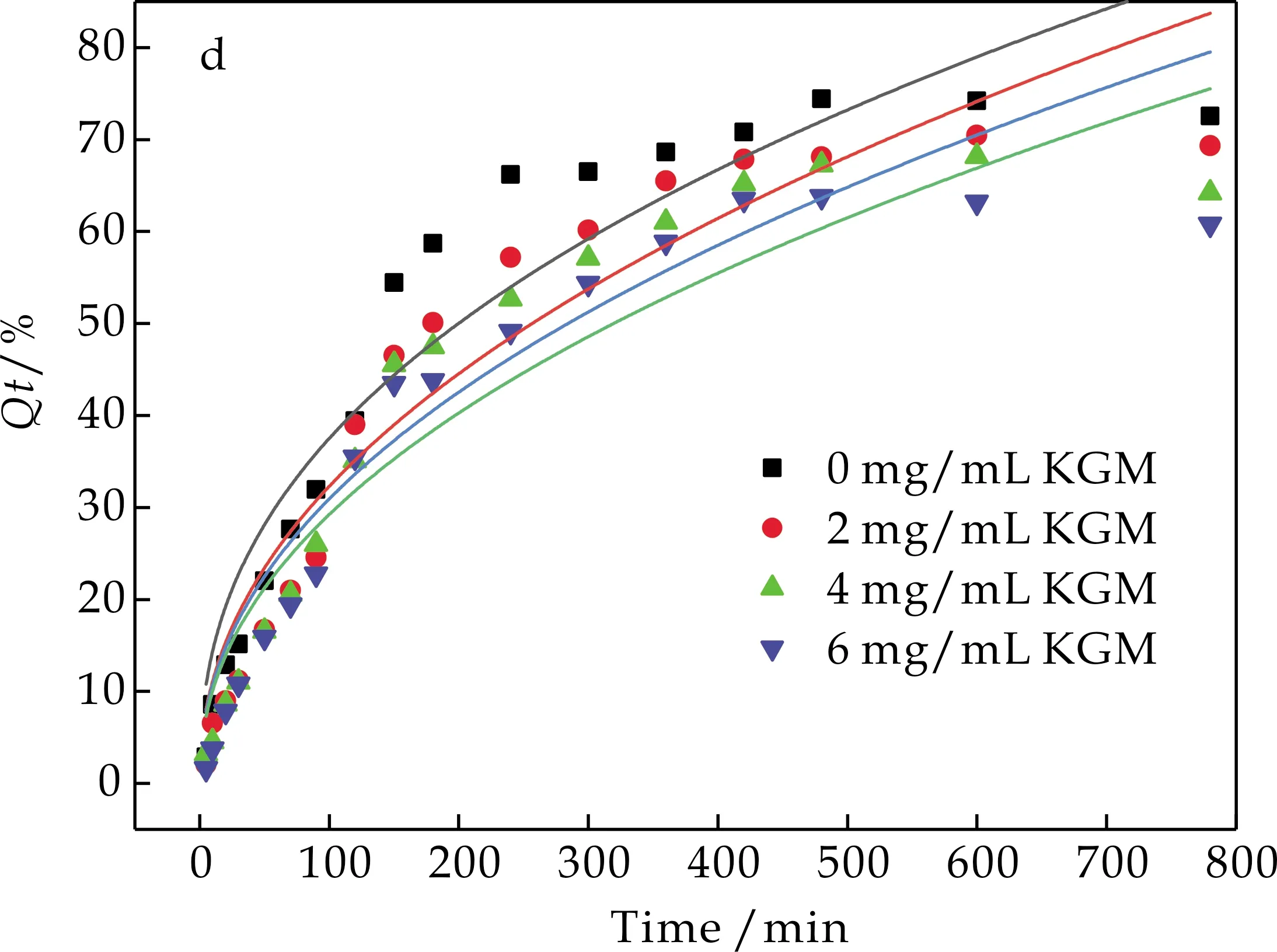
(d)葡萄糖在KGM肠液分散液中Korsmeyer-Peppas 模型拟合曲线图8 葡萄糖在KGM肠分散液中 扩散拟合曲线
2.5 KGM对α-淀粉酶的抑制作用
由图9可知,KGM对α-淀粉酶抑制率随着KGM浓度的增大而增加,KGM的质量分数越大,对α-淀粉酶的抑制效果越好,其对α-淀粉酶的抑制特性与阿卡波糖一致.由表1可知,通过拟合曲线得到KGM的IC50为10.659 mg/mL,R2=0.984 7.该结果说明KGM对α-淀粉酶具有抑制作用,摄入一定量的KGM可以达到与阿卡波糖相同的抑制效果.

图9 KGM/阿卡波糖对α-淀粉酶 的抑制率

表1 KGM/阿卡波糖对α-淀粉酶的抑制作用拟合方程
2.6 KGM的动态粘弹性
由图10可知,随着频率的增加,KGM的储能模量G′和损耗模量G″也随之增加.这是因为此时溶液中KGM分子链还未来得及伸展,所以使储能模量G′和损耗模量G″都增加.从图可知,在扫描频率范围内,低频区G′﹤G″,高频区G′﹥G″,且储能模量G′和损耗模量G″会在某一个频率值时有一个交点,随着KGM浓度的增加,该频率交点值逐渐降低,交点模量增大.可以发现,无论是高浓度还是低浓度,在频率交点之前,储能模量G′总是小于损耗模量G″,此时频率交点值也成为两种模量转变的拐点,拐点之前,KGM溶胶以粘性为主,拐点之后以弹性为主.这是由于KGM浓度增大后,分子链间的缠结程度也会随之增加,KGM与水结合成凝胶状物质,在剪切力的作用下,KGM溶液由粘性液体向弹性固体转变.
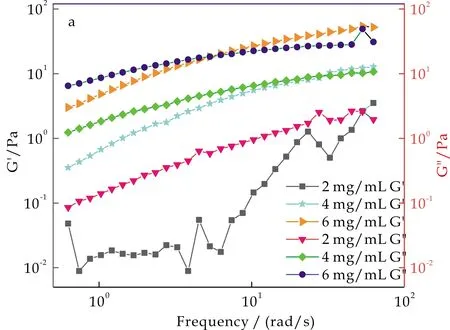
(a)不同质量分数KGM的弹性指数G′和粘性指数G″ 随剪切频率的变化曲线

(b)不同质量分数KGM的复数黏度随剪切频率的变化曲线图10 不同质量分数KGM的动态粘弹性变化
3 结论
KGM作为一种水溶性膳食纤维,可以影响机体肠道内的糖代谢,具有抑制人体餐后血糖水平升高的作用,其主要机制为:
(1)KGM富含纤维,几乎不含热量,糖尿病患者在食用KGM后,KGM不会增加患者血糖水平.
(2)因其很好的吸水溶胀性,KGM在体内能够吸水膨胀,增强人体饱腹感,延缓食物在胃肠道的消化,降低人体摄食量与摄食次数,从而降低人体对葡萄糖的吸收量及吸收速度,达到抑制人体血糖水平的作用.
(3)KGM进入机体后,一方面因其良好的增稠性,会使得人体胃肠道环境粘度增大,从而增加了葡萄糖在胃肠道中的扩散阻力,降低葡萄糖的扩散速率,抑制了葡萄糖的扩散;另一方面,当KGM的浓度达到一定值时,会形成粘度大、流动性差的KGM溶胶,可以包裹葡萄糖分子,降低机体内葡萄糖浓度,减少机体对葡萄糖的吸收.
(4)KGM形成的溶胶可以降低α-淀粉酶的活力,包裹淀粉颗粒,阻碍淀粉水解,降低机体内糖代谢,从而抑制人体血糖水平升高.
本研究阐明了KGM对机体肠道内糖代谢的干预机制,为Ⅱ型糖尿病的膳食干预治疗提供了理论依据.
