盐胁迫对液体培养发菜细胞生理生化特性的影响
2021-04-20赵燕妮袁晓龙陈雪峰许牡丹赵洁妤
赵燕妮, 李 悦, 袁晓龙, 陈雪峰, 许牡丹, 赵洁妤
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.陕西农产品加工技术研究院, 陕西 西安 710021; 3.河北环境工程学院 环境工程系, 河北 秦皇岛 066102)
0 引言
发菜(Nostocflagelliforme)学名发状念珠藻,因藻体细长呈黑色而得名“发菜”,属原核生物界、蓝藻门、蓝藻纲、段殖体目、念珠藻科、念珠藻属[1],是一种可食用的陆生固氮蓝藻,广泛分布于世界各地的沙漠和贫瘠土壤中,在我国主要分布于宁夏、内蒙古、甘肃省等西北地区[2].发菜特殊的生长环境使得其可耐受强光、干旱、极端温度、盐渍化等多种环境因子的胁迫,因此发菜对改善生态环境和维持荒漠生态系统的稳定性有重要的作用[3,4].
作为一种食品,发菜在我国已经有两千多年的历史,富含蛋白质、必需氨基酸、20多种微量元素等营养物质.发菜很高的药用价值也早有记载,传统的中医认为:发菜味甘寒,性平,有顺肠理肺的作用;现代医学认为:常食发菜可助消化、化痰止咳、清热解毒、清肠降压、利尿渗湿、滋补等[5].陈雪峰等[6]通过研究发现,发菜中必需氨基酸、多不饱和脂肪酸含量都较高,可以作为优质蛋白和二十二碳六烯酸( docosahexaenoid acid,DHA)的良好来源.然而,由于野生发菜的生长速度极为缓慢,加之长期以来对发菜的过渡开采,使得发菜资源濒临枯竭,草原生态系统也受到严重破坏.1999年,我国正式将野生发菜列为国家二级保护野生植物,并从2000年7月起严令禁止对野生发菜的随意开采和交易[7].
为实现发菜的可持续利用,人工液体悬浮培养发菜细胞成为培养发菜的主要方法,相关学者对培养基的营养成分、培养温度、光照强度进行优化来提高发菜的生长量.Han等[8]采用红、绿、紫三种不同发光二极管光照对发菜进行培养,研究其多糖代谢的变化,结果表明在红光中发菜产生的多糖含量高于其他光照条件下的多糖.范华等[3]发现发菜在0.3 M盐添加胁迫条件下,细胞的胞外多糖相比于正常培养的发菜细胞有所增加,且盐胁迫下产生的多糖具有更好的体外抗氧化与抗炎镇痛活性.Han等[9]通过添加不同种类的氮源以提高发菜的生物量,结果发现以尿素为氮源可将生物量提高66%,多糖含量提高217.3%.
但是,目前由于对人工液体培养发菜的生理特性认识不足,发菜活性成分生物量较低,还不能用于工业化生产.本实验在先前研究的基础上[3],以发菜悬浮细胞为材料,用BG-11培养液分别添加0、0.1 M、0.3 M浓度的NaCl模拟盐胁迫条件,探索盐添加对发菜悬浮细胞的影响机制,为提高发菜活性生物量及耐盐性提供理论基础,对提高资源利用率及保护生态环境具有重要的意义.
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
发菜细胞,陕西科技大学微生物制造研究室;三氯乙酸、硫代巴比妥酸、乙二酸四乙酸二钠(EDTA-Na2)、无水乙醇,天津科密欧化学试剂有限公司;甲硫氨酸、氯化硝基四氮唑兰(NBT)、核黄素,天津市天力化学试剂有限公司;过硫酸钾、磷酸二氢钠、硫酸亚铁、过氧化氢,天津市恒兴化学试剂制造有限公司.
1.1.2 主要仪器设备
JA2003型电子分析天平,赛多利斯科学仪器有限公司;DM2500M型正置式显微镜,德国徕卡公司;UV-2401PC型紫外可见分光光度计,日本SHIMADZU公司;Varioskan Flash型酶标仪,芬兰赛默飞世尔科技有限公司;DDS-11D型电导率仪,江苏电分析仪器厂;水浴锅,北京科伟永兴仪器有限公司;移液器,德国Eppendorf公司;PHS-25型数显PH计,上海仪电科学仪器股份有限公司.
1.2 实验方法
1.2.1 菌种的培养
500 mL的三角瓶中装入200 mL BG-11培养液,接种10 mL处于对数生长期的发菜悬浮细胞,于温度25 ℃、光照1200 lx的培养箱中培养,BG-11培养基中分别添加0、0.1 M、0.3 M NaCl,每隔5 d取样测定发菜细胞的生理生化特征.
1.2.2 盐胁迫下细胞显微结构观察
选取不同盐浓度(0、0.1 M、0.3 M)在胁迫1 d、15 d、30 d时的发菜细胞,无菌制片,于光学显微镜在目镜×10、物镜×40条件下观察.
1.2.3 叶绿素a和类胡萝卜素含量的测定
叶绿素a的测定采用乙醇提取法[10,11].取2 mL发菜细胞藻悬液,离心去除上清液后加2 mL 95%乙醇混匀润洗一次,再次离心去除上清液,添加1 mL 95%乙醇用研钵充分研磨,避光置于4 ℃冰箱中24 h,记录上清液在664.1 nm和648.6 nm处的吸光度值,叶绿素a含量的计算公式如式(1)所示.类胡萝卜素提取方法同叶绿素a,测定453 nm处的吸光值,绘制吸光值(A)-时间(d)曲线.
CChla/(μg/mL)=13.36×A664.1-5.19×A648.6
(1)
1.2.4 藻蓝素含量的测定
采用张薇君等[12]的方法稍加修改.取2 mL发菜悬浮液,离心去上清液,用pH=7的磷酸缓冲液定容在25 mL容量瓶中,放置于-20℃冰箱中冷冻12 h,取出解冻,3 000 r/m离心15 min,取上层清液(提取液为空白)测定620 nm处的吸光度(整个操作过程要求避光),绘制吸光值(A)-时间(d)曲线.
1.2.5 质膜渗透率测定
参考赵学敏等[13]的方法稍作修改后测定电导率.取5 mL发菜细胞悬浮液离心去除上清液,放入烧杯中,加入20 mL去离子水,25 ℃条件下静置10 h,用玻璃棒轻轻搅拌均匀,恒温条件下测定电导率(Ct),为测定细胞100%电解质渗透率,将测试管加盖煮沸20 min,冷却至25 ℃时测定杀死样电导率(Ck).细胞质膜渗透率测定公式如式(2)所示:
(2)
1.2.6 丙二醛(MDA)含量测定
MDA的测定采用硫代巴比妥酸(TBA)[14]法.取5 mL发菜悬浮细胞液离心去除上清液,加2 mL 10%三氯乙酸(TCA)溶液,于研钵中充分研磨,4 000 rpm条件离心10 min取2 mL上清液,以蒸馏水为空白组加入2 mL 0.6%硫代巴比妥酸溶液,加塞沸水水浴15 min,迅速冷却后离心,取上清液测定532 nm、600 nm、450 nm波长处的吸光度.丙二醛含量计算公式如式(3)所示:
C/(μmol/L)=6.45(A532 nm-A600 nm)-
0.56A450 nm
(3)
1.2.7 超氧化物歧化酶(SOD)活性测定
采用NBT光还原法[15].配制0.1% PVP和20 mmol/L EDTA-Na2混合于棕色瓶中,4 ℃冰箱中保存,取10 mL发菜悬浮细胞离心后去除上清液,加入上述试剂2 mL冰浴研磨匀浆,6 000 r/m、4 ℃离心10 min,上清液即为酶提取液,在-20 ℃冰箱中保存.取透明度高且均一的试管,按照表1加入各组分.
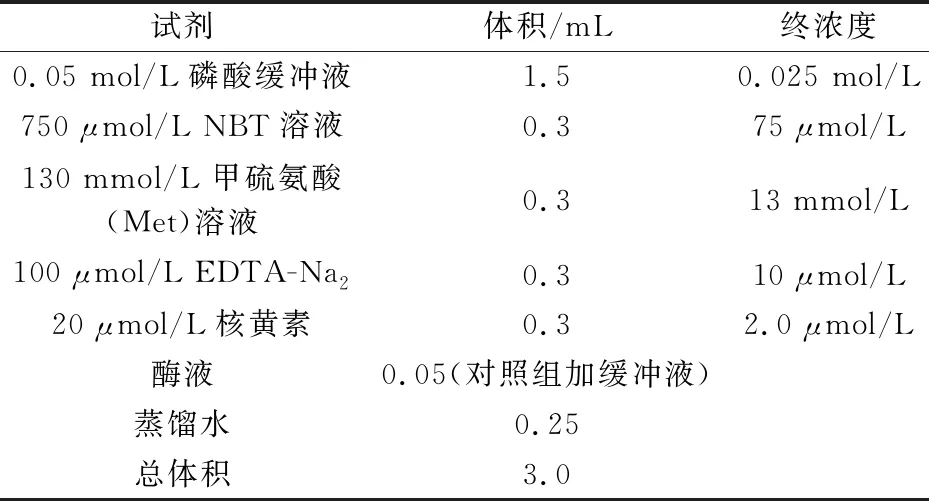
表1 SOD反应液组分表
混匀后将2支放置于暗处做空白对照,其余各管于4 000 lx光下反应25 min,以未经光照的对照管为空白,波长为560 nm处测定OD值.SOD酶活力单位(U),计算SOD酶活性,其单位以U(g·min)表示.
1.2.8 统计学分析
所有试验均重复六次,结果用平均值±标准偏差表示,用origin 9.1进行数据作图.显著性差异表示方法可参考文献[16].
2 结果与讨论
2.1 盐胁迫下发菜细胞显微结构观察
利用光学显微镜对发菜细胞显微结构进行观察,从图1可以看出,发菜细胞形态在盐胁迫下发生了显著变化.第1 d时,不同盐浓度胁迫后,发菜细胞大小均一,各营养细胞相互连接呈念珠状藻丝体,自由舒展在整个培养基中.第15 d时,盐处理发菜细胞中营养细胞链成为较短的藻殖段,甚至断裂成单个细胞,并出现颜色较浅的解体细胞,这些细胞体积逐渐变小,最终退化消亡.30 d时,两组加盐细胞中裂解细胞逐渐增多,其中0.3 M盐处理已几乎没有完整细胞链的存在,0.1 M盐添加中还有部分细胞可存活.本研究表明,添加0.1 M盐时,部分发菜细胞的结构仍较为完整,因此推测发菜在条件适宜时可恢复正常生长状态.而添加0.3 M盐对发菜细胞的胁迫作用最为明显,胁迫30 d后细胞几乎无恢复的可能性.

图1 不同盐浓度胁迫后的发菜分别在 1天、15天、30天时的显微结构(倍数 ×400,比例尺=50 μm)
2.2 盐胁迫下叶绿素a和类胡萝卜素的含量
叶绿素a是叶绿素的重要组成部分,具有吸收和传递光能的作用,存在于类囊体膜上,其合成和降解受到外界非生物胁迫和细胞营养状态的影响[11].本实验对发菜在盐胁迫下叶绿素a含量进行测定,结果如图2(a)所示,该结果表明盐胁迫对发菜细胞中叶绿素a含量有明显抑制作用.未加盐对照组中,发菜的叶绿素a含量持续上升,在第20~25 d之间,上升速率最大.而加盐组随着盐浓度的升高,叶绿素a含量逐渐变低,这可能与细胞类囊体膜的损伤有关.因膜系统是盐胁迫的主要作用靶点,而类囊体膜是进行光合作用电子传递和能量转化的主要场所,因此盐胁迫通过对膜上d氨基乙酰丙胺酸脱氢酶和酸酯还原酶的抑制阻碍了叶绿素a的合成,同时,盐胁迫引起细胞中活性氧簇的积累,这些活性氧簇也使得叶绿素a减少.叶绿素的减少会影响补光蛋白的合成,综上,我们推测细胞的光合速率在盐胁迫条件下也降低.
类胡萝卜素是一种潜在的抗氧化物质,可有效清除盐胁迫诱导的活性氧簇,减少膜系统的过氧化损伤,但是类胡萝卜素的过量积累又会引起光能的遮挡与转移,从而减少叶绿素对光量子的有效吸收,构成盐胁迫下的次级胁迫因素[3].从图2(b)可以看出,随着盐浓度的增加,在盐胁迫初期(第5 d)为了应对外界的非生物胁迫,类胡萝卜素含量发生短暂增加,随后因类胡萝卜素积累造成的二次胁迫使加剧细胞的损伤,其含量呈显著下降趋势,说明发菜细胞对盐胁迫有一定的适应能力,但0.3 M胁迫下第5 d之后无应对能力.

(a)叶绿素a含量在盐胁迫下的变化趋势

(b)类胡萝卜素含量在盐胁迫下的变化趋势图2 不同盐浓度胁迫后叶绿素a和类胡萝卜 素含量的变化趋势(a与b分别表示0.1 M & 0 M、0.3 M & 0 M差异显著(P<0.05))
2.3 盐胁迫下发菜细胞藻蓝素的含量
藻蓝素是色素中少数与蛋白质结合的色素,存在于藻胆体中,又称为藻蓝蛋白.黏附在细胞类囊体膜上的基质表面的藻蓝蛋白(PBPs)是首要的PSII光吸收触角,其组成和功能在胁迫条件下发生变化[17].由图3可知,未加盐发菜细胞的藻蓝素含量逐渐增加,第20 d时达到平稳,加盐细胞的藻蓝素随着盐胁迫时间的增加,含量显著变低,且盐浓度越高含量越低,该结果可能与盐胁迫下藻蓝蛋白含量的降低干扰并阻断了PBPs向PSII反应中心的能量转化有关[18].
2.4 质膜渗透率测定
生物膜是选择透过性膜,是细胞抵抗外界胁迫的天然屏障,细胞膜结构和功能是否稳定以及膜透性是否增加成为判断植物的受伤害程度和其自身抗逆的关键[19].由图4可知,随着盐胁迫时间的延长,三种不同浓度盐胁迫处理后,发菜细胞质膜透性均呈现增加的趋势.与未加盐组相比,加盐组细胞质膜渗透率较高,在胁迫15 d时,0.3 M与0.1 M相比对照组分别增加了6.35%和3.53%,30 d时,0.3 M与0.1 M的质膜渗透率已经达到94.13%和93.01%.在三种盐浓度处理后,0.3 M的盐处理对细胞膜的破坏作用最明显,具有显著差异.因此,随着盐浓度和胁迫时间的增加,细胞质膜的损害程度逐渐加大.

图3 不同盐浓度胁迫后藻蓝素的变化趋势 (a与b分别表示0.1 M & 0 M、0.3 M & 0 M 差异显著(P<0.05))

图4 不同盐浓度胁迫后质膜渗透率的变化 趋势(a与b分别表示0.1 M & 0 M、0.3 M & 0 M差异显著(P<0.05))
2.5 不同盐浓度下发菜丙二醛(MDA)含量
丙二醛是细胞膜脂过氧化物的主要产物,可与细胞膜上的蛋白质、酶等相结合或交联使之失活,从而破坏生物膜的结构与功能,通常作为膜脂过氧化程度和生物抗逆性的重要指标[20].由图5可知,与未加盐组相比,0.1 M与0.3 M盐处理后发菜悬浮细胞MDA含量增加了0.042μmol/g和0.015μmol/g,到第30 d时差异变大,分别为0.233μmol/g和0.176μmol/g,因此在盐胁迫下发菜细胞的丙二醛含量升高,其中0.3 M盐处理胁迫作用最显著,其次为0.1 M盐处理的发菜细胞.这与干旱胁迫和盐碱胁迫时发菜的生理特性研究结果基本一致[21],郭金英等[22]对盐碱胁迫下发菜的MDA含量测定,结果表明随着盐浓度的增加MDA含量先增加后缓慢降低,当大多数细胞死亡时,MDA含量呈现降低趋势.
2.6 不同盐浓度胁迫对发菜悬浮细胞超氧化物歧化酶(SOD)活性的影响
逆境胁迫可促使细胞产生活性氧自由基,破坏体内活性氧自由基的产生和清除之间的平衡,使得细胞损伤,SOD能有效清除体内的超氧自由基,在多种环境胁迫中发挥重要的作用,因此植物在受到盐胁迫时,细胞内抗氧化酶活性与其耐盐性密切相关[23].如图6所示,随着培养时间的增加,发菜细胞SOD活性均呈现先增加后降低的趋势.此外盐处理对发菜悬浮细胞的SOD活性的影响具有剂量效应,低浓度促进酶活,高浓度抑制酶活.0.1 M盐处理能显著提高SOD活性,在第20 d时比未加盐处理的发菜SOD活性增加了40.44%,而0.3 M盐处理的细胞SOD活性最低,发菜细胞受到的伤害较大,SOD活性系统遭到破坏.

图5 不同盐浓度胁迫后MDA含量的变化 趋势(a与b分别表示0.1 M & 0 M、 0.3 M & 0 M差异显著(P<0.05))

图6 不同盐浓度胁迫后SOD的变化 趋势(a与b分别表示0.1 M & 0 M、 0.3 M & 0 M差异显著(P<0.05))
吴月燕等[24]对杜鹃的耐盐性进行研究发现,随着盐浓度的增加,杜鹃细胞SOD活性呈现先增加后降低的趋势,低浓度盐添加时SOD活性有所提高,出现轻微盐害症状,随着盐浓度的增加,SOD活性降低.此外,对盐生隐杆藻[25]和螺旋藻[26]进行盐胁迫处理,结果表明SOD活性均表示为前期增加,达到最大值后迅速降低.
3 结论
盐胁迫容易引起细胞内水分外流,外部离子通过简单扩散和主动运输进入细胞内,引起细胞内离子平衡改变,由此破坏细胞内某些细胞器如叶绿素和细胞膜的结构,抑制代谢酶的活性,从而导致细胞某些生理活性如光合速率的下降.本实验研究表明,在盐胁迫条件下,随着盐浓度的增加,发菜细胞的叶绿素a和藻蓝素含量逐渐降低,类胡萝卜素含量在盐胁迫下先增加后降低,说明发菜细胞在盐胁迫条件下色素组成未发生变化,但含量发生了不同程度的改变,尤其在盐胁迫第10 d之后细胞中色素含量均显著降低,且盐浓度越高色素含量越低,当浓度增加到0.3 M时,色素含量已受到明显抑制,此时胁迫已经超出发菜耐受范围.
细胞膜受损也表现在丙二醛和质膜渗透率的变化上,未加盐培养的细胞丙二醛和质膜渗透率较低,此时细胞具有较高的膜稳定性,盐胁迫下发菜细胞的MDA和质膜透性均增加,且当盐浓度越高时MDA含量越高,此时细胞受到较大的损伤,电解质外渗,膜脂过氧化物增多.
综上所述,液体培养发菜细胞能耐受一定浓度的盐胁迫,对低浓度盐胁迫有一定的适应性,但随着盐浓度的增加和时间的延长,细胞表现出不同程度的损伤.本文仅从生理生化方面做出分析,后续应该进一步从蛋白质、基因、小分子代谢物等水平来阐述发菜受胁迫的机理,分析对比正常、低浓度盐添加、高浓度盐添加时发菜基因、蛋白质或小分子化合物发生了怎样的变化,为念珠藻的抗逆机制研究提供新的视角,为资源保护和定向改良菌株提供理论依据.
