COPD患者血清PGRN、GDF-15和NLRP3炎性小体水平与病情严重程度的相关性及发病危险因素分析
2021-04-15王海滨韩蕃颉杨文平白晓月
王海滨,韩蕃颉,杨文平,白晓月
山东省济南市人民医院呼吸科,山东济南 271100
慢性阻塞性肺疾病(COPD)是一种以持续气流受限为特征的疾病,与肺部、气道对有害颗粒或气体异常的炎性反应有密切关系[1]。随着环境的恶化,COPD发病率逐年上升,不仅严重损伤患者肺功能,还会影响其劳动能力,给家庭及社会均造成了巨大的经济负担[2]。COPD稳定期与急性期的治疗和预后差异较大,但目前临床尚不完全明确其发病机制,故对其判断多以症状为主,还缺乏客观的检验指标。颗粒蛋白前体(PGRN)由多种细胞表达,富含半胱氨酸分泌蛋白,参与了神经退化、肿瘤发生、炎症、伤口愈合等众多病理生理过程[3]。研究发现,在多种自身免疫性疾病和炎症性疾病中,PGRN扮演重要角色,而COPD作为一种慢性炎症性疾病,其PGRN水平升高[4]。生长分化因子-15(GDF-15)由巨噬细胞产生,正常情况下表达较少,但在缺血、缺氧、氧化应激等环境下可出现高表达,研究证实,COPD患者血清GDF-15水平明显升高,其可作为诊断COPD的生物标志物[5]。NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体是免疫系统中一种模式识别受体,参与了感染性疾病和自身免疫性疾病的发生发展[6]。虽有研究分别报道了上述指标对COPD诊断的价值,但探讨其联合诊断COPD的价值及对病情严重程度判断的研究较少,基于此,本研究拟探讨血清中PGRN、GDF-15和NLRP3炎性小体水平与COPD病情严重程度的关系,并分析其发病相关危险因素,现报道如下。
1 资料与方法
1.1一般资料 选取本院2020年1—5月收治的216例COPD患者为COPD组,均经肺功能检查确诊,存在不同程度的呼吸困难、气短、咳痰、慢性咳嗽等症状,根据不同病情分为2组,稳定期组121例,其中男85例,女36例;年龄38~86岁,平均(63.54±8.57)岁;体质量指数(BMI)19.5~25.8 kg/m2,平均(22.05±2.35)kg/m2;10例糖尿病,7例高血压,82例有吸烟史。急性期组95例,其中男63例,女32例;年龄37~88岁,平均(63.72±8.85)岁;BMI 19.2~24.6 kg/m2,平均(22.08±2.34)kg/m2;7例糖尿病,6例高血压,75例有吸烟史。纳入标准:(1)符合COPD相关诊断标准者[7];(2)无支气管扩张者;(3)无支气管哮喘者;(4)无心力衰竭者。排除标准:(1)严重肝肾功能不全者;(2)癌症患者;(3)血液系统疾病者;(4)近3个月使用免疫抑制剂者;(5)严重免疫系统疾病者。另选取同期本院体检健康者100例为健康对照组,其中男69例,女31例;年龄38~88岁,平均(63.71±8.82)岁;BMI 19.2~25.9 kg/m2,平均(22.11±2.42)kg/m2;7例糖尿病,5例高血压,52例有吸烟史。各组研究对象一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,患者及家属均知情同意并签署知情同意书。
1.2方法 问卷调查:根据文献[8]设计调查问卷,包括性别、年龄、既往患病史、营养状况、暴露状况、呼吸道相关症状、燃料类型、人均居住面积、文化程度、家庭经济收入、居住环境等。肺功能检测:选择COSMED便携式肺功能仪(型号Pony FX)检测所有研究对象的肺功能,统一校正各参数值,吹出合格肺功能曲线图3条,采集用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、第1秒用力呼气容积占用力肺活量比值(FEV1/FVC)等肺活量指标。血清指标检测:抽取健康对照组体检当日和COPD组入院次日清晨5 mL空腹静脉血,3 000 r/min离心10 min,取上清液,选择美国贝克曼库尔特全自动生化分析仪(型号AU5800),通过酶联免疫吸附测定检测血清PGRN、GDF-15和NLRP3炎性小体水平,试剂盒均购自杭州联科美讯生物医药技术有限公司,所有操作严格按照仪器和试剂盒说明书进行。
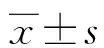
2 结 果
2.1COPD发病相关单因素分析 COPD组家族呼吸道疾病史、化学品暴露或职业粉尘、吸烟人数占比均高于健康对照组(P<0.05)。见表1。
2.2影响COPD发病的多因素Logistic回归分析 以家族呼吸道疾病史(是=1;否0)、化学品暴露或职业粉尘(是=1;否0)、吸烟(是=1;否0)为自变量,以是否为COPD为因变量(是=1;否0),多因素Logistic回归分析结果显示,家族呼吸道疾病史、化学品暴露或职业粉尘、吸烟为影响COPD发病的独立危险因素(P<0.05)。见表2。

表1 COPD发病相关单因素分析[n(%)]

表2 影响COPD发病的多因素Logistic回归分析
2.33组血清PGRN、GDF-15和NLRP3炎性小体水平比较 急性期组血清PGRN、GDF-15和NLRP3炎性小体水平高于稳定期组,稳定期组血清PGRN、GDF-15和NLRP3炎性小体水平高于健康对照组,差异均有统计学意义(P<0.05)。见表3。

表3 3组血清PGRN、GDF-15和NLRP3炎性小体水平比较
2.43组肺功能指标比较 急性期组FEV1/FVC、FVC、FEV1低于稳定期组,稳定期组FEV1/FVC、FVC、FEV1低于健康对照组,差异均有统计学意义(P<0.05)。见表4。

表4 3组肺功能指标比较
2.5血清PGRN、GDF-15和NLRP3炎性小体水平与肺功能指标的相关性 Pearson相关分析结果显示,血清PGRN、GDF-15和NLRP3炎性小体水平与FEV1/FVC、FVC、FEV1均呈正相关(P<0.05)。见表5。

表5 血清PGRN、GDF-15和NLRP3炎性小体水平与肺功能指标的相关性
2.6PGRN、GDF-15和NLRP3炎性小体对COPD的诊断价值 ROC曲线结果显示,除PGRN+GDF-15联合检测COPD的灵敏度与PGRN+NLRP3炎性小体联合检测COPD的特异度高于PGRN+GDF-15+NLRP3炎性小体联合检测外,PGRN+GDF-15+NLRP3炎性小体联合检测COPD的曲线下面积(AUC)、准确度、灵敏度和特异度均高于各指标单独及两两联合检测。见表6。

表6 PGRN、GDF-15和NLRP3炎性小体对COPD的诊断价值
3 讨 论
COPD是临床常见气道炎症性疾病,可分为稳定期与急性期,急性期病情进展迅速,较稳定期病死率明显升高,因此有必要积极预防COPD稳定期向急性期发展,对挽救患者生命安全有重要意义。但目前临床尚不完全明确COPD的发病机制,还缺乏有效的检验指标,血常规、C-反应蛋白和白细胞计数等指标虽然能判断患者炎症程度,但血常规易受临床波动影响,灵敏度和特异度较低,故不能准确反映患者情况[9]。C-反应蛋白主要由肝脏产生,正常情况下水平较低,当机体被感染后C-反应蛋白水平则会升高,因此能帮助判断机体感染程度,但其属于非特异性炎症标志物,很容易受其他因素干扰而影响结果的准确性[10]。MARTINEZ等[11]研究认为,联合降钙素原和高敏C-反应蛋白可提升诊断COPD的准确性,但还缺乏大样本研究证实。
PGRN为一种多功能分泌性生长因子,在多种组织中广泛表达,特别是在类风湿关节炎、系统性红斑狼疮等慢性炎症性疾病中,其水平与疾病严重程度有密切关系[12]。PGRN在肺内主要由上皮细胞表达,研究表明,当机体被细菌感染后,PGRN水平明显升高[13]。一项动物模型研究显示,在气道上皮细胞中PGRN诱导气道上皮细胞凋亡[14]。GDF-15为转化生长因子β超家族成员,正常人体中GDF-15水平极低,但若发生炎性反应、心脏负荷加重、缺血、缺氧等情况则会导致GDF-15水平升高,并发挥保护性调节作用,如抗组织损伤和炎性反应等[15]。以往临床主要通过GDF-15评估心血管异常,但近期研究发现,在病理状态下,肺血管内皮细胞和肺组织也会引起GDF-15水平升高,同时还发现缺氧、氧化应激等刺激均会诱导肺血管内皮细胞产生大量GDF-15[16],故推测其与肺栓塞、COPD等发病有关。NLRP3炎性小体为机体固有免疫主要组成部分,激活后能抵抗病毒、细菌等外来病原体,研究表明,异常激活的炎性小体可促进与疾病相关的慢性炎症的发生,在氧化应激所致损伤和感染所致病原相关分子模式的信号刺激下,炎性小体信号分子被激活,可促进NLRP3结合配体,形成NLRP3炎性小体,激活半胱天冬酶1,诱导并释放白细胞介素等炎症介质,出现一系列炎性反应[17],因此其也参与了COPD的发生和发展。本研究中急性期组血清PGRN、GDF-15和NLRP3炎性小体水平高于稳定期组,稳定期组血清PGRN、GDF-15和NLRP3炎性小体水平高于健康对照组,差异均有统计学意义(P<0.05),说明血清PGRN、GDF-15和NLRP3炎性小体水平可随着病情的加重而升高。肺功能检测是临床诊断COPD的“金标准”,结果显示,急性期组FEV1/FVC、FVC、FEV1低于稳定期组,稳定期组FEV1/FVC、FVC、FEV1低于健康对照组,差异均有统计学意义(P<0.05),说明随着病情的加重,肺功能指标水平也明显降低。Pearson相关分析结果显示,血清PGRN、GDF-15和NLRP3炎性小体水平与FEV1/FVC、FVC、FEV1均呈正相关(P<0.05),说明血清PGRN、GDF-15和NLRP3炎性小体与肺功能指标明显相关,也可以作为评估COPD病情严重程度的指标。ROC曲线结果显示,除PGRN+GDF-15联合检测COPD的灵敏度与PGRN+NLRP3炎性小体联合检测COPD的特异度高于PGRN+GDF-15+NLRP3炎性小体联合检测外,PGRN+GDF-15+NLRP3炎性小体联合检测COPD的AUC、准确度、灵敏度和特异度均高于各指标单独及两两联合检测,说明血清PGRN、GDF-15和NLRP3炎性小体联合检测COPD的价值更高,可有效预测COPD进展情况。COPD可引起呼吸困难、气短、咳痰、慢性咳嗽等症状,严重降低了患者生活质量,且目前尚无特效药物进行治疗,故提前做好防护措施十分重要。本研究多因素Logistic回归分析结果显示,存在家族呼吸道疾病史出现COPD的风险为无家族呼吸道疾病史的2.418倍(P<0.05),分析原因是COPD具有典型的家族聚集倾向和多基因遗传特点,因此若父母存在COPD则易遗传到下一代。但也有研究认为,COPD的家族聚集倾向可能与家族的共同暴露因素和生活环境有关[18],还需大样本研究进一步确定。存在化学品暴露或职业粉尘出现COPD的风险为无化学品暴露或职业粉尘的2.080倍(P<0.05),分析原因为长期接触职业粉尘或存在化学品暴露会改变呼吸道上皮细胞病理及生理特性,增加肺泡间质中炎症介质,诱发肺部疾病,故应加强通风,佩戴口罩,做好安全防范意识,降低患病风险[19]。吸烟出现COPD的风险为不吸烟的2.456倍(P<0.05),分析原因是烟草中含有大量有害颗粒,会引起多种疾病,同时长期吸烟会刺激气道引起气道慢性损伤。TALIKKA等[20]研究发现,吸烟还会引起支气管痉挛,提高气道阻力,并损伤支气管上皮纤毛,紊乱其排列,缩短其长度,降低气道局部抵抗力,因此应加大戒烟力度,禁止公共场所吸烟。
综上所述,COPD患者血清PGRN、GDF-15和NLRP3炎性小体水平升高,且与病情严重程度相关,上述指标联合检测可有效预测COPD进展情况;家族呼吸道疾病史、化学品暴露或职业粉尘、吸烟为影响COPD发病的独立危险因素,应加强职业防护,宣传公共场所禁止吸烟,降低COPD发生率。
