不同浓度氧化石墨烯对人牙周膜干细胞增殖及成骨分化的影响
2021-04-15张元杰吴佩玲王倩云买热叶木姑艾沙阮晓慧
张元杰,吴佩玲,王倩云,买热叶木姑·艾沙,阮晓慧
(新疆医科大学第二附属医院口腔科,乌鲁木齐 830063;*通讯作者,E-mail:295923650@qq.com)
牙周病是口腔中常见的炎症性疾病之一,导致牙槽骨吸收,最终使牙齿脱落,所以在牙周病的治疗中,恢复缺损的牙槽骨依旧是研究的热点内容之一。近年来,随着对新型支架材料和干细胞的研究,为牙周组织再生提供了新的思路。GO因其优异的理化性质,成为组织工程领域研究与应用的热点。其作为石墨烯的衍生物之一,具有良好的生物相容性和亲水性[1],高的机械强度,大的接触面积等特性[2],在组织工程领域展现出应用潜力。国内外学者研究发现,GO超过一定浓度对细胞产生毒性作用[3-6],但对低浓度GO是否能够促进间充质干细胞增殖与成骨分化得出的结论不同[7]。
hPDLSCs作为牙源性干细胞的一种,具有多向分化潜能,本课题组[8,9]前期研究发现,hPDLSCs表现出了明显的增殖和成骨分化能力,是牙周组织再生的理想的种子细胞。本研究拟通过体外实验,将hPDLSCs与不同浓度GO共培养,探讨GO对hPDLSCs的增殖及成骨分化能力的作用。
1 材料和方法
1.1 主要试剂和仪器
氧化石墨烯分散液(江苏先锋纳米);澳洲胎牛血清(Gibco,美国);维生素C;β-甘油磷酸钠;地塞米松;茜素红染色液(索莱宝生物,北京);细胞计数试剂盒(博士德生物,武汉);逆转录试剂盒(Thermo,美国);实时荧光定量聚合酶链反应试剂盒(QIAGEN,德国)。
实时荧光定量PCR仪(Life-Tech,美国);酶标仪(Thermo,美国);荧光倒置显微镜(Leica,德国);超净工作台(苏州净化);恒温水浴箱(上海一恒科技);正置显微镜;倒置显微镜(Leica,德国);低温高速离心机(Eppendorf,德国)。
1.2 氧化石墨烯(graphene oxide,GO)完全培养基的制备
配制0,0.1,0.5,2.5,12.5,62.5 μg/ml GO完全培养基(含10%FBS的α-MEM培养基)和0,0.1,0.5,2.5 μg/ml GO成骨诱导液(10% FBS、10 mmol/L β-甘油酸钠、50 mg/L维生素C及10 nmol/L地塞米松的α-MEM培养基)。
1.3 hPDLSCs复苏、培养及传代
hPDLSCs由课题组前期构建,复苏第2代冻存hPDLSC,放入培养条件为37 ℃、体积分数5%CO2、饱和湿度的恒温箱进行培养,待细胞汇合度为80%-90%时,用2.5 g/L胰蛋白酶消化及传代,采用第3-4代细胞进行实验。
1.4 倒置显微镜观察hPDLSCs的细胞形态
将hPDLSCs用2.5 g/L胰蛋白酶常规消化为细胞悬液,进行细胞计数,将细胞密度调整为1×103/孔,接种于6孔板中,24 h细胞贴壁后分别加入不同GO浓度完全培养基对细胞培养,于恒温箱培养72 h,倒置显微镜下观察细胞形态。
1.5 细胞计数试剂盒法(CCK-8)检测hPDLSCs增殖
将对数生长期的hPDLSCs常规消化为细胞悬液,以1×103/孔的密度接种于4块96孔培养板中,置于恒温箱中培养24 h。待细胞贴壁后,弃去原培养基,换为不同GO浓度完全培养基对细胞培养,每组设置3个复孔。分别在1,3,5,7 d随机取出一块96孔板终止培养,用磷酸盐缓冲液清洗3次,加入10 μl CCK-8液,置于恒温箱中孵育2 h,在推荐波长490 nm下测定吸光度(OD),另设波长630 nm为参考波长。
1.6 hPDLSCs成骨分化能力的测定
1.6.1 茜素红染色法检测hPDLSCs矿化情况 将对数生长期的hPDLSCs常规消化为细胞悬液,以1×105个/孔的浓度接种于6孔板,在恒温箱进行培养。待细胞汇合度达到50%-60%弃去原培养基,换为含0,0.1,0.5,2.5 μg/ml GO的成骨诱导液对细胞培养,每3 d换液1次,培养到第14天时行茜素红染色,于倒置显微镜下观察各组矿化结节的形成情况。
1.6.2 实时荧光定量PCR检测成骨标志基因的表达 将对数生长期的hPDLSCs常规消化制成细胞悬液,以2×105个/孔的浓度接种于6孔板,换为含0,0.1,0.5,2.5 μg/ml GO成骨诱导液对细胞培养。14 d后终止培养,Trizol裂解、提取细胞总RNA并测定浓度与纯度,将所提取的RNA逆转录为cDNA,采用荧光定量试剂盒对成骨标志基因进行定量,分别检测碱性磷酸酶(alkaline phosphatase,ALP)、骨钙蛋白(ostecalcin,OCN)、Runt相关转录因子2(Runt-related transcription factor 2,Runx2)的表达,求各组2-ΔΔCt值,并进行统计学分析。

表1 实时荧光定量PCR目的基因引物序列
1.7 统计学方法
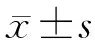
2 结果
2.1 GO对hPDLSCs形态的影响
加入不同浓度的GO完全培养基培养72 h后,采用PBS清洗3次。镜下观察,除0 μg/ml组外,各浓度组均有GO颗粒的沉积,12.5,62.5 μg/ml GO培养基中GO颗粒较多,并与细胞紧紧黏附至皿底。0.1,0.5,2.5,12.5 μg/ml GO完全培养基中细胞形态立体饱满,呈长梭形,轮廓清晰,与0 μg/ml组无明显差异。62.5 μg/ml GO完全培养基中细胞折光度降低,立体感消失,呈现扁平并发生皱缩(见图1)。
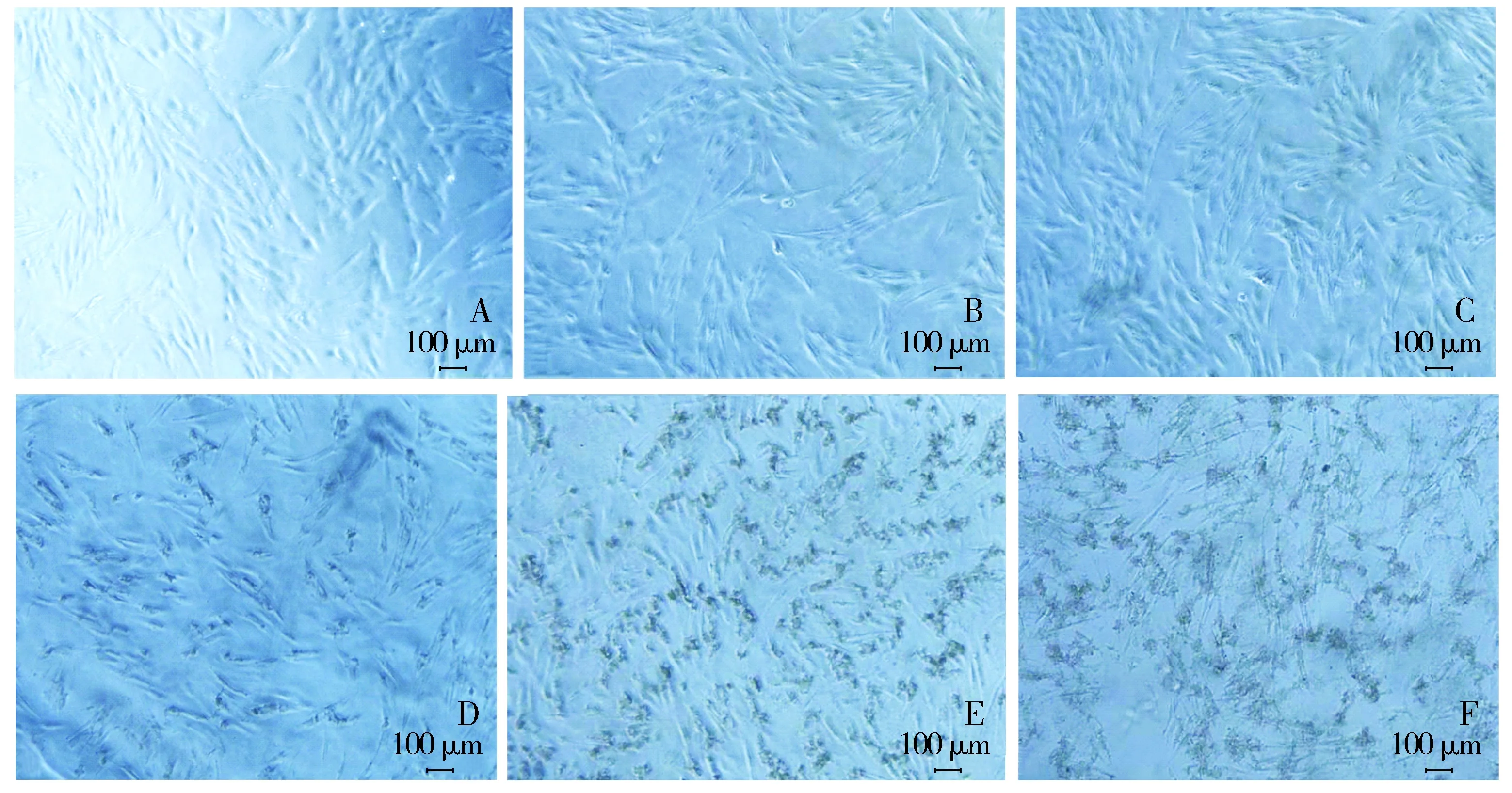
A.0 μg/ml GO组;B.0.1 μg/ml GO组;C.0.5 μg/ml GO组;D.2.5 μg/ml GO组;E.12.5 μg/ml GO组;F.62.5 μg/ml GO组图1 不同浓度GO培养的hPDLSCs形态学观察 (×50)Figure 1 Morphological observation of hPDLSCs cultured with different concentrations of GO (×50)
2.2 GO对hPDLSCs增殖影响
加入不同浓度的GO完全培养基培养,分别在1,3,5,7 d随机取出一块96孔板进行CCK-8检测。结果显示:第1,3,5,7天,0.1,0.5,2.5,12.5 μg/ml GO对hPDLSCs增殖无影响,与0 μg/ml相比,差异无统计学意义(P>0.05)。第1,3天,62.5 μg/ml GO对hPDLSCs增殖无影响(P>0.05),但从第5天起,62.5 μg/ml GO抑制hPDLSCs增殖,差异具有统计学意义(P<0.001,见图2,表2)。
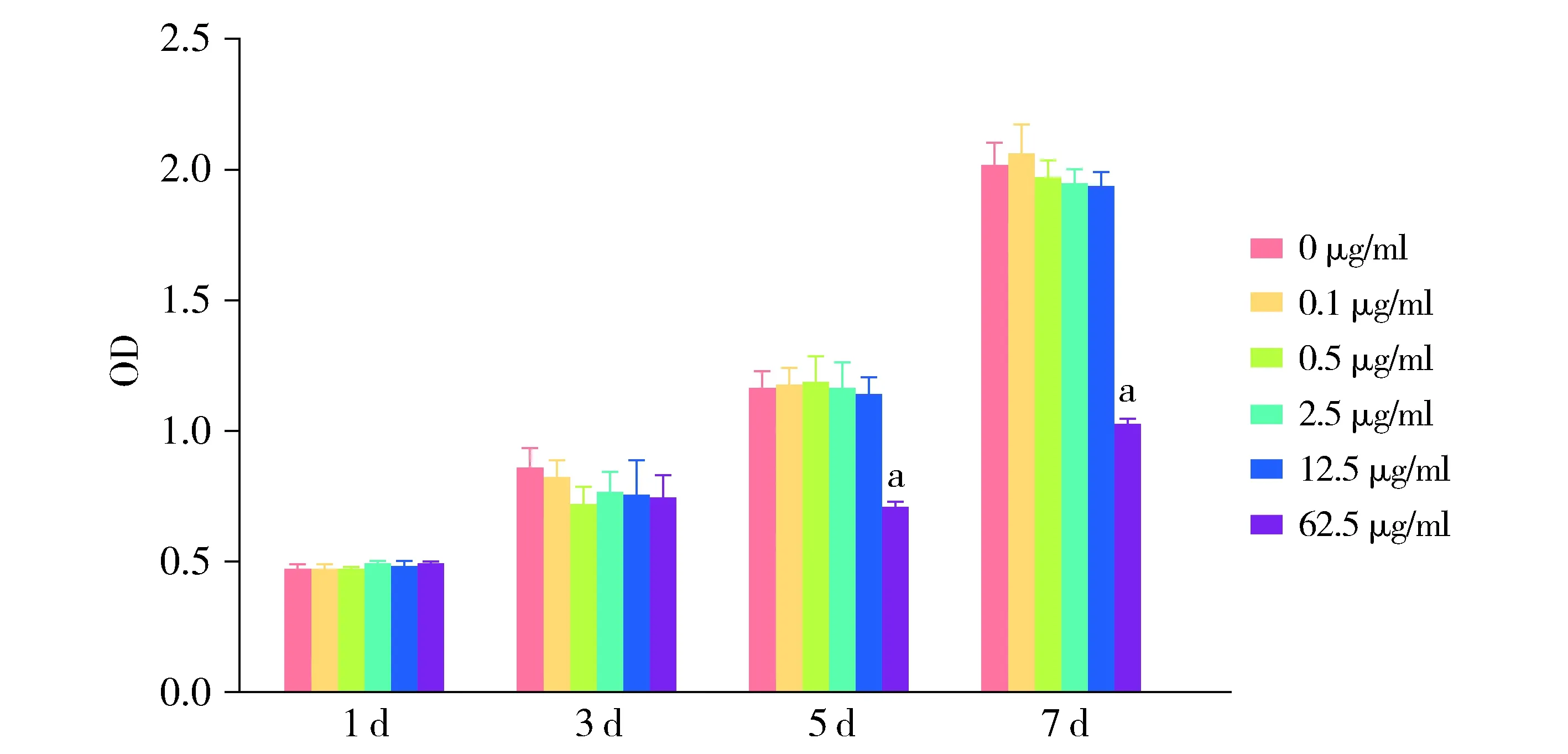
与0 μg/ml比较,aP<0.001图2 GO对hPDLSCs增殖影响Figure 2 The effect of GO on the proliferation of hPDLSCs
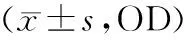
表2 CCK-8测定GO培养不同时间对hPDLSCs增殖影响
2.3 GO对hPDLSCs成骨能力的影响
2.3.1 茜素红染色结果 不同浓度GO成骨诱导液对hPDLSCs进行成骨诱导14 d,进行茜素红染色。结果显示,0 μg/ml GO组矿化结节数量多、染色深、且形成的范围较广泛,随着GO浓度的增大,矿化结节数量逐渐减少且范围较小(见图3)。
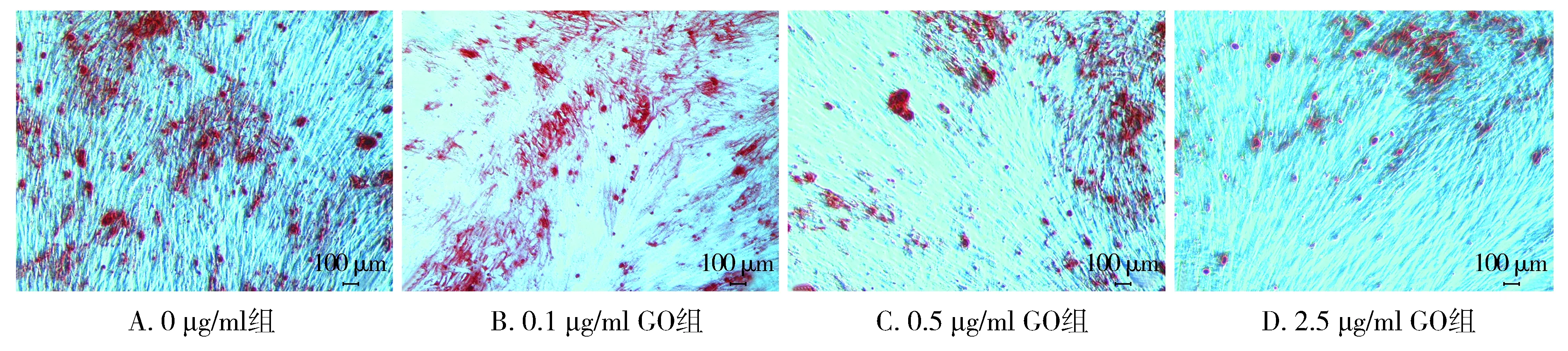
图3 不同浓度GO培养hPDLSC茜素红染色 (×50)Figure 3 Alizarin red staining of hPDLSC cultured with different concentrations of GO (×50)
2.3.2 成骨标志基因表达结果 对hPDLSCs成骨诱导14 d,实时荧光定量PCR检测成骨基因ALP、Runx2、OCN的表达。结果显示,与0 μg/ml相比,ALP表达量随着GO浓度的增高逐渐降低,差异具有统计学意义(P<0.001)。在0.1,0.5 μg/ml GO成骨诱导液中的Runx2表达量下降(P<0.05),随着GO浓度增高至2.5 μg/ml,Runx2表达量显著下降(P<0.001)。OCN表达量在0.1,0.5 μg/ml GO成骨诱导液中与0 μg/ml相比无差异(P>0.05),在2.5 μg/ml GO成骨诱导液中明显下降(P<0.001,见图4)。

与0 μg/ml比较,*P<0.05,***P<0.001图4 GO对hPDLSCs成骨基因表达的影响Figure 4 The effect of GO on the expression of hPDLSCs osteogenic genes
3 讨论
石墨烯及其衍生物中,GO是生物医学应用中有潜力的材料之一[10]。与其他材料相比,GO具有较大的表面积,易于被不同的官能团修饰[11],在生物医学领域有很大潜能,但GO表现出的毒性和生物安全性依旧需要引起重视[12,13]。
本实验从细胞形态、细胞增殖及细胞成骨分化方面探讨不同浓度GO对hPDLSCs的影响。倒置显微镜观察表明,0.1,0.5,2.5,12.5 μg/ml GO完全培养基中细胞形态饱满,呈长梭形,轮廓清晰,与对照(0 μg/ml)无明显差异;而62.5 μg/ml GO完全培养基中GO颗粒与细胞紧密黏附于皿底,细胞呈现扁平并发生皱缩,折光度降低,立体感消失。国内学者研究发现高浓度GO对大鼠骨髓间充质干细胞形态同样有显著影响,可使细胞伸展性下降,折光率降低。这些细胞形态的变化与氧化石墨烯的浓度呈正相关[14]。Olteanu等[3]通过激光共聚焦显微镜观察也发现40 μg/ml GO导致人牙囊干细胞骨架收缩,微管结构受损。由此可见,高浓度GO对细胞形态有显著影响。
细胞增殖实验表明,培养第1,3,5,7天,0.1,0.5,2.5,12.5 μg/ml GO对hPDLSCs增殖无影响(P>0.05),在第5,7天,62.5 μg/ml GO完全培养基抑制hPDLSCs增殖,差异具有统计学意义(P<0.001)。国外学者研究发现,GO对人成纤维细胞毒性表现为浓度依赖性,GO浓度小于20 μg/ml对细胞无影响,高于50 μg/ml表现出明显的细胞毒性,并且可以进入细胞质和细胞核,降低细胞黏附[15]。Wu等[16]将人角膜上皮细胞培养12.5-100 μg/ml GO培养基中,随着时间跟浓度的增加,细胞活力降低,与本实验的研究结果相一致。
本实验通过茜素红染色与检测成骨基因表达情况研究不同浓度GO对hPDLSCs成骨分化能力的影响。对hPDLSCs成骨诱导14 d后,茜素红染色显示,不同浓度GO成骨诱导液培养后,各浓度组均有矿化结节生成,0 μg/ml GO组矿化结节数量多、染色较深,且形成的范围较广泛,随着GO浓度的增大,矿化结节数量逐渐减少且范围较小。实时荧光定量PCR检测结果显示,与0 μg/ml GO组相比,随着GO浓度的增高,ALP、Runx2表达量逐渐降低,差异具有统计学意义(P<0.05或P<0.001),OCN在2.5 μg/ml GO成骨诱导液组表达有显著差异(P<0.001)。
关于GO对细胞增殖及成骨的影响,较为一致的观点是高浓度GO存在细胞毒性[17]。但较低浓度GO对细胞增殖及成骨的影响,国内外学者得出不同的结论。王洁等[13]发现低浓度GO对大鼠骨髓间充质干细胞的增殖无促进作用。魏常博等[7]发现GO浓度为0.1,0.5 μg/m以促进人乳牙牙髓干细胞的黏附和增殖能力,并且可以促进成骨相关蛋白表达,这与我们的研究结果相反。其原因可能与GO有关。研究表明,在制备GO过程中,不同氧化时间和温度、不同类型和浓度的氧化剂会极大地影响其结构性能,进而导致氧化水平不同、杂质含量不同的GO作用于同一细胞系后会产生不同结果[18]。同时,本实验在细胞增殖与成骨诱导过程中,所设定的浓度梯度不适宜hPDLSCs的增殖及成骨分化,同时培养时间过长可能引起hPDLSCs成骨分化能力减弱。也可能是由于GO与细胞在培养皿中黏附,培养过程中多次换液造成GO富集,导致浓度改变。其具体抑制原因尚不清楚,还需要进一步实验明确。
本研究将hPDLSCs与不同浓度GO培养基共培养,结果表明随着GO浓度增高和培养时间增加,hPDLSCs的增殖及成骨能力受到抑制,表现出剂量和时间依赖性。在未来的研究中,如何使其更有利于干细胞的增殖与分化,更好地引导牙周组织再生,仍需要进一步探究。
