上调miR-126对LPS诱导的小鼠急性肺损伤的保护作用及机制
2021-04-15尚娟,祝瑞
尚 娟,祝 瑞
(川北医学院第二临床医学院,南充市中心医院重症医学科,南充 637000;*通讯作者,E-mail:shangjuanzzyx@163.com)
急性肺损伤(acute lung injury,ALI)是呼吸系统最常见的急危重症之一,以肺组织过度炎症反应和微循环通透性增加为主要特征,已经成为重症医学科患者死亡的主要原因之一[1]。ALI的病因多样,发病机制复杂,但炎性反应失控在ALI发病过程中的作用已经得到公认[2]。目前临床上对于ALI的治疗以对症支持治疗为主,仍缺乏特异性药物和有效的治疗手段,死亡率仍居高不下[3]。因此探索能够抑制ALI早期过度和失控炎症反应的有效手段意义重大。
微小RNA(miRNAs)是由19-25个核苷酸组成的小分子非编码RNA,通过调控下游靶基因的表达发挥作用,参与调控机体细胞许多重要的生命活动[4]。近年来研究显示miRNA在机体炎症反应的调控中发挥着重要的作用,并且与ALI的发生进展密切相关[5]。研究发现miR-126是血管和心脏、肺等组织器官的内皮细胞中高表达的miRNA之一,参与多种免疫细胞的发育和功能的调控[6,7],在机体炎症方面起着重要的作用[8-10]。Huang等[11]通过基因芯片技术发现包括miR-126在内的多个miRNA在ALI大鼠模型肺组织中表达降低,然而具体作用机制尚不清楚。因此,本研究通过体外构建脓毒症ALI小鼠模型,探索miR-126对小鼠ALI肺损伤的影响及可能的作用机制。
1 材料与方法
1.1 实验动物及试剂
清洁级C57BL/6小鼠40只,雄性,8-10周龄,体质量20-25 g,购自川北医学院实验动物中心。LPS购自美国Sigma公司;agomiR-NC、agomiR-126购自上海吉玛公司;髓过氧化物酶(MPO)试剂盒购自南京建成公司;IL-1β、TNF-α和IL-6的ELISA试剂盒购自武汉博士德生物公司;Trizol购自美国Invitrogen公司;反转录试剂盒、qRT-PCR试剂盒购自美国Thermo Fisher公司;PCR引物购自广州锐博生物公司;HMGB1、GAPDH抗体购自美国CST公司。
1.2 小鼠分组及ALI模型建立
40只C57BL/6小鼠随机分为control组、ALI组、ALI+agomiR-NC组和ALI+agomiR-126组,每组10只。ALI组利用腹腔注射LPS(5 mg/kg)诱导建立ALI模型[12,13],ALI+agomiR-NC组和ALI+agomiR-126组在建立ALI模型后即刻,分别从尾静脉给予注射agomiR-NC和agomiR-126(80 mg/kg),control组仅以等量的生理盐水进行腹腔和尾静脉注射。本研究经实验动物伦理委员会审查批准(批文号20190105),整个实验过程严格遵循《实验动物管理条例》规定。
1.3 观察指标
1.3.1 血气分析 ALI模型建立后24 h,用含肝素钠注射器经颈动脉采血0.5 ml,在全自动血气分析仪上行动脉动脉血氧分压(PaO2)、二氧化碳分压(PaCO2)和pH值的检测。
1.3.2 支气管肺泡灌洗液(BALF)中IL-1β、TNF-α和IL-6浓度的检测 ALI模型建立后24 h,颈椎脱臼法处死小鼠,开胸,结扎气管和右侧主支气管,用1 ml注射器穿刺进入左侧主支气管应用0.3 ml PBS缓慢进行肺泡灌洗3次,收集BALF,4 ℃离心取上清液,应用IL-1β、TNF-α和IL-6的ELISA试剂盒测定支气管肺泡灌洗液(BALF)中IL-1β、TNF-α和IL-6的浓度。
1.3.3 肺组织病理学观察及肺损伤评分 取小鼠右肺上叶组织,4%多聚甲醛固定24 h后,石蜡包埋,行5 μm切片,苏木精-伊红(HE)染色,光镜下观察肺组织的病理学变化,并参考文献[14]的方法进行肺损伤病理评分。肺损伤病理评分依据肺泡出血、肺泡间隔水肿、肺泡内中性粒细胞浸润、肺泡内纤维蛋白沉积4个方面进行评价,根据病变程度分别赋分:0分,正常或者轻微病变;1分,轻度病变;2分,中度病变;3分,重度病变。
1.3.4 肺湿重/干重(W/D)比值的检测 取右肺中叶及下叶组织100 mg,滤纸沾干表面水分,天平称湿重后,放入80 ℃恒温烘箱中烘烤48 h后,天平称干重,计算W/D比值。
1.3.5 髓过氧化物酶(MPO)活性检测 取右肺中叶及下叶组织100 mg,液氮研磨后,RIPA裂解液冰上裂解,收集裂解液,4 ℃离心取上清液,采用MPO检测试剂盒测定MPO活性。
1.3.6 肺组织中miR-126表达的检测 采用qRT-PCR测定肺组织miR-126的表达。取右肺中叶及下叶组织,应用Trizol提取肺组织总RNA,应用反转录试剂盒反转录合成cDNA。参照qRT-PCR试剂盒说明书反应体系进行qPCR反应。miR-126引物正向:5′-UCGUACCGUGAGUAAUAAUGCG-3′,反向:5′-CAUUAUUACUCACGGUACGAUU-3′;U6引物正向:5′-CTCGCTTCGGCAGCACA-3′,反向:5′-AACGCTTCACGAATTTGCGT-3′。PCR反应条件:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,进行45个循环。以U6作为内参,miR-126的表达采用2-ΔΔCt法计算。
1.3.7 肺组织中HMGB1蛋白表达的检测 采用Western blot法测定肺组织HMGB1蛋白的表达。取右肺中叶及下叶组织匀浆,加入RIPA裂解液提取蛋白并蛋白定量。取50 μg蛋白上样,行10% SDS-PAGE电泳并转移至PVDF膜。5%脱脂牛奶封闭3 h,加入抗HMGB1(1 ∶1 000)和GAPDH一抗(1 ∶2 000)4 ℃孵育过夜,次日再加入二抗室温孵育1 h,经曝光显影、照相,图像分析软件分析条带灰度值。
1.4 统计学方法
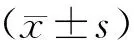
2 结果
2.1 各组小鼠肺组织miR-126、HMGB1蛋白表达水平的比较
与control组比较,ALI组小鼠肺组织miR-126相对表达明显降低(P<0.05),HMGB1蛋白表达明显升高(P<0.05)。与ALI组比较,ALI+agomiR-NC组小鼠肺组织miR-126和HMGB1蛋白表达差异无统计学意义(P>0.05)。与ALI+agomiR-NC组比较,ALI+agomiR-126组小鼠肺组织miR-126表达明显升高(P<0.05),HMGB1蛋白表达明显降低(P<0.05,见表1,图1)。
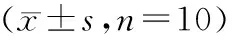
表1 各组小鼠肺组织miR-126、HMGB1蛋白表达水平的比较

图1 各组小鼠肺组织HMGB1蛋白表达Figure 1 Expression of HMGB1 protein in lung tissue of mice in each group
2.2 各组小鼠动脉血气分析结果比较
与control组比较,ALI组小鼠动脉血pH值和PaO2明显降低(P<0.05)。与ALI组比较,ALI+agomiR-NC组小鼠动脉血pH值和PaO2差异无统计学意义(P>0.05)。与ALI+agomiR-NC组比较,ALI+agomiR-126组小鼠动脉血pH值和PaO2明显升高(P<0.05)。各组小鼠动脉血PaCO2明显差异无统计学意义(P>0.05,见表2)。
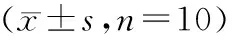
表2 各组小鼠血气分析结果比较
2.3 各组小鼠BALF中IL-1β、TNF-α和IL-6浓度的比较
与control组比较,ALI组小鼠BALF中IL-1β、TNF-α和IL-6的含量明显增多(P<0.05)。与ALI组比较,ALI+agomiR-NC组小鼠BALF中IL-1β、TNF-α和IL-6的含量差异无统计学意义(P>0.05)。与ALI+agomiR-NC组比较,ALI+agomiR-126组小鼠BALF中IL-1β、TNF-α和IL-6的含量明显减少(P<0.05,见表3)。
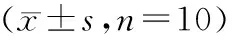
表3 各组小鼠BALF中IL-1β、TNF-α和IL-6的浓度的比较
2.4 各组小鼠肺组织病理学改变及肺损伤评分比较
control组小鼠肺泡形态规则,结构清晰完整。与control组比较,ALI组小鼠肺泡结构杂乱,肺泡壁增厚,肺泡腔内可见大量炎性细胞及红细胞,肺损伤病理评分明显升高(P<0.05,见图2、表4);与ALI组比较,ALI+agomiR-NC组小鼠肺组织病理学改变相近,肺损伤病理评分差异无统计学意义(P>0.05)。与ALI+agomiR-NC组比较,ALI+agomiR-126组小鼠肺组织病变学改变明显减轻,肺损伤评分明显降低(P<0.05,见图2、表4)。

图2 各组小鼠肺组织的病理学改变 (HE染色,×200)Figure 2 Pathological changes of lung tissue in mice in each group (HE staining,×200)
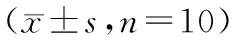
表4 各组小鼠肺组织损伤评分、W/D比值、MPO活性的比较
2.5 各组小鼠肺W/D比值、MPO活性的比较
与control组比较,ALI组小鼠肺W/D比值、MPO活性明显升高(P<0.05)。与ALI组比较,ALI+agomiR-NC组小鼠肺W/D比值、MPO活性差异无统计学意义(P>0.05)。与ALI+agomiR-NC组比较,ALI+agomiR-126组小鼠肺W/D比值、MPO活性明显降低(P<0.05,见表4)。
3 讨论
脓毒症是急性肺损伤发病的最常见原因之一,能够直接或间接引起不同程度的肺损伤,严重者进展为ARDS,病死率可高达60%[15]。过度炎症反应是脓毒症诱发ALI的重要原因,但具体分子机制尚不清楚,如何有效控制ALI过程中过度炎症反应,对于ALI的治疗至关重要[16]。LPS是内毒素的主要成分,进入机体后快速诱发“炎症风暴”,导致弥漫性肺损伤,腹腔注射LPS制备ALI动物模型是目前常用的理想方法[17,18]。本研究发现,ALI模型制备24 h后,小鼠动脉血pH值和PaO2明显降低,BALF中IL-1β、TNF-α和IL-6的含量明显增多,肺组织出现ALI典型的病理学改变,肺损伤评分、W/D比值、MPO活性明显升高,提示本研究制备ALI模型成功。
近年来研究显示miRNA在ALI的发生发展中发挥重要的调控作用。Li等[19]在研究中发现miR-33低表达参与了LPS诱导的ALI的发病机制。过表达miR-146b可以有效地抑制LPS诱导的ALI小鼠的炎症反应,减轻肺组织损伤[20]。miR-16通过调节TLR4/NF-κB通路和减轻炎症反应,对小鼠ALI具有显著的保护作用[21]。Wang等[22]发现miR-19缺陷的小鼠肺组织更容易受到炎症反应的影响,恢复miR-19能够减轻LPS诱导的ALI的炎症反应。研究发现miR-126与机体多种疾病的炎症及免疫反应有关[23,24],近期基因芯片技术发现包括miR-126在内的多个miRNA在ALI大鼠模型肺组织中表达降低[11],miR-126在ALI肺组织中表达降低是否与炎症反应有关尚不清楚。本研究中我们通过qRT-PCR也发现ALI组小鼠肺组织miR-126表达明显降低。进一步我们通过对ALI小鼠尾静脉注射miR-126模拟物成功上调ALI小鼠肺组织中miR-126的表达,结果显示,小鼠动脉血气分析明显改善,BALF中IL-1β、TNF-α和IL-6的含量明显减少,肺组织病理学改变明显减轻,肺损伤评分、W/D比值、MPO活性明显降低,提示上调miR-126能够抑制ALI的炎症反应,改善小鼠的肺组织损伤。
近期研究发现,miR-126能够通过靶向调控HMGB1抑制高糖环境下内皮细胞[25]和视网膜细胞[26]的炎症反应。本研究中我们也发现ALI小鼠肺组织中HMGB1蛋白的表达明显升高。为了探索miR-126对ALI炎症反应的抑制作用是否与其对HMGB1的调控有关,我们发现上调miR-126表达后,ALI小鼠肺组织HMGB1蛋白的表达明显降低,提示上调miR-126对ALI小鼠肺组织的炎症反应的抑制作用可能与其对HMGB1的调控有关。HMGB1是一种进化上高度保守的非组蛋白染色体结合蛋白,已经被证实在致死性的系统性炎症反应中发挥着调节炎性介质的作用。HMGBl刺激促炎细胞因子的释放,反之,促炎细胞因子也能促进HMGBl的释放[27],形成了一个能够放大炎症反应的正反馈环。Abraham等[28]发现直接在小鼠气管内注射HMGB1后会出现中性粒细胞聚集,肺水肿及IL-1β、TNF-α和MIP-2分泌的增加。研究发现,在内毒素引起的ALI中,HMGB1激活NF-κB转录引起的炎性因子水平的增加,导致肺血管渗透性的增加[29,30],从而引起ARDS。特异性阻断HMGB1可明显减轻LPS引起的损伤,Gong等[31]证实了HMGB1拮抗剂通过减少促炎因子的产生,对LPS导致的ALI小鼠有显著保护作用。
综上所述,miR-126在ALI小鼠肺组织中呈现异常低表达,上调miR-126能够减轻ALI小鼠肺组织的炎症反应,其机制可能与其对HMGB1的抑制有关,为ALI的治疗提供了新的研究方向。
