痰标本mecA 和Sa442 基因的定量PCR 检测结果与MRSA培养结果的关联
2021-04-13蔡骁垚林堃银闫佩毅
蔡骁垚,林堃银,孙 涛,张 立,闫佩毅,金 姝,
1.同济大学附属普陀人民医院中心实验室,上海200060;2.同济大学附属普陀人民医院检验科,上海200060
金黄色葡萄球菌是一种重要的致病菌,耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)在金黄色葡萄球菌中的分离率已超过40%[1-2],无菌体液中MRSA培养阳性可以作为MRSA感染的诊断依据。痰标本作为非侵入性标本,其检测对病原学诊断有重要参考意义[3]。因此,痰标本MRSA培养阳性对感染诊断也有重要的参考意义[4]。痰液培养的周期为48~72 h;即便是质谱技术,也需要培养出菌落才能进行质谱鉴定,需时约24 h。聚合酶链反应(polymerase chain reaction,PCR)可以在数小时内获知是否有MRSA基因的存在,其检测结果早于细菌培养结果;但是,临床对于痰标本MRSA 的PCR 检测结果的指导意义尚不清楚[5]。本研究中,我们定量检测痰标本中MRSA 的耐药基因mecA、金黄色葡萄球菌种基因Sa442,同时进行痰标本的培养,分析定量PCR(quantitative PCR,qPCR)检测结果与细菌培养结果的关联;并通过对耐药基因的定量检测预判细菌培养结果,便于更早期地指导临床诊疗工作。
1 材料与方法
1.1 菌株、试剂及引物
收集2017 年5 月—2018 年5 月同济大学附属普陀人民医院入院送检的痰标本,共筛选出1 775 例合格痰标本。标准菌株ATCC33591,购于美国典型培养物保藏中心(American Type Culture Collection,ATCC),为MRSA标准菌株,常用于抗菌药物研发;细菌基因组DNA 提取试剂盒(DP302)购于天根生化科技(北京)有限公司;UNG 酶和Premix Ex TaqTM(2×)购自瑞士罗氏公司;引物和探针均由上海基康生物技术有限公司合成。
1.2 方法
1.2.1 痰细菌培养鉴定 挑取痰标本的脓性部分涂片,革兰染色,显微镜观察,平均每个低倍(10×)视野下鳞状上皮细胞数<10 个、白细胞>25 个为合格痰标本。痰标本中加入等体积的0.1%DTT 的磷酸缓冲液,涡旋混匀后37 ℃孵育液化30 min。涂布于血平板上,5%CO2、35 ℃过夜培养。平板上见菌落生长,菌落出现β 溶血、血浆凝固酶试验和触酶试验均阳性,鉴定为金黄色葡萄球菌,用全VITEK2 Compact自动细菌鉴定及药敏分析仪(美国生物梅里埃公司)分析鉴定为MRSA。同时用头孢西丁纸片法复核:按标准K-B(Kirby-Barer)法进行,挑取单个菌落,调整菌悬液浊度为0.5 MCF,均匀涂布于M-H药敏试验琼脂平板,贴上30 μg 头孢西丁纸片,在35 ℃下培养16~18 h,抑菌环直径≤21 mm判定为MRSA。
1.2.2 qPCR 检测 qPCR 绝对定量检测复苏标准菌株ATCC33591,稀释成浓度(CFU/mL)为5×108、5×107、5×106、5×105、5×104、5×103、5×102的细菌悬液,提取基因组DNA,作为定量标准品。提取痰液样本的DNA。本实验使用的引物以及探针序列如下[6]。mecA-F:5'-GGT TACGGACAAGGTGAAATACTGA-3'; mecA-R: 5'-GTG TCTTTTAATAAGTGAGGTGCGTTA-3';mecA探针:5'-FAMCCAGTACAGATCCTTTCTAQMAN-MGB-3'。Sa442-F:5'-CTGTAGCTTCTTTATCCATACGTTGAA-3';Sa442-R:5'-TTCACATCGTTGTGTTGAAAAACTT-3';Sa442探针:5'-FAM-ATTGTACGATTCTGACGCACCATCTTTTGCTMAR A-3'。反应体系:上下游引物(20 μmol/L)各0.6 μL、探针(20 μmol/L)0.3 μL、PCR Mix(2×)10 μL、DNA模板2 μL、UNG(1 U/μL)0.5 μL、H2O 5.9 μL。反应条件:40 ℃10 min;95 ℃10 min;95 ℃10 s,60 ℃31 s(采集荧光),72 ℃1 s,40个循环;40 ℃10 s反应终止。以2种基因qPCR反应中均出现典型的扩增曲线且CT值≤35为MRSA阳性。
1.3 统计学方法
采用SPSS17.0 统计软件进行数据分析。率的比较采用四格表描述,P<0.05表示差异有统计学意义。
2 结果
2.1 绝对定量qPCR
标准细菌株菌悬液倍比稀释浓度为(5×102~5×108)CFU/mL 时,细菌浓度与检测的CT值有较好的线性关系,相关系数R2>0.99(图1)。标准株细菌提取DNA 后,以细菌DNA 拷贝数为横坐标,qPCR 的CT值为纵坐标绘制标准曲线,通过此标准曲线计算痰样本中的细菌数量,从而绝对定量测定痰标本中细菌量。
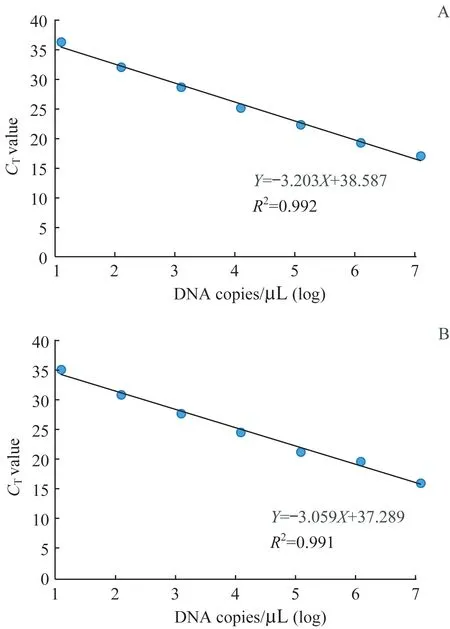
图1 mecA(A)和Sa442(B)基因qPCR的标准曲线Fig 1 Standard curve of qPCR of mecA(A)and Sa442(B)genes
2.2 常规细菌培养和qPCR检测
经常规细菌培养,MRSA 阳性标本64 例,阳性率为3.61%(64/1 775);经qPCR 检测,MRSA 阳性237 例,阳性率为13.35%(237/1 775)。1 775 例标本中,3.32%(59/1 775)细菌培养和qPCR检测结果均为阳性,86.37%(1 533/1 775)细菌培养和qPCR 检测结果均为阴性,细菌培养和qPCR 结果相符者占89.69%(1 592/1 775)。以细菌培养鉴定结果为金标准,qPCR 检测的灵敏度为92.19%(59/64),特异度为89.60%(1 533/1 711),阳性预测值为24.89%(59/237),阴性预测值为99.67%(1 533/1 538),可作为排除MRSA 检出的指标。qPCR 检测阳性样本中,mecA 定量对数值分布于(5.04±1.26) ~(6.23±1.23)[对应CT值为(25.30±3.75)~(29.17±3.77)]。
2.3 受试者操作特征曲线分析对预测MRSA 培养结果的提示
mecA 阴性的标本可以排除MRSA 的存在,绘制受试者操作特征(receiver operating characteristic,ROC)曲线(图2),分析mecA 定量对数值对于细菌培养阳性的预测价值,可见曲线下面积为0.755,标准误为0.037(95% CI 0.682~0.827),最佳临界值为5.59,敏感度和特异度分别为72.4%和70.2%,阳性预期值和阴性预期值分别为44.2%和88.65%。在没有定量值的情况下,以CT值绘制ROC 曲线,曲线下面积为0.770,标准误为0.035(95% CI 0.701~0.839),最佳临界值为27.1,敏感度和特异度分别为73.0%和74.1%,阳性预期值和阴性预期值分别为47.25%和89.66%。
2.4 不同mecA 和Sa442基因检测结果对应不同的细菌培养结果

图2 mecA定量对数值(A)以及CT值(B)的ROC曲线Fig 2 ROC curve of mecA quantitative value(A)and CT value(B)
将1 775例标本根据基因检测结果分为4组:1 170例mecA-Sa442-、48 例mecA-Sa442+、320 例mecA+Sa442-、237 例mecA+Sa442+,分析每组中总的细菌培养阳性率、不同细菌的检出率与菌株数。仅Sa442阳性时,细菌培养结果以甲氧西林敏感的金黄色葡萄球菌(methicillinsusceptible Staphylococcus aureus, MSSA) 为 主; 当mecA 和Sa442 均为阳性时,细菌培养阳性率为50.63%,以MRSA为主。统计结果见表1和图3。

表1 mecA和Sa442基因检测结果及所对应的细菌培养结果Tab 1 Bacterial culture results corresponding to different results of gene mecA and Sa442

图3 不同mecA和Sa442基因检测结果所对应的细菌培养结果Fig 3 Bacterial culture results corresponding to different mecA and Sa442 gene results
3 讨论
《2018 年全国细菌耐药监测报告》[7]指出,临床标本(主要来源于痰、尿、血标本,分别占41.5%、18.8%、9.2%)细菌检验中,革兰阳性菌分离率最高的为金黄色葡萄球菌,MRSA 检出率为30.9%,其中上海市最高(46.8%)。金黄色葡萄球菌中检出耐药基因mecA 或其编码的耐药蛋白青霉素结合蛋白2a (penicillin binding protein 2a,PBP2a),是检出MRSA 的金标准[8]。Sa442基因为金黄色葡萄球菌种基因[9]。mecA 和Sa442 基因同阳性时,可判定MRSA 检测阳性[10]。与常规细菌培养相比,MRSA 的qPCR 检测有明显的时间优势,且阳性检出率显著高于常规培养[11-12]。有研究报道[13],qPCR 和培养法分别检测鼻拭子的MRSA,两者的一致性很高,在患者应用抗生素的情况下qPCR 法的结果更可能为阳性。本研究数据表明,在痰MRSA 的检测中,qPCR 检测与常规细菌培养相符率为89.69%,阴性预测值达到99.67%。qPCR 可检测出更多的阳性标本,具有更高的灵敏度和准确度[14-15]。
本研究采用ROC曲线分析,发现当mecA定量对数值为5.59 时,MRSA 培养阳性率为72.4%,特异度为70.2%,ROC 曲线下面积为0.755。如果用ROC 曲线分析CT值,CT值为27.1 时,其预判MRSA 培养阳性的灵敏度为73.0%,特异度为74.1%,曲线下面积为0.770。一般来说曲线下面积在0.7~0.9 表示诊断价值中等,因此细菌培养阳性的标本中,约73%的标本mecA 定量对数值>5.59,或者Ct 值<27.1。细菌培养阴性的标本中,70%~73%的mecA 定量对数值<5.59,或者Ct 值>27.1。因此,能在细菌培养结果明确之前,利用分子诊断技术早期对培养结果有一个预判。当面对一份痰培养MRSA 阳性结果时,临床医师有较丰富的经验将其用于诊疗工作中;但是,对于痰PCR 的阳性结果,由于其显著增高的阳性率,指导临床诊疗尚需要谨慎。分析痰PCR 结果的定量值与培养结果的关系,用于预判培养的结果,使得临床医师更容易理解PCR结果,用于指导临床诊疗。
不同的mecA和Sa442基因检测结果,对应不同的细菌培养结果。Sa442为金黄色葡萄球菌的种的特异基因,当痰PCR检测结果仅出现Sa442基因阳性时,极少培养出常见的革兰阴性杆菌(如肺炎克雷伯菌、鲍曼不动杆菌),多为MSSA 培养阳性。而仅mecA 基因阳性时,培养结果为鲍曼不动杆菌占优势,但尚未见鲍曼不动杆菌携带mecA基因的报道。仅有文献[16]报道,鲍曼不动杆菌含有7种PBP,不包含mecA基因表达产物PBP2a。因此,出现单一mecA 基因阳性可能为样本中的条件致病菌即凝固酶阴性的葡萄球菌携带mecA基因导致。当mecA和Sa442均为阳性时,细菌培养阳性率显著上升,以MRSA培养阳性为主。当mecA和Sa442基因均为阴性时,细菌培养阳性率仅为7.18%,以肺炎克雷伯菌培养阳性为主。
用qPCR 法检测痰标本中的MRSA 时,一份阴性的qPCR结果(mecA-Sa442-)意味着细菌培养的阳性率较低(7.18%),且可能以肺炎克雷伯菌为主,几乎可以排除MRSA 存在;一份单阳性PCR 结果(mecA-Sa442+、mecA+Sa442-) 说明细菌培养的阳性率会成倍增加(14.58%和20.00%),分别以MSSA 或鲍曼不动杆菌为主;当PCR 结果为mecA 和Sa442 均阳性时,细菌培养阳性率达50.63%,以MRSA为主。并且,当mecA定量对数值>5.59 或者Ct 值<27.1 时,与MRSA 培养阳性有较好的一致性。
综上,qPCR 技术显著提高了MRSA 检测的灵敏度,阴性和阳性结果均可以从不同角度为临床提供可能的细菌培养的信息。本研究为qPCR 技术更可靠地应用于临床提供了理论依据。
