3株石油降解菌鉴定与降解特性研究
2021-04-12张宝宝余天飞艾加敏柳晓东姜影影邓振山
张宝宝,余天飞,艾加敏,王 华,柳晓东,姜影影,邓振山
(延安大学 生命科学学院,陕西 延安 716000)
石油是一种粘稠状、深褐色的液体[1],其成分复杂,主要成分为烃类、非烃类化合物以及少量的有机金属化合物[2]。石油在开采加工的众多环节中,难免会泄露到土壤中,影响植物生长及微生物群落结构,对生态环境造成严重破坏。石油具有高粘度、高黏着力的特性,并且具有疏水性,因此会与土壤粘连在一起,阻塞土粒孔道,影响土壤的透水、透气能力,并且石油还会侵蚀土壤,导致土层物理性质改变,使土壤盐碱化、板结概率增大[3]。对石油污染土壤中生长的植物研究发现,石油会附着在植物根系表面,形成黏膜,降低植物的根系呼吸、物质转运和养分吸收,当石油浓度较大时,会造成植物根系腐烂,严重的还会导致植物死亡[4]。石油污染会引起土壤中的有机碳含量明显增加,影响土壤中的微生物生长和繁殖,导致微生物群落结构失调,对土壤中的微环境产生一定的破坏[5]。
目前处理石油污染的方法主要有物理、化学、生物修复法。物理法因其成本较高、处理不彻底等问题,目前未能普及应用;化学法往往会造成二次污染,修复效果不理想[6]。生物法是近些年兴起修复方法,主要有协同修复法、微生物降解法,其修复效果明显,对环境干扰较小,已成为处理石油污染主要修复的方法。
细菌、真菌、放线菌和藻类等各种类群中都发现具有石油降解能力的生物[7]。目前国内外研究报道能够降解石油微生物主要有:假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、红球菌属(Rhodococcus)放线菌属(Actinomyces)、红酵母属(Rhodotorula)、镰刀菌属(Fusarium)和小球藻(Chlorellavulgaris)、芽孢杆菌属(Bacillus)、无色杆菌属(Achromatobacteria)[8]。
微生物降解石油主要在水-油界面进行,表面活性剂可以将石油乳化为更小的颗粒,从而可以扩大石油与微生物的接触面积,提高石油降解效率[9]。生物表面活性剂是一种微生物在生长过程中产生的一种双亲性化合物,具有降低油脂表面张力、乳化油脂,增强微生物表面的疏水性等作用[10],通过卷曲、增溶和洗脱三大作用,能够扩大石油与土壤微生物的接触面积,提高菌株对石油的降解效率,并且生物表面活性剂可降解、绿色环保[11]。因此筛选出既能产生表面活性剂又能降解石油的微生物,是当前微生物修复法关注的热点[12]。
陕北地区位于黄土高原中心区域,生态环境十分脆弱,同时陕北地区也是国家重要能源化工基地,石油资源丰富,但同时石油污染严重,因此处理陕北地区石油污染需要采取一种高效、绿色环保的修复手段。基于此,本研究对3株石油降解菌进行鉴定,研究其降解特性,进一步丰富石油降解菌菌种资源,为微生物修复石油污染应用于实际生产提供保障。
1 材料与方法
1.1 材料
1.1.1 原油、菌株及试剂
实验所用原油采自陕西宝塔区青化砭镇(36°78′45″,109°57′63″,暖温带大陆季风性气候)。
试验菌株由延安大学生命科学学院提供,由微生物实验室-80℃冷冻甘油管保存,试验菌株为3株,分别编号为HZ-01、HZ-02、HZ-03。
C2Cl4购自南京化学股份有限公司,Na2SO4、NaOH、NaCl均购自天津市科密欧化学试剂有限公司。
1.1.2 供试培养基
(1)PYG培养基:牛肉膏3.0 g,蛋白胨5.0 g,酵母膏0.2 g,葡萄糖5.0 g,NaCl 0.5 g,MgSO4·7H2O 1.5 g,蒸馏水1000 mL,pH 7.2~7.5,121℃灭菌20 min,配制固体培养基需另加入15.0 g-20.0 g琼脂。
(2)无机盐培养基:NaCl 10.0 g,NH4Cl 0.5 g,KH2PO40.5 g,K2HPO41.0 g,MgSO40.5 g,CaCl20.02 g,KCl 0.1 g,蒸馏水1000 mL,pH 7.0,121℃灭菌20 min。
(3)石油培养基:在无机培养基中加入1%(v/w)的原油,121℃灭菌20 min。
1.1.3 主要仪器
AL204电子天平(梅特勒·托利多仪器有限公司)、T-960PCR仪(力康生物科技有限公司)、岛津UV-1780紫外可见分光光度计(东莞瑞高电子科技有限公司)、Oil-480红外分光测油仪(北京华夏科创仪器有限公司)。
1.2 方法
1.2.1 菌株的活化
将-80℃甘油管冷冻保藏的菌株,接种到PYG固体养基上,放入25℃恒温培养箱中培养24 h,然后挑取单菌落,接种到PYG培养基上,培养24 h,重复以上步骤3次,可得到纯菌落,将得到纯菌株,4℃保藏试管斜面中,作为种子菌种,供后续试验使用。
1.2.2 菌悬液制备
将种子菌种接种到PYG液体培养基中,160 r/min,30℃培养48 h,吸取OD600 1.5的发酵液10 mL,然后将发酵液经8000 r/min,离心5 min,重复3次,用生理盐水反复冲洗3次,收集菌体,再用无菌水混合,吹打至悬浮液,可制得所需菌剂。
1.2.3 菌株的鉴定
(1)16S rDNA分子生物学鉴定
采用菌落PCR对3株菌进行16S rDNA分子生物学鉴定,将3株菌分别接种到牛肉膏蛋白胨固体培养基上,30℃,培养24 h,然后挑取单菌落置于规格为1.5 mL灭菌离心管中,加入5 μL溶液Ⅱ(0.2 mol/L NaOH,1%SDS),PCR仪95℃反应5 min,当温度达到16℃时取出,加入无菌水至100 μL,颠倒混匀,吹打成悬浮液,扩增菌株16S rDNA序列时,吸取2 μL为模板;扩增16S rDNA序列引物为:
P15′-CGGGATCCAGAGTTTGATCCTGGTCAGAACGAACGCT-3′
P65′-CGGGATCCTACGGCTACCTTGTTGTTACGACTTCACCC-3′
PCR反应体系(2×EsMasterMix(Dye)25 μL,P12 μL,P62 μL,模板DNA 2 μL,ddH2O 19 μL)和反应条件(预变性94 ℃,5 min;变性94 ℃,30 s;退火54 ℃,30 s;延伸72 ℃,30 s;终延伸72 ℃,3 min;循环数:30)均参照康为世纪公司所生产的2×EsMasterMix(Dye)所提供的体系和条件扩增,部分条件稍有改动。
PCR扩增产物用1%琼脂糖凝胶,90 V水平电泳30 min,用凝胶成像系统拍照检查扩增结果。扩增产物送至上海生工进行测序,测序结果在NCBI数据库进行BLAST比对,用软件MEGA-X构建发育进化树,测序数据上传至GeneBank,申请菌株序列登录号。
(2)菌株的生理生化实验
参考文献方法[13]对3株菌株进行生理生化试验,选取革兰氏染色、接触酶、明胶液化、甲基红试验、V.P试验等。
1.2.4 菌株的生长曲线绘制
将菌剂接种到PYG液体培养基中,30℃,160 r/min培养,每隔2 h取4 mL菌悬液,用紫外分光光度计测定在波长为600 nm处吸光度,一直持续至50 h,每次重复3次,以生长时间为横坐标,以平均吸收值为纵坐标,绘制菌株的生长曲线。
1.2.5 菌株产表面活性剂检测
柴油-苏丹Ⅲ混合液制备:用电子天平准确秤取苏丹Ⅲ0.05 g,并溶于100 mL柴油中,滤纸过滤,除去杂质,并于121℃灭菌25 min,供后期使用。将菌悬液分别接种到PYG液体培养基中,30℃,160 r/min培养48 h,使用菌离心管分装,10000 r/min离心5 min,去除沉淀,保存上清液,重复离心3次。取9 cm灭菌培养皿,加入15 mL去离子水,滴入200 μL柴油-苏丹Ⅲ混合液,使其形成油膜,覆盖在去离子水表面,待油膜稳定后,用微量移液器吸取2 μL发酵上清液滴入油膜中心,测量排油圈直径,以未接种培养基为空白对照[14]。
1.2.6 菌株抗逆性试验
(1)菌株pH试验
用1 mol/L NaOH和1 mol/L HCl调节基础培养基的pH值,起始pH值分别为:3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,盐度为2.0%,分装至250 mL三角瓶,每个瓶中加入1 mL菌剂,30℃,160 r/min培养48 h,以未接菌剂液体PYG液体培养基为空白对照,然后使用紫外可见分光光度计测定吸收值,每个梯度重复3次。
(2)菌株盐度试验
用NaCl调节基础培养基的盐度,起始盐度分别为:0%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%、8.0%,pH为7.0,分装至250 mL三角瓶中,每个瓶中加入1 mL菌剂,30℃,160 r/min培养48 h,以未接菌剂PYG液体培养基为空白对照,然后使用紫外可见分光光度计测定吸收值,每个梯度重复3次。
1.2.7 石油降解率的测定
在石油培养基中分别加入OD600=1.0的菌悬液,30℃,160 r/min振荡培养,隔5 d测量1次石油浓度,每个样品重复3次,以未加菌剂为空白对照。采用Oil-480型测油仪测量石油降解率,每个样品用10 mL C2Cl4萃取3次,合并萃取液,将萃取液用烘干48 h Na2SO4吸收多余水分,然后转移至容量瓶中,用C2Cl4定容至50 mL,测定其浓度。
1.2.8 室内模拟修复
从延安大学文汇山采0.5 m处泥土,过100目筛子,分装到20 cm×40 cm的塑料盒中,每个塑料盒中分别装2.0 kg泥土,称取20.0 g原油用100 mL石油醚溶解稀释,将稀释液与泥土充分搅拌,使其混匀,通风橱内风干,使石油醚完全挥发,模拟石油污染的土壤。每个样品中加入发酵液,每隔5 d测1次石油浓度,每次测量每个样品取5样点,每个样点取10.0 g土壤,将5个样点样品泥土充分混匀,测量样品中的石油浓度。
2 结果与分析
2.1 菌株鉴定结果
菌株的16S rDNA序列扩增结果在紫外凝胶系统拍照结果(图1A)所示,结果显示,3株菌株16S rDNA PCR序列扩增产物的大小均为1500 bp左右,测序结果上传至NCBI数据库,进行BLAST比对,HZ-01与Bacilluscereus(KX242264.1)同源性为99.79%,HZ-02和HZ-03与Bacillushalotolerans(MF988692.1)同源性分别为99.86%和99.72%,使用MEGA软件中N-J方法构建系统发育树(图1B和C)。
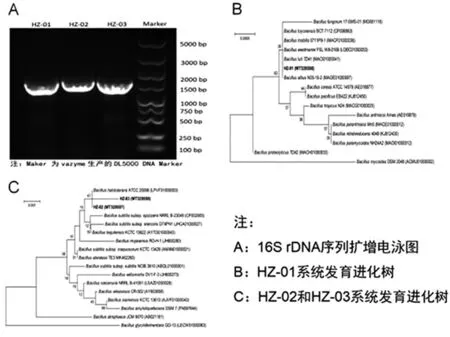
图1 菌株16S rDNA鉴定结果
菌株生理生化试验结果(表1),3株菌株经革兰氏染色,3株菌均为革兰氏阳性菌,明胶液化、淀粉水解、接触酶3株菌均为阳性。V.P和M.R试验HZ-01和HZ-02均为阴性,HZ-03为阳性;3株菌均能利用葡萄糖产酸,其中HZ-03还能利用乳糖。
结合菌株的生理生化特性,初步确定HZ-01属于蜡状芽孢杆菌(Bacilluscereus),HZ-02、HZ-03属于嗜盐芽孢杆菌(Bacillushalotolerans),根据结果构建3株菌株的系统发育树。将其上传至GenBank申请序列登录号,分别为HZ-01:MT328556,HZ-02:MT328557,HZ-03:MT328558。
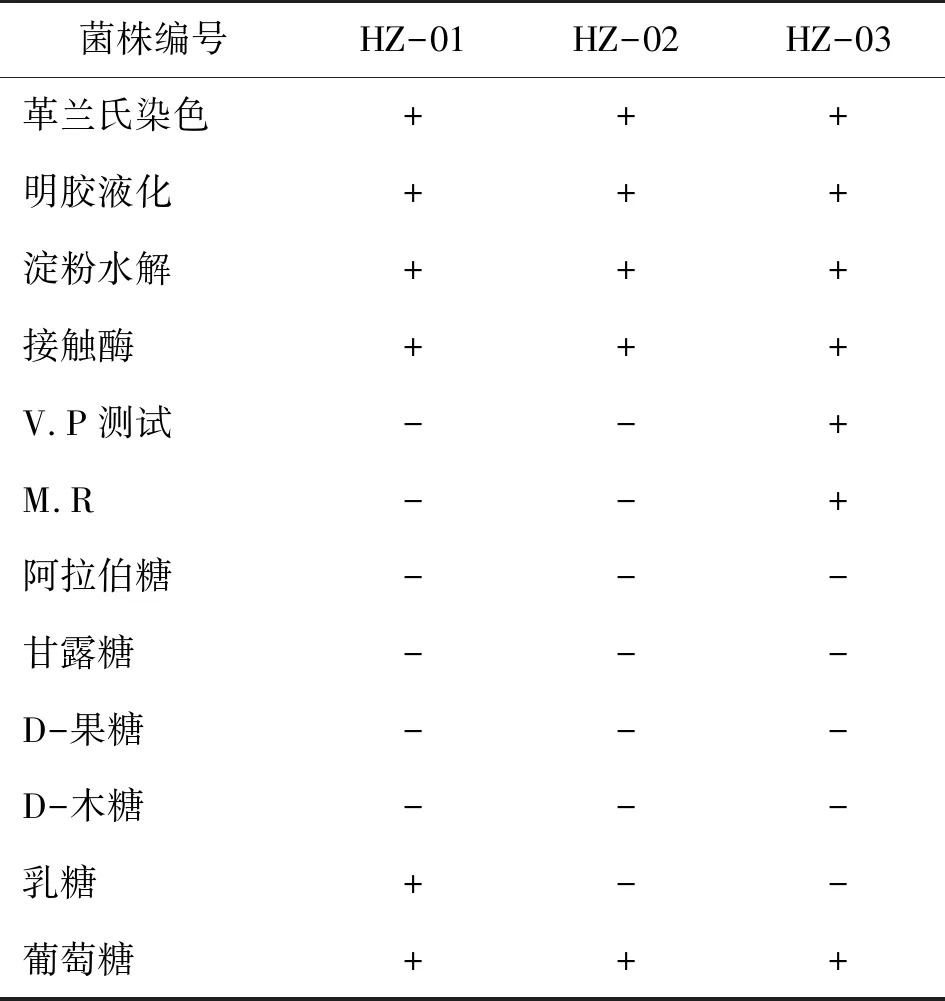
表1 石油降解菌生理生化指标
2.2 菌株产表面活性剂结果
表面活性剂能够将原油乳化为小颗粒,改变油滴表面张力,可以提高微生物降解石油效率。因此通过测定排油圈的大小,间接反映菌株产表面活性剂的能力,如图2所示。试验表明,HZ-01产表面活性剂能力最强,三者排油圈直径分别为:HZ-01为5.68 cm,HZ-02为4.50 cm,HZ-03为3.12 cm。

图2 3株菌排油圈
2.3 菌株的生长曲线
通过摇瓶试验培养绘制了3株石油降解菌的生长曲线(图3),在相同培养条件下,HZ-01菌株相对于HZ-02菌株和HZ-03菌株生长较好,并且3株菌株均在4-36 h生长速度较快时,在40 h时达到到达生长稳定期。

图3 石油降解菌生长曲线
2.4 菌株抗逆性测试试验
2.4.1 菌株的pH试验结果
高酸碱的环境可以抑制微生物对营养物质的吸收,成为限制微生物的主要环境因素,合适的pH是菌株正常生长的条件之一。菌株的pH试验如图4所示,结果表明,HZ-01最适生长pH为8.0,HZ-02和HZ-03最适生长pH为7.0。3株菌的耐受范围均为pH 4.0-pH 10.0,耐受范围广,可以适应陕北地区大部分地区。
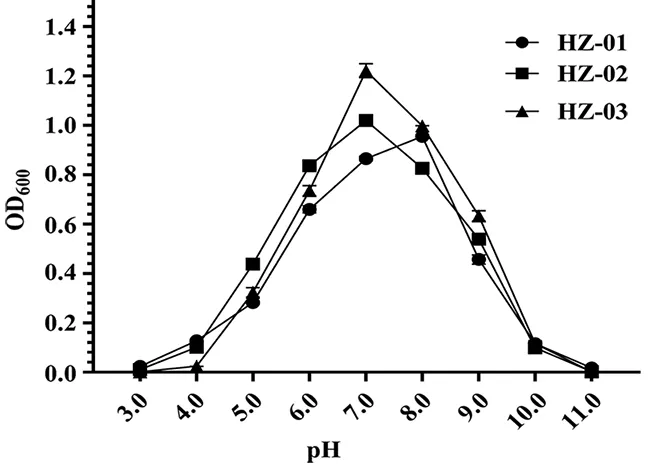
图4 菌株的pH试验结果
2.4.2 菌株的盐度试验
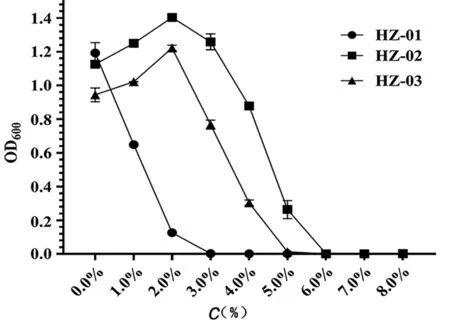
图5 菌株的盐度试验结果
合适的盐度是菌株正常生长的条件之一,3株菌株耐盐度试盐如图5所示。3株菌株均能对高盐度有较好的耐受性,HZ-02和HZ-03最适盐度为2.0%,HZ-02可耐受盐度为6.0%,HZ-03可耐受盐度为5.0%,HZ-01可耐受盐度为3.0%。细菌内部是一个半封闭的生理环境,内部环境需要与外界进行物质交换,高盐度可以导致渗透压的改变,而渗透压的改变会直接影响到菌株的生长,甚至会导致菌株的死亡。
2.5 石油降解效率
不同菌株降解石油能力各有差异,3株石油降解菌的降解效率如图6所示,在石油初始浓度为10000 mg/L的条件下,经过30 d的处理,添加HZ-01、HZ-02和HZ-03的原油培养基中石油浓度(c)分别为2782.5 mg/L、5767.0 mg/L和3045.9 mg/L,石油降解率为72.18%、42.33%和69.54%。在修复的0-5 d内,微生物处于适应期,降解效效果不明显;在5-20 d中,微生物适应了培养基环境,菌体生长旺盛,代谢效率高,石油降解效果明显,培养基已由清亮变得浑浊,原油大部分被乳化;20 d后,受营养底物含量和次生代谢产物的限制,菌体生长速率减慢,代谢活动受到相应的抑制,石油降解率趋于平缓。

图6 菌株石油降解效率测定结果
2.6 室内模拟修复
室内模拟修复结果如图7所示,在初始石油浓度为10000 mg/kg模拟石油污染土壤,分别添加HZ-01、HZ-02和HZ-03,经过30 d的室内模拟修复,样品中的石油浓度分别为3717.8 mg/kg、5047.9 mg/kg和4168.8 mg/kg,石油降解率为62.82%、49.52%和58.31%。与石油培养基测定石油降解率相比,土壤的微环境复杂,石油降解菌营养物质的获取依赖外源添加,室内模拟修复中各菌株的降解石油能力均有所下降。
3 讨论与结论
目前,微生物在环境修复中已有很多应用,在处理石油污染方面有了很多的研究。石油降解菌株的筛选是石油污染微生物修复的基础与前提,受到人们广泛关注。本研究中从石油污染的土壤中分离的3株石油降解菌,HZ-01可耐受盐度为3%,HZ-02和HZ-03可耐受盐度分别为5%和6%,H-02和HZ-03具有很好的耐盐性,3株菌pH耐受范围为pH 4.0-pH 10.0,HZ-01、HZ-02和HZ-03可适应陕北石油开采大多数区域。
采用柴油-苏丹Ⅲ测量排油圈直径,相比于用石蜡油测量,柴油黏度较小,形成的油膜稳定,灵敏度高;HZ-01、HZ-02和HZ-03排油圈直径分别为5.68 cm、4.50 cm和3.12 cm,石油降解率分别为72.18%、42.33%和69.54%。与李晓娜等[15]从石油污染的土壤中分离出能产表面活性剂的石油降解菌XB(Bacillussp.),其排油圈直径为3.6 cm,石油降解率为72.30%相比,HZ-01与XB降解性能基本持平,但在产表面活性剂方面,HZ-01优于XB;本研究中采用Oil-480型红外测油仪直接测出石油浓度,除了直接使用红外测油仪法,大多数研究者都采用紫外法、重量法、色谱法等方法,不同的方法在应用时也各有利弊,在选择时,应根据自己试验的目的,选择出适合自己的方法[15],使用红外测油仪,高效、易操作,并且误差较小[16]。受土壤微环境和营养底物的影响,与采用石油培养基测定菌株降解效率相比,室内模拟修复中的各菌株的石油降解效率均有所下降。
然而,本研究仅对菌株表面活性剂进行初步研究,后期还应对表面活性剂化学组成进行定性和定量分析,以及菌株是否存在一些功能基因。如:单加氧酶、双加氧酶基因[17]进行鉴定;还需要对菌株进行油藏环境模拟实验,以评定其在真实环境中的降解效果。
