17β-雌二醇注射雌性金钱鱼下丘脑转录组分析
2021-04-11石红娟茹笑影刘玉琪伍旭辉李广丽江东能
石红娟,茹笑影,刘玉琪,郑 芸,伍旭辉,黄 洋,李广丽,江东能
(1.广东海洋大学水产学院//2.广东省名特优鱼类生殖调控与繁育工程技术研究中心,广东 湛江 524088;3.金湖县人民医院,江苏 淮安 211600)
下丘脑是调节机体和内分泌活动的重要神经中枢,也是神经内分泌的重要枢纽。作为一个重要的内分泌器官,下丘脑直接分泌多种神经内分泌激素,调控垂体中激素的分泌及其靶腺的活动,包括体温控制、睡眠、生理节律、生殖和生长等[1-3]。性类固醇激素雌激素在动物的生殖和生长发育过程中扮演重要的角色。在哺乳类,雌激素参与调控雌性卵巢生殖细胞囊破裂和初级滤泡形成[4]。在鸟类、爬行类、两栖类和鱼类等低等脊椎动物,雌激素是参与性别决定与分化的重要因子[5-9]。此外,雌激素还参与调控机体生长激素(Growth hormone,GH)的合成与分泌。在人类,雌激素17β-雌二醇(17β-Estradiol,E2)能显著上调垂体中生长激素GH的分泌[10]。在鱼类,雌激素也能调控垂体中GH的合成和分泌[11-13]。在尼罗罗非鱼(Oreochromis niloticus)、马苏大马哈鱼(Oncorhynchus masou)和黑头软口鲦(Pimephales promelas)和金钱鱼(Scatophagus argus)中,高浓度雌激素E2或17α-乙炔雌二醇(17α-Ethinylestradiol,EE2)处理显著上调雌鱼垂体中ghmRNA表达[12-14]。研究发现,腹腔注射E2能显著上调金钱鱼垂体中ghmRNA的表达[15],但在体注射雌激素对下丘脑中基因表达的影响研究尚未见报道。
金钱鱼隶属于鲈形目(Perciformes)金钱鱼属(Scatophagus),主要分布在太平洋和印度洋,是我国东南沿海地区重要的经济品种。金钱鱼肉质鲜嫩,富含多种的营养物质,可为人体提供多种不饱和脂肪酸[14-18]。此外,金钱鱼个体适中、性成熟年龄短,具有明显的雌、雄生长二态性,雌鱼快于雄鱼。与此相一致,金钱鱼生长激素gh呈二态性表达,雌鱼垂体中gh表达显著高于雄鱼[13]。在金钱鱼人工养殖过程中,雌、雄鱼性腺发育不同步,雌鱼卵泡不能充分发育成熟,需要施加适量催产素进行催产。因此,本研究通过开展转录组测序分析雌激素在体注射后对雌性金钱鱼下丘脑中基因表达的影响,以期为金钱鱼生长二态性和卵泡发育的机制研究提供新的思路。
1 材料与方法
1.1 实验动物
本实验所用的12尾2龄雌性金钱鱼均购于广东省珠海市育成鱼苗养殖有限公司,在广东海洋大学东海岛生物研究基地养殖。
1.2 活体注射外源雌激素
将雌性金钱鱼随机分为两组:对照组和E2(Sigma-Aldrich,美国)注射组。其中E2组金钱鱼腹腔注射4.0 g/L的E2乙醇溶液,每克体质量注射1 μL,对照组雌鱼注射等剂量无水乙醇。6 h后麻醉解剖,取下丘脑样品,液氮速冻,操作结束后转移至-80 ℃保存,用于提取下丘脑总RNA、进行转录组测序等后续实验。
1.3 提取总RNA
按照Trizol试剂盒(Invitrogen,美国)说明 书[14]提取雌鱼下丘脑总RNA。取1 μL总RNA用于质量分数1%的琼脂糖凝胶电泳检测,另取1 μL总RNA,利用Nanodrop 2000超微量核酸蛋白测定仪(Thermo Scientific,美国),测定浓度和质量,其余总RNA置于-80 ℃保存,备用。
1.4 RNA样品检测、文库构建及测序
RNA样品的纯度、浓度和完整性检测合格后,构建文库,具体流程如下:1)按照VAHTS®mRNA-seq V3 Library Prep Kit for Illumina试剂盒(诺唯赞,中国)说明书,用带有Oligo(dT)的磁珠富集真核生物mRNA;2)加入Fragmentation缓冲液将mRNA进行随机打断;3)以mRNA为模板,用六碱基随机引物合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA聚合酶I合成第二条cDNA链,利用AMPure XP beads纯化cDNA;4)纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择;5)最后通过PCR富集得到cDNA文库。然后,分别使用Qubit 2.0和Agilent 2100对文库的浓度和插入片段大小(Insert Size)进行检测,使用qPCR方法对文库的有效浓度进行准确定量,以保证文库质量。待库检合格后,用HiSeq X-ten进行高通量测序,测序读长为PE150。
1.5 差异表达基因筛选
HiSeq X-ten高通量测序平台对cDNA文库进行测序,获得以FASTQ格式存储的Raw Data,通过测序质量控制得到了Clean Data。然后,使用HISAT2比对系统将每个文库中的Clean reads与金钱鱼参考基因组(数据尚未公布,基因组大小为572.42 Mb,Contig N50 19.60 Mb,预测到24 256个基因)进行比对及后续的分析。利用RPKM(the reads per kb per million reads)法[19]计算每个基因在不同样本中的表达量。测序差异基因的检测方法,参照文献[20]对金钱鱼E2注射组和对照组进行差异表达分析。使用错误发现率(False Discovery Rate,FDR)来调整所得的P值的阈值,将|log2(FC)|≥1且FDR≤0.05作为差异表达基因检测过程中的筛选标准。其中对照组金钱鱼下丘脑转录组中RPKM≤1的基因,都归为本底表达基因(background expression),不再进行后续分析;RPKM>1,-1<log2(FC)<1且FDR>0.05的基因归为无差异表达基因(nondifferentially expressed genes);而RPKM>1,|log2(FC)|≥1且FDR≤0.05的基因归为上调(up-regulated)/下调(down-regulated)表达基因。
1.6 差异表达基因功能注释和通路富集分析
将筛选获得的差异基因,通过百迈客在线云平台(http://www.biocloud.net/),在线对差异表达基因进行MA图、火山图、GO功能注释和KEGG通路富集分析。
1.7 实时荧光定量PCR(Real-time quantity PCR,qPCR)验证差异表达基因
此实验所用的所有引物见表1。利用Primer 5.0设计差异基因prl、pgr特异的荧光定量引物,cyp19a1b、3β-HSDI和生长相关基因ghrh、sst1、sst3、sst5、sst6的引物序列参照[14-15,18]。采用qPCR检测雌性金钱鱼下丘脑中差异基因的表达。qPCR反应在实时荧光定量PCR仪(Roche,瑞士)上进行,根据试剂盒说明书进行:反应体系及程序设定参照文献[15]。β-actin为内参基因。运用2-ΔΔCt方法计算差异基因的相对表达量。数据表示为平均值±标准差(means±SD),6个生物学重复。采用SPSS 18.0进行单因素方差分析和Duncan多重比较,检验的显著性概率临界值为0.05。
2 结果与分析
2.1 下丘脑转录组测序质量评估
金钱鱼下丘脑转录组测序结果显示,总共获得Raw bases数目为57 019 996 730,高质量纯净序列Clean reads为190 909 756。测序质量统计结果表明,测序的质量值20(Q20)百分比均超过98%,质量值30(Q30)百分比均超过94%,GC含量所占比例在47.93%~48.38%(表2)。测序质量总体较好,可进行后续研究分析。
2.2 E2处理雌性金钱鱼下丘脑转录组分析
基因注释的结果显示,基于NR、Swissprot、KOG、KEGG和GO等 6个数据库,通过基因序列比对,共注释到金钱鱼下丘脑中17 687个基因,采用 EBSeq 软件分析获得对照组、E2注射组的差异表达基因集(RPKM>1,|log2(FC)|≥1和FDR≤0.05),结果显示筛选到22个差异表达基因,包括11个表达上调基因,11个表达下调基因,将筛选出来的差异表达基因绘制MA图及火山图(图1 A、B)。

图1 差异基因表达情况Fig.1 Differences of genes expression
2.3 E2注射雌性金钱鱼下丘脑中差异表达基因的筛选
基于E2注射组和对照组雌鱼下丘脑中基因RKPM值变化倍数,筛选到22个差异表达基因:prl(催乳素)、erf3α(真核肽链释放因子3α)、pde6h(磷酸二酯酶6H,cGMP特异,视锥,γ)、pgr(孕激素核受体)、lingo3(富含亮氨酸重复序列和免疫球蛋白结构域的与Nogo受体相互作用蛋白3)、zbtb4(锌指与btb结构域蛋白4)、cyp19a1b(细胞色素p450家族19亚家族a多肽1b)、nlrc3(核苷酸结合寡聚化结构域样受体蛋白3)、3β-HSD I(3β-羟类固醇脱氢酶Ⅰ)、arntl(芳香烃受体核转位蛋白)、pcdhαc2(原钙黏蛋白α-c2)、chsy1(硫酸软骨素合酶)、muc17l(黏蛋白17样蛋白)、prf1(穿孔素1)、hla-α(MhcⅠ类抗原)、nlrp12(Nacht富亮氨酸重复序列和Pyd结构域)、kcnt1(Na+激活K+通道)、tprg1l(肿瘤蛋白p63调节类因子1)、ifi44l(干扰素诱导蛋白44样蛋白)、cntn3(接触蛋白3)、scocob(短卷曲螺旋蛋白)和1个尚未注释基因(表3)。
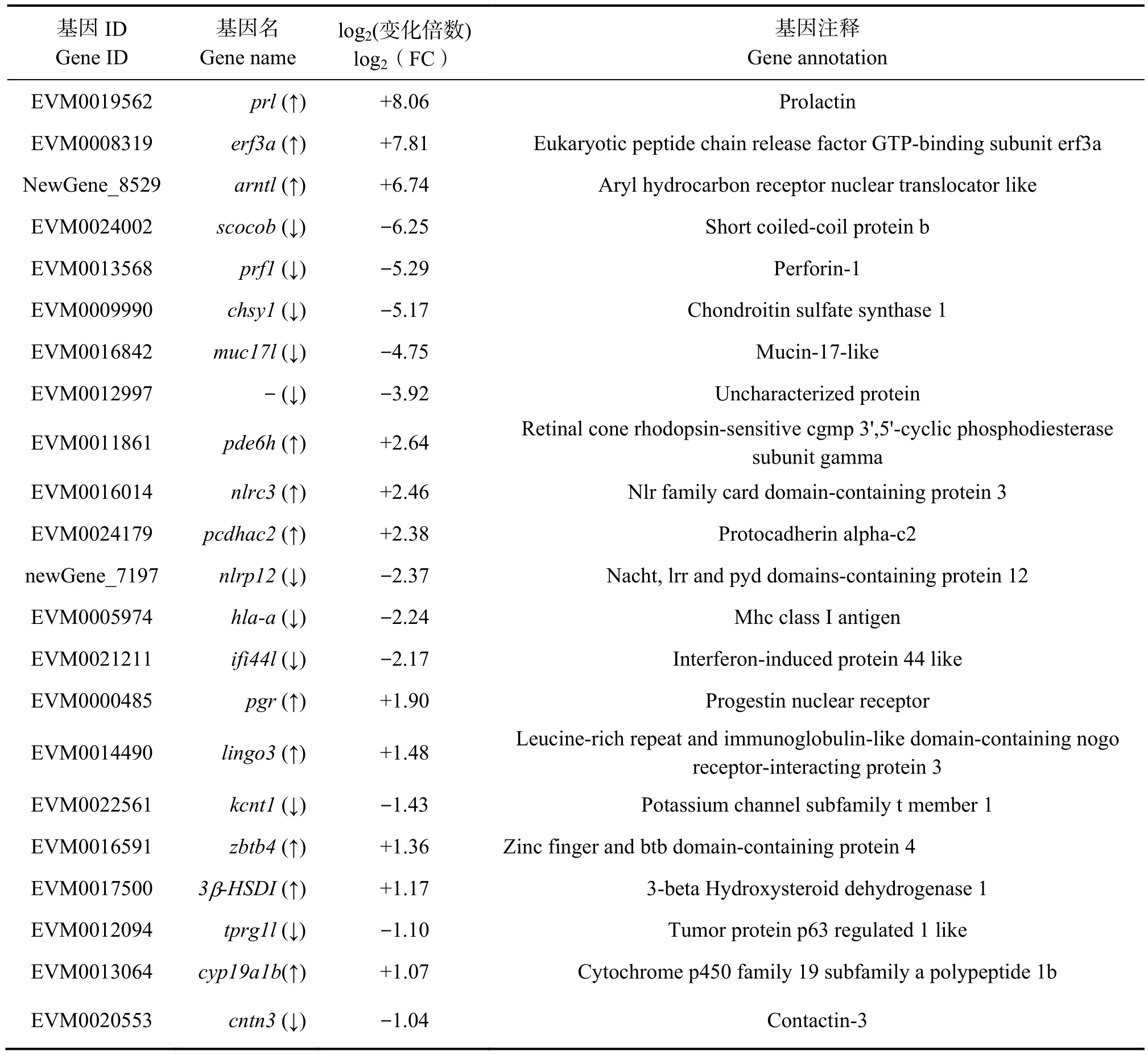
表3 筛选差异表达基因Table 3 Filter differentially expressed genes
2.4 E2注射雌性金钱鱼下丘脑中差异表达基因功能富集分析
基因GO功能富集分析结果显示,涉及生物学过程、细胞组分和分子功能这3大功能分类中54个功能小类。其中,差异基因涉及的生物过程有8个,包括细胞过程、代谢过程、发育过程等;细胞组分6个,包括细胞、细胞组分、膜组分等;分子功能2个,包括结合、催化活性等(图2)。

图2 差异表达基因的GO功能富集分析Fig.2 GO enrichment analysis of differential expression genes
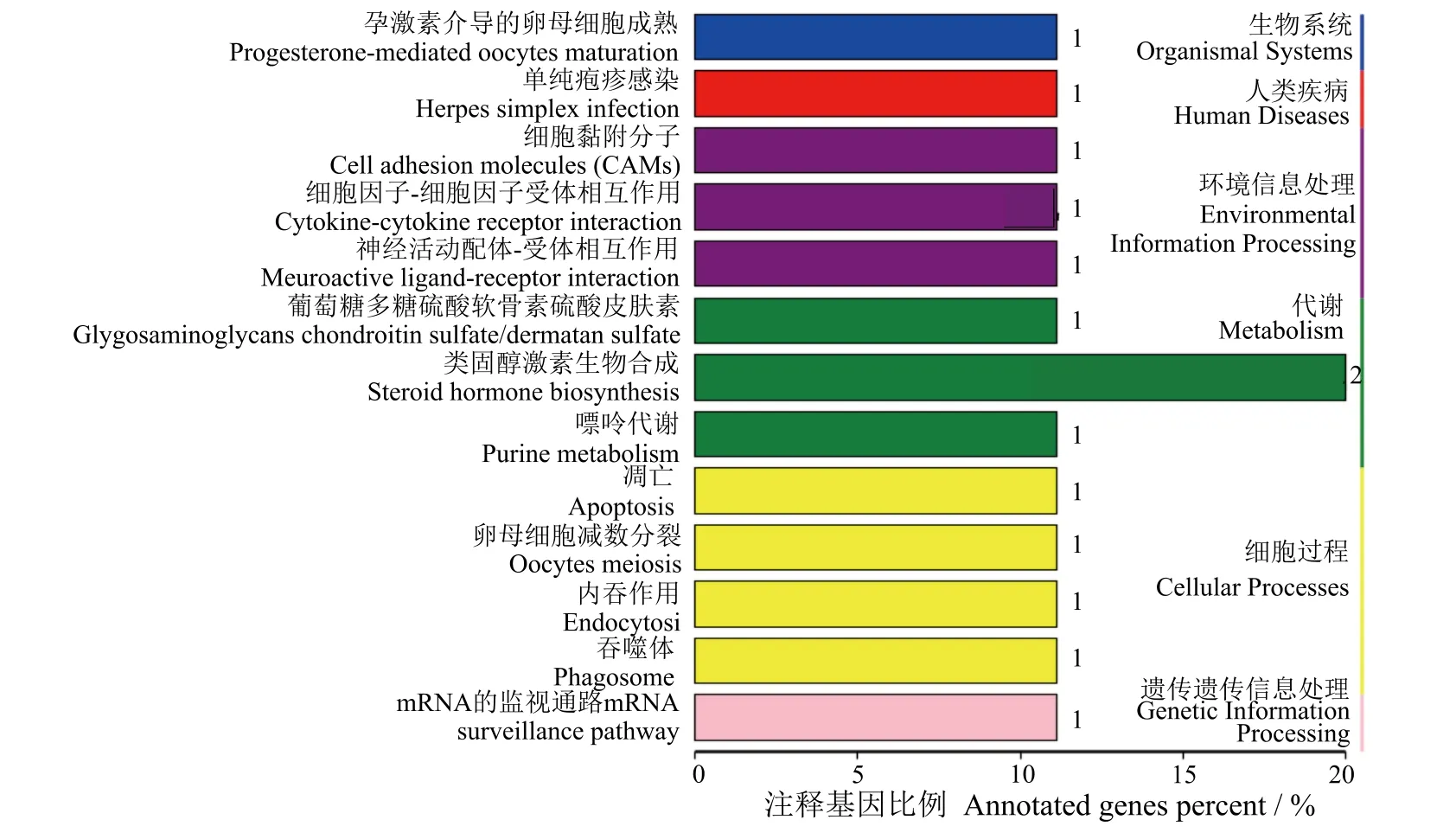
图3 差异表达基因的KEGG功能富集分析Fig.3 KEGG enrichment analysis of differential expression genes
进一步通过KEGG系统分析差异基因涉及的代谢途径结果(图3)显示,E2处理雌性金钱鱼下 丘脑转录组中的差异表达基因参与生物系统、人类疾病、环境信息处理、代谢、细胞过程和遗传遗传信息处理6大类,孕激素介导的卵母细胞成熟、单纯疱疹感染、细胞黏附分子、嘌呤代谢等13小类代谢通路。
2.5 E2对金钱鱼下丘脑中性类固醇激素和生长相关基因表达的影响
与下丘脑转录组结果相一致,qPCR结果显示,与对照雌鱼相比,E2注射组雌鱼下丘脑中prl、pgr、cyp19a1b和3β-HSDI的表达显著上调(图4)。
下丘脑转录组(图5 A)和qPCR(图5 B)结果显示,与对照雌鱼相比,E2注射组雌鱼下丘脑中,生长相关基因ghrh、sst1、sst3、sst5和sst6的表达无显著差异(P> 0.05)。

图4 雌鱼下丘脑中类固醇激素合成相关基因的表达Fig.4 Steroid genesis related genes expression in hypothalamus of female fish
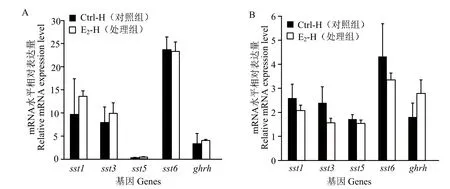
图5 雌鱼下丘脑中类固醇激素合成相关基因的表达Fig.5 Steroid genesis related genes expression in hypothalamus of female fish
3 讨论
雌激素在鱼类、两栖类、爬行类等低等脊椎动物的性别决定、性别分化过程中具有重要作用,同时也参与脊椎动物卵泡发育过程。此外,在生殖轴(下丘脑―垂体―性腺轴)中,雌激素通过反馈作用调节下丘脑的生理机能。在本研究中,E2在体注射雌性金钱鱼后,通过下丘脑转录组筛选到22个差异基因,包括prl、erf3α、pgr和cyp19a1b等11个表达上调基因和chsy1、muc17l、prf1和hla-α等11个表达下调基因,共涉及孕激素介导的卵母细胞成熟、类固醇激素生物合成、单纯疱疹感染、细胞黏附分子和嘌呤代谢等13个信号通路。
3.1 E2在体注射后对下丘脑中生殖相关基因表达的影响
在本研究筛选与鉴定的22个差异基因中,筛选到3个生殖相关信号通路基因:孕激素介导的卵母细胞减数分裂和卵泡成熟通路(pgr)、类固醇激素生物合成通路(cyp19a1b、3β-HSDI)。其中,孕激素受体Pgr介导孕激素在卵泡成熟和排卵过程中发挥重要功能,其表达主要受特异配体孕激素的调控。本研究qPCR和转录组结果表明,在鱼体注射E2能显著上调雌鱼下丘脑中pgrmRNA的表达。在金头鲷(Sparus aurata)中,研究发现E2能显著上调pgr的转录与表达[21-22]。因此,雌激素E2也可通过反馈作用激活下丘脑-垂体中pgr的表达。此外,本研究中E2在鱼体注射后,脑型芳香化酶基因cyp19a1b在下丘脑中的表达显著上调。同样,在其他硬骨鱼类中,研究发现E2能显著上调cyp19a1b的表达[23-26],其通过雌激素受体结合在cyp19a1b基因启动子的雌激素效应元件(estrogen response element,ERE)来激活cyp19a1b的转录[27-30]。同时,E2在鱼体注射后,下丘脑中性类固醇激素合成通路关键酶基因3β-HSDI的表达显著上调。这些结果表明,E2可通过反馈作用调节下丘脑中生殖相关基因的表达。
3.2 E2在体注射后对下丘脑中生长相关基因表达的影响
性类固醇激素,尤其是雌激素参与调控生长激素(GH)的分泌和合成。在金钱鱼中,前人研究发现,E2在鱼体注射6 h后,雌鱼垂体中生长激素ghmRNA的表达显著上调,肝脏中ghr1和igf1mRNA的表达显著下调,而下丘脑中ghrh表达未受影响[14-15,31]。垂体中生长激素gh的表达受到下丘脑中生长激素释放激素Ghrh和生长抑素Ss的调控。本研究中转录组和qPCR结果显示,E2在鱼体注射6 h后,下丘脑中生长激素释放激素ghrh和生长抑素sst1、sst3、sst5和sst6mRNA表达未受到影响。这表明E2可能在垂体和肝脏水平直接或间接地调控垂体中gh的表达,而非通过下丘脑水平。小鼠垂体细胞系GH3和MtT/S中的研究发现,雌激素能显著上调细胞系中GHmRNA的表达。同样,在雌激素受体ERα敲除小鼠中,垂体中GHmRNA表达水平显著降低,通过施加E2显著上调了GH的表达,这表明,E2可直接调控垂体中GH的表达和GH分泌[32]。此外,E2通过下调小鼠肝脏中GHR的表达减弱肝脏对生长激素的敏感度,从而下调肝脏中IGF1的表达,进而通过IGF1的负反馈作用间接上调垂体中GH的表达[10,33]。因此,E2还可在肝脏水平间接调控垂体中GH合成。在金钱鱼中,E2在鱼体注射6 h后,雌、雄鱼垂体中生长激素ghmRNA的表达显著上调,而肝脏中ghr1和igf1 mRNA的表达显著下调[15,31]。在欧洲鳗鲡(Anguilla anguilla)、尼罗罗非鱼、虹鳟(Oncorhynchus mykiss)、马苏大马哈鱼(Oncorhynchus masou)和黑头软口鲦(Pimephales promelas)中,高浓度雌激素E2或 EE2处理显著上调垂体中ghmRNA表 达[34-37],而肝脏中ghr1、ghr2和igf1mRNA的表达显著下调[11,38]。因此,和哺乳类一样,一方面,雌激素可在直接在垂体水平调控鱼类gh的表达;另一方面,雌激素通过降低肝脏中生长激素受体ghr表达降低其对GH的敏感度,同时下调肝脏中胰岛素生长因子igf1的表达,通过其负反馈作用间接调控垂体中gh的表达。
4 结论
E2注射后激活了金钱鱼下丘脑中生殖通路基因如pgr、cyp19a1b和3β-HSDI的表达,但下丘脑中生长轴相关基因生长激素释放激素基因ghrh和生长抑素基因sst表达未受到影响。E2主要通过在垂体和肝脏水平调节gh的表达,而非下丘脑水平。这对雌激素调控金钱鱼垂体gh二态性表达的分子机制研究具有重要的参考价值。
