基于SnO2/Sn/CH4两步法生产太阳能燃料的热力学研究
2021-04-09哈尔散巴依努拉合买提楼波王水安郑海红陈珍燕
哈尔散巴依·努拉合买提,楼波,王水安,郑海红,陈珍燕
(华南理工大学 电力学院,广东 广州 510640)
清洁能源对我国完善能源结构等具有重要意义,太阳能是丰富的可再生能源[1-2]。太阳能热化学(STC)技术具有太阳能燃料化、全光谱利用等优点[3],主要分为一步法、两步法和多步法[4],其中基于金属氧化物的两步法更具潜力[5-14]。
本研究基于SnO2/Sn甲烷还原与水分裂的两步STC循环,运用HSC化学热力学软件研究反应物配比nCH4/nSnO2和nH2O/nSn对反应平衡组分和反应温度的影响,得到压力、温度对产物选择性、燃料能量升级和太阳能燃料转换效率的影响规律。
1 太阳能热化学(STC)技术原理与方法
SnO2/Sn的STC碳还原循环因还原温度低更受人们青睐[15-18],典型的是甲烷还原循环,循环式如下:
SnO2+2CH4=Sn+2CO+4H2
(1)
Sn+2H2O=SnO2+2H2
(2)
本文用HSC化学热力学软件及其数据库进行了STC循环的热力学和平衡成分计算,STC(太阳能热化学)循环的能量分析则使用热力学第一、二定律进行。图1示出了基于SnO2/Sn的STC循环的循环流程图。CH4和SnO2在太阳能反应器中混合加热,产生CO、H2和Sn,然后将混合气体隔离引到氧化反应器,与通入预热的水蒸气进行反应,所产生的SnO2传输回还原反应器,形成循环。

图1 SnO2/Sn的STC循环流程图Fig.1 STC cycle flow chart of SnO2/Sn
某些物质,如烃类摩尔质量小于10-5,与其他主要成分相比可以忽略不计,因此本文中摩尔分数小于10-5的物质种类不包括在平衡组成分析中。计算基于吉布斯自由能理论,假设反应达到稳态下,将反应吉布斯能量变化最小化以预测平衡组分。另外,假设太阳反应器是一个绝热的等温黑体腔反应器,忽略热传导和热对流的能量损失,只考虑辐射损失。太阳能反应器的吸收效率(ηabs)定义如式(3):
(3)
其中,I为地球表面的太阳能辐照强度,受天气、季节、时间等影响,本文采用1 000 W/m2;C为太阳能聚光比;σ为Stefan-Boltzmann常数。
加热进入还原反应器的反应物(CH4和SnO2)和进行还原反应所需的吸热量可根据以下方程式确定:

(4)
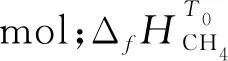
根据式(5)估算输入太阳能反应器(Qsolar反应器)的总能量:
(5)

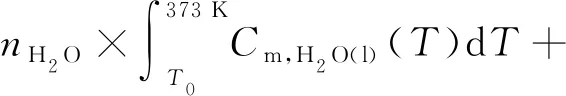
(6)
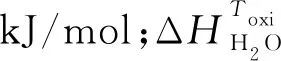
CH4转化率(χCH4)和生产选择系数(S)的换算率由以下表达式定义:
χCH4=(nCH4,ini-nCH4,eq)/nCH4,ini
(7)
SC=nC,eq/nCH4,ini
(8)
SH=nH,eq/2nCH4,ini
(9)
式中,SC为含碳产物的选择系数;SH为含氢产物的选择系数;nc,eq为含碳物质的平衡数量,mol;nH,eq为含氢物质的平衡数量,mol。
由于整个循环的净反应是2CH4+2H2O→ 6H2+2CO,其为吸热反应,故生产的燃料比甲烷原料具有更高的能量。太阳能转化为燃料化学能的程度可以用能量升级因子(U)和太阳能转化为燃料效率太阳能来衡量,其计算式如下:
(10)
ηsolar-to-fuel=
(11)
式中,U为能量升级因子;HHV为某种物质高位发热量,kJ/mol;ηsolar-to-fuel太阳能燃料转换效率。
2 结果与讨论
2.1 还原温度
图2为R=0和R=2(CH4/SnO2为R)两种状况下SnO2分解的吉布斯自由能。
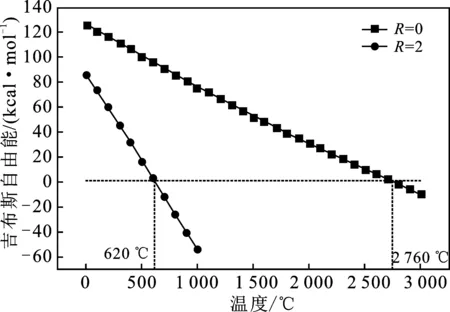
图2 R=0和R=2时SnO2分解的吉布斯自由能变化Fig.2 Gibbs free energy variation of SnO2 decomposition when R=0 and R=2
由图2可知,CH4对SnO2还原温度(Tred)有降低的作用。当R=0时,该反应能进行的温度达到还原温度(Tred)2 760 ℃,而利用CH4作为还原气体,在R=2时,SnO2的分解所需的TH从2 760 ℃减少到620 ℃,明显降低。因此,引入CH4作为还原剂,使还原温度大大降低,使热化学循环能在实际工程中变得可行,另一方面加剧了热还原过程,降低热化学循环时间。
2.2 还原过程
2.2.1 产物选择性分析 Hah等[18]在1 000 ℃下进行了批量实验,用连续流动的CH4流过暴露的SnO2粉末,测到生成H2和CO质量分数分别为83.9%,14.0%。本文在相同工况下模拟计算结果H2和CO质量分数分别为83.0%,16.0%,理论计算与实验结果非常接近。
本模拟计算中将CH4/SnO2比值R选取1~10范围来研究SnO2完全反应所需的Tred(还原温度)以及平衡组分变化,得到系统中的平衡组分组成见图3,即SnO2、SnO、Sn、CH4(g)、CO2(g)、CO(g)、C、H2(g)平衡组成变化。

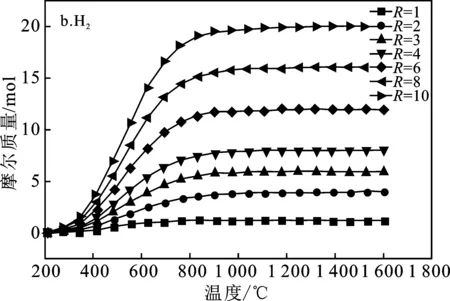
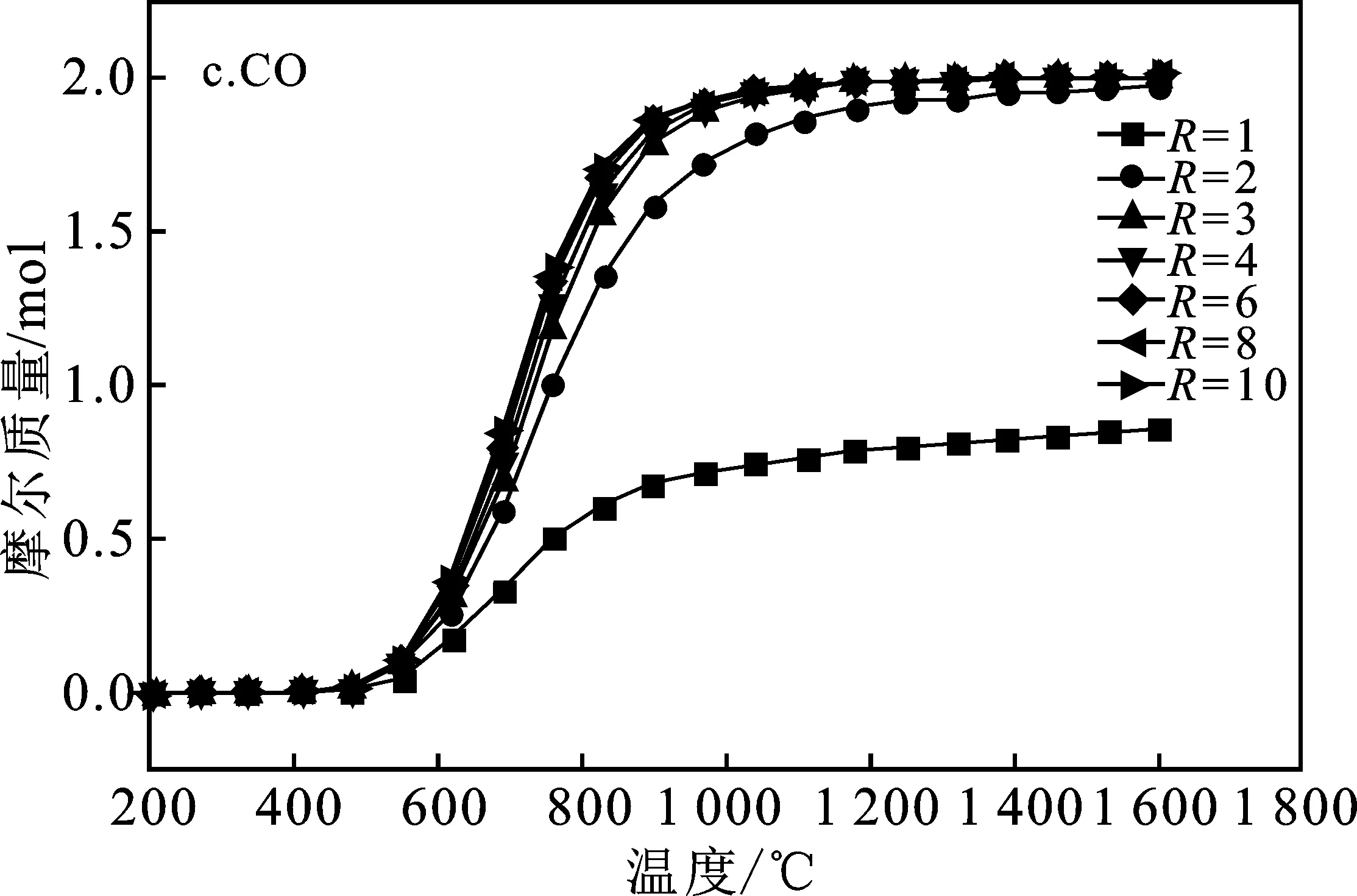


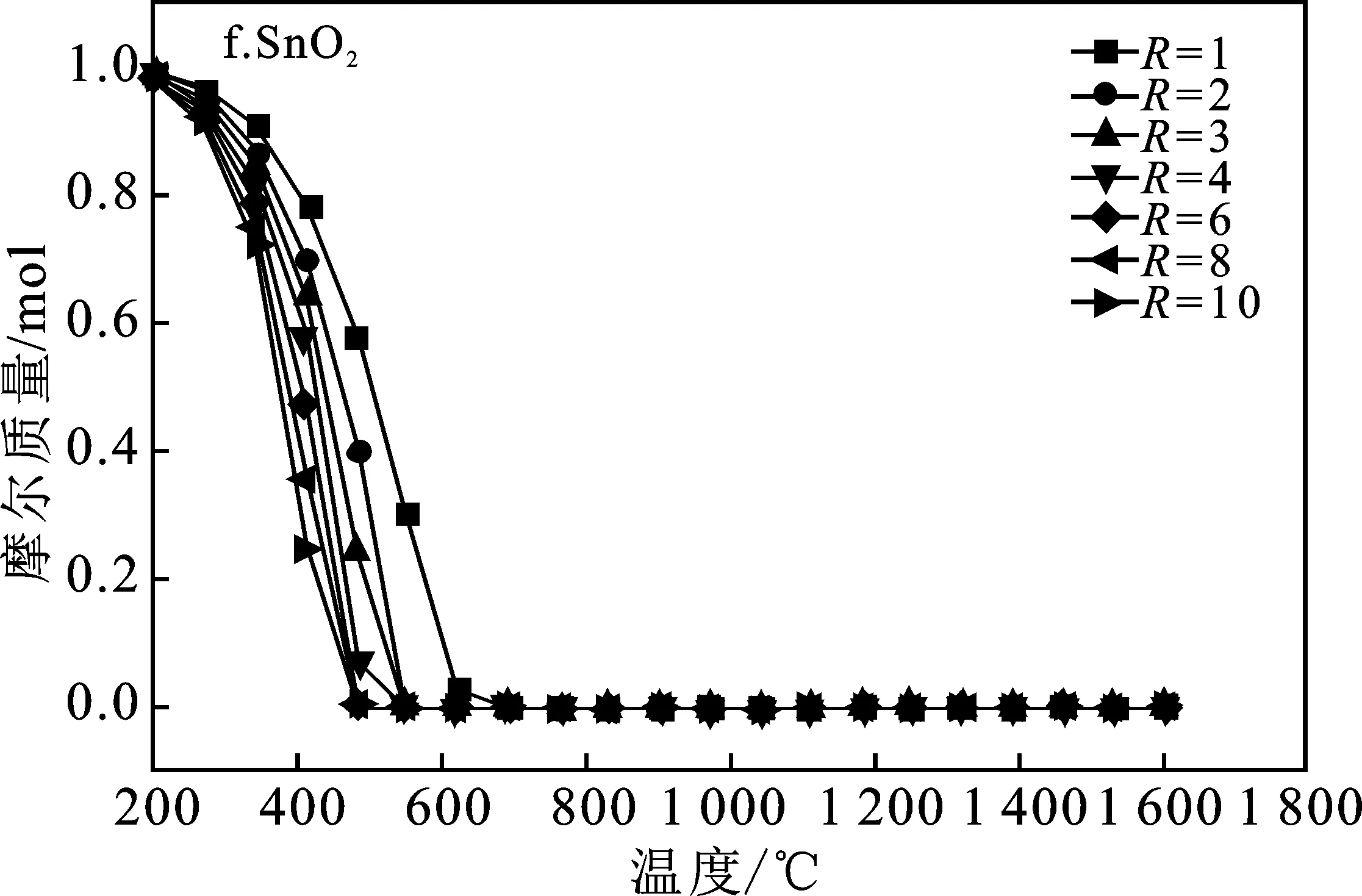
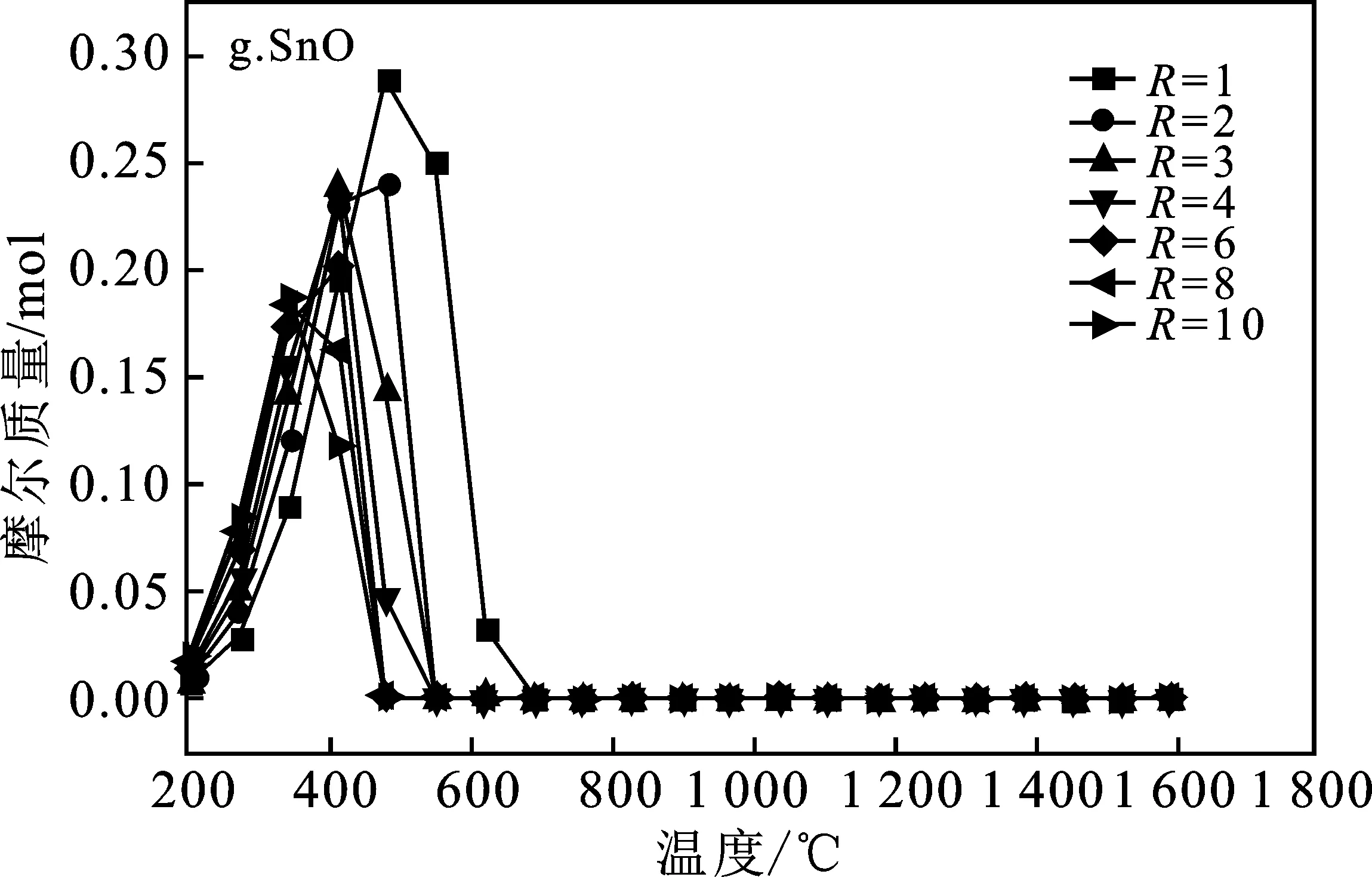
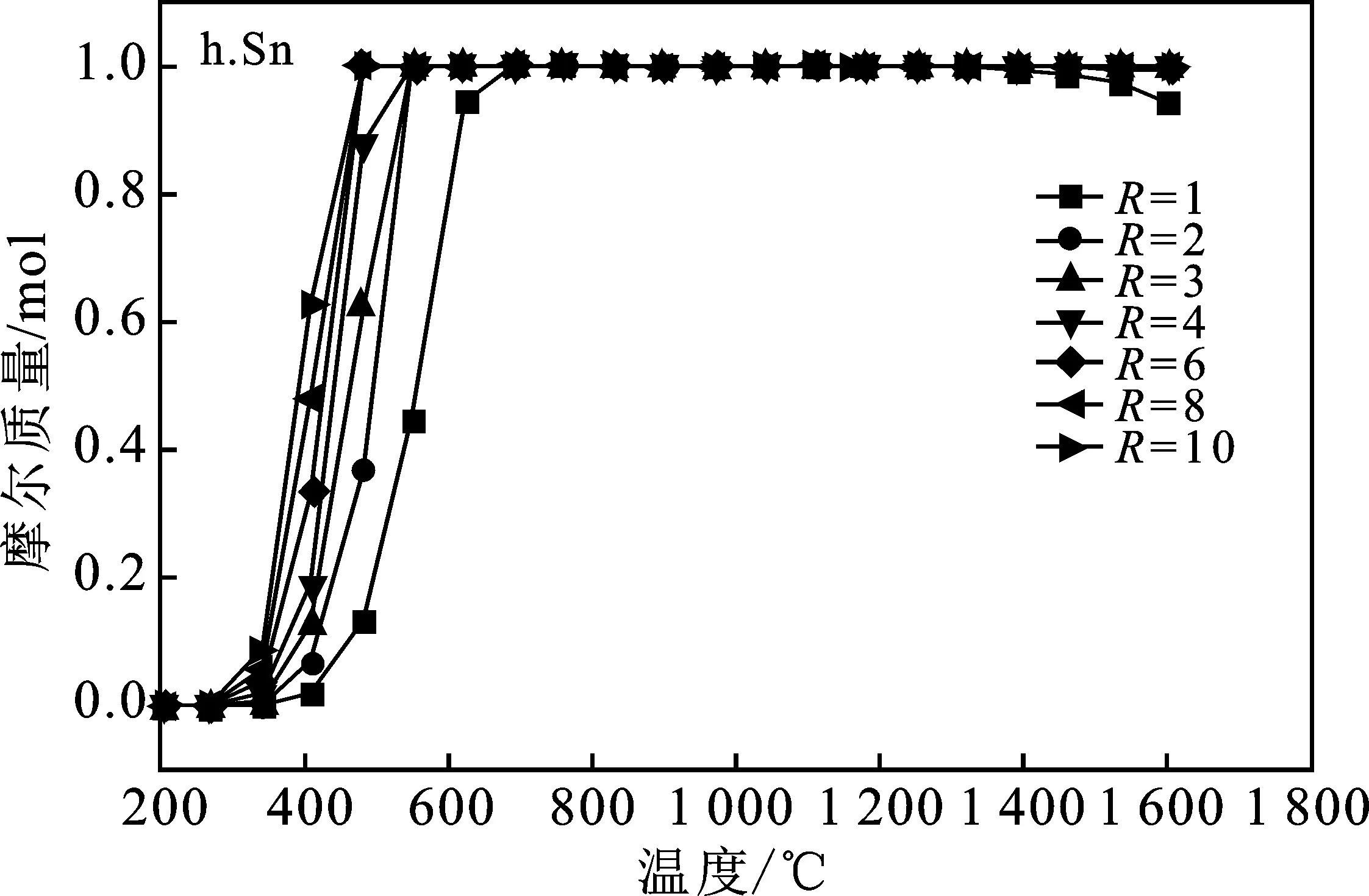
图3 SnO2和CH4系统中SnO2、SnO、Sn、CH4(g)、CO2 (g)、CO(g)、C、H2 (g)平衡组成变化Fig.3 Changes in equilibrium composition of SnO2,SnO,Sn,CH4 (g),CO2 (g),CO(g),C,H2 (g) in SnO2 and CH4 systems
由图3a可知,随着还原温度(Tred)的升高,CH4转化率增加,温度达到950 ℃时完全转化。图3b中随着温度升高到800 ℃,H2的浓度达到最大值并趋于稳定,但随着R的不断增大,H2的最大产量也不断增大。图3c显示,还原温度(Tred)高于600 ℃时CO才开始产生,CO随着Tred增加,超过950 ℃,达到最大值,并保持稳定。而且随着R的增加,CO产量增加很快,R>2以后 最大值几乎没有变化,这是因为当R=1时,由于CH4不足,产物中的CO会还原剩余SnO2导致CO减少CO2量增多。图3d表明,当R≤2时,由于CH4不足,这种情况下C的量随着Tred先增加然后减小到0。当R>2时,C的最大值随着R的增大而增大,即充足的CH4容易导致金属氧化物的表面产生大量的炭黑,可能使反应物失活。由图3f、3g可知,不管R为多少,在700 ℃后SnO2完全反应,不产生SnO。图3中各平衡成分显示趋势表明,按化学当量比R=2时,只要Tred=950 ℃,可以完全反应得到2 mol CO和4 mol H2,几乎没有副产物,可认为是最佳还原工况。
SH2和SCO是太阳能热化学燃料生产的关键参数,图4为在不同R下SH2和SCO的变化趋势。
由图4可知,当R≥2时,SH2曲线几乎相似,SH2随着Tred增加逐渐上升到达1。而当R=1时,SH2随着Tred增加缓慢上升稳定到0.6,这是由于还原剂CH4不足而导致的。由图4b可知,当R≥2时,SCO在Tred增加620 ℃后逐渐增加,并且随着R增大,还原剂CH4过多,SCO的最大值减小。当R≥2时,SH2变化很小,几乎为1;而SCO在R=2时最大值为1,R为其他值时,SCO均小于1。从理论上来说,(SH2+SCO)越大意味着在相同的太阳能和CH4输入下,可以生产更多的太阳能化学燃料。根据上述的分析,本研究还原步骤的物料比R=2时为最佳工况。


图4 SH2(a)和SCO (b)在不同R下的变化情况Fig.4 The variation of SH2(a) and SCO (b)under different R
2.2.2 还原反应器中压力对产物的影响 图5为还原反应器中压力p=101.3~911.7 kPa(1~9 atm)H2和CO的产量图。
由图5可知,随着还原反应器中的压力增加,相同还原温度下,H2和CO产率均降低,或者说,维持H2和CO同样产率,所需的还原温度增加。其原因是压力升高,使生成物气体浓度增大,不利于反应的继续进行,要获得到高的气体燃料产率,就必须及时把气体排出,维持还原反应器的低压运行。


图5 不同压力下p(1~9 atm)下CO(a)和H2(b)的产量情况Fig.5 CO(a) and H2(b) production under different pressure p(1~9 atm)
2.3 水分解氧化过程
图6为不同物料比X(H2O/Sn为X)下水分解反应的H2和SnO2量的变化图。
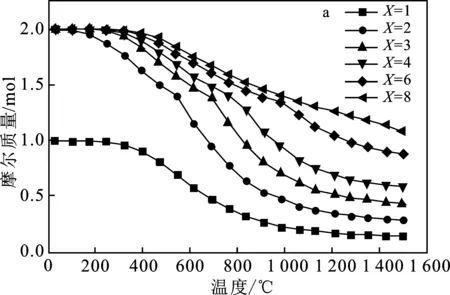
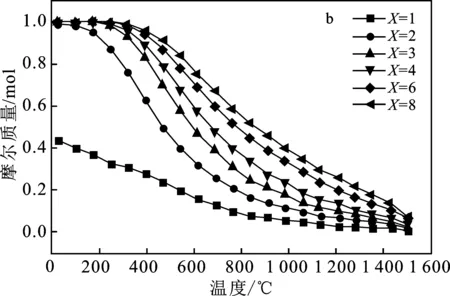
图6 水分解反应中在不同X下H2(a)和SnO2(b)量的变化Fig.6 Changes of H2(a) and SnO2(b) quantities in water decomposition reactions under different X values
由图6可知,SnO2和H2的量随着氧化温度(Toxi)的上升而下降,这是因为Sn水分解氧化为放热反应。当X=1时,nH2和nSnO2的最大值分别为1.0,0.44 mol。当X≥ 2时,nH2和nSnO2的最大值分别为2.0,1.0 mol,在任何给定的X下,Sn都完全反应,但是随着Toxi的上升,X越大,下降越缓慢。可知增加水蒸气的量,有助于提高SnO2的回收率和更高的产氢性能。
2.4 能量升级因子
根据上述优化结果,关于能量升级因子和能量转换效率的讨论都是基于R=2、p=0.1 MPa(1 bar)情况。能量升级因子(U)大于1,说明产生的气体燃料的能量比输入的CH4的能量要大,即能量升级了,还原反应中有较多的H2O、C和CO2等副产物生成,会使能量升级因子变小。图7为X=2,4,6,8条件下U变化图。

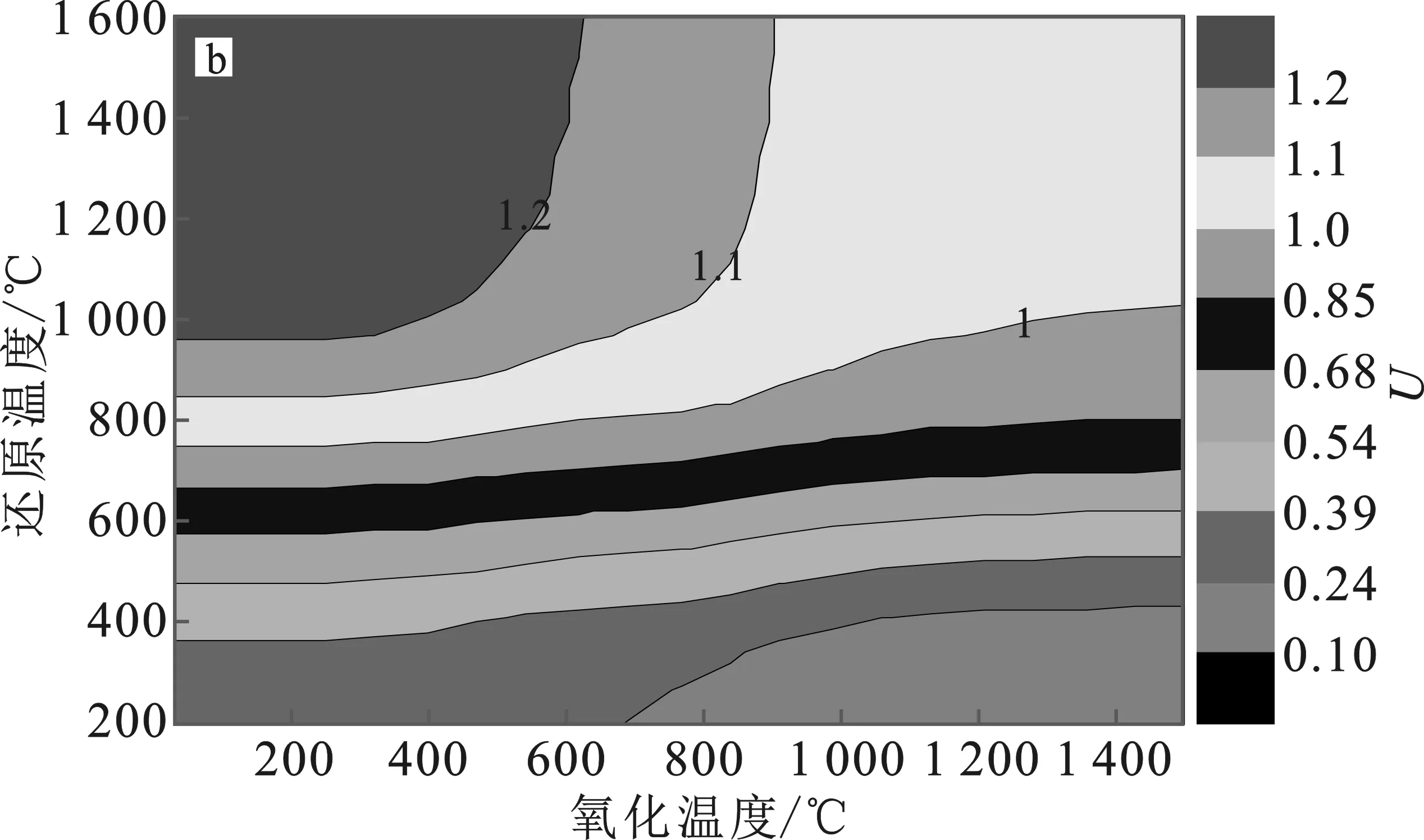
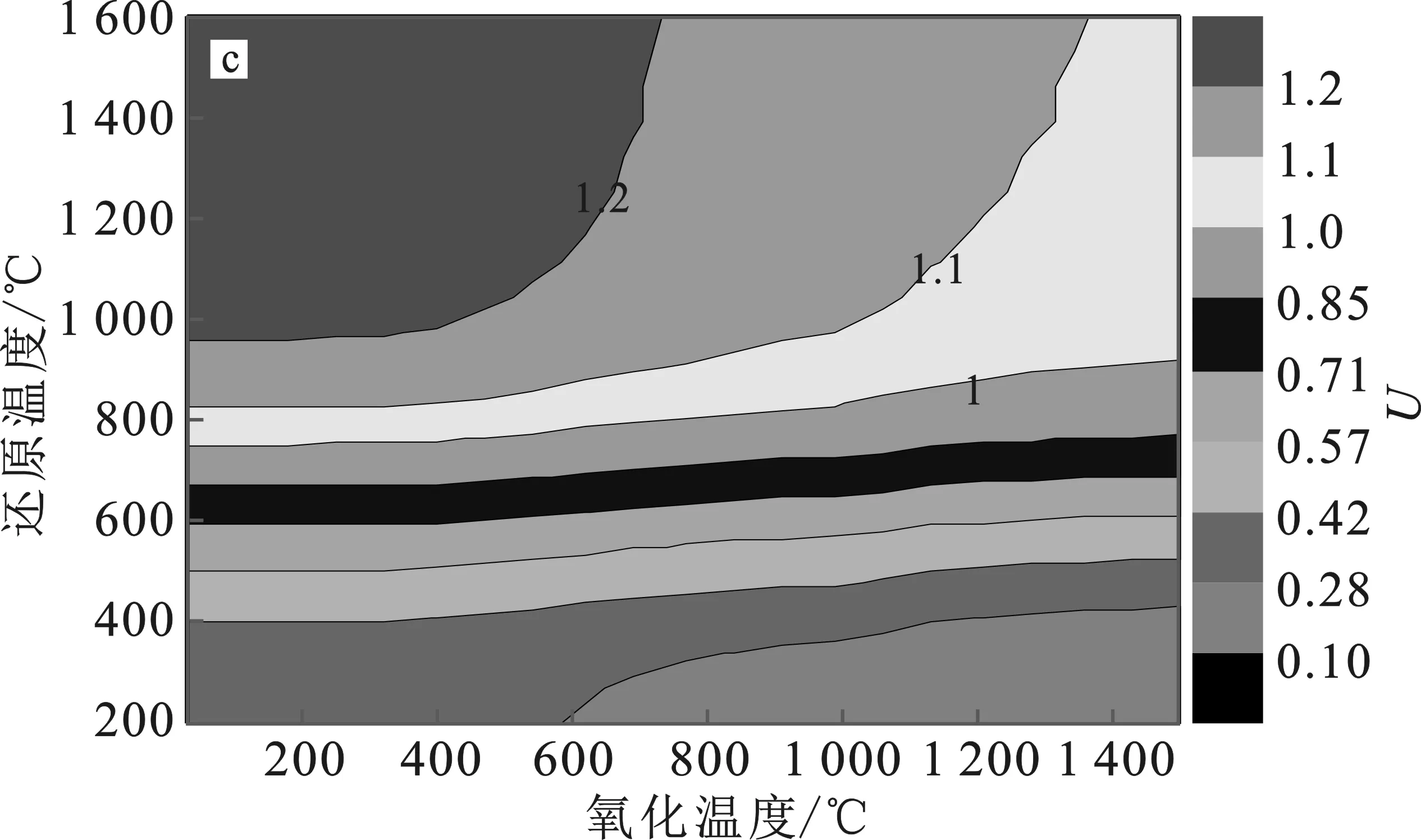

图7 U在R=2、p=0.1 MPa及X=2(a)、4(b)、6(c)、8(d)条件下的变化Fig.7 The change of U under R=2,p=0.1 MPa and X=2(a),4(b),6(c) and 8(d) conditions
由图7可知,U>1的面积较大,说明以SnO2/Sn为原材料的热化学循环有较高的产率和较大范围的操作条件。随着还原温度(Tred)升高,U逐渐增大,然后保持不变。而随着Toxi升高,逐渐减少,其原因是H2O和Sn的反应在高温下受阻。可见,高Tred和低Toxi下可获得高能量升级因子U,这与还原反应是吸热过程、氧化步骤是放热反应相一致。另外,通过对比可发现,U对Tred较Toxi更敏感,因此在一定程度上,适当增加Tred,可以提高太阳能热化学燃料的生产。
2.5 太阳能燃料转化效率
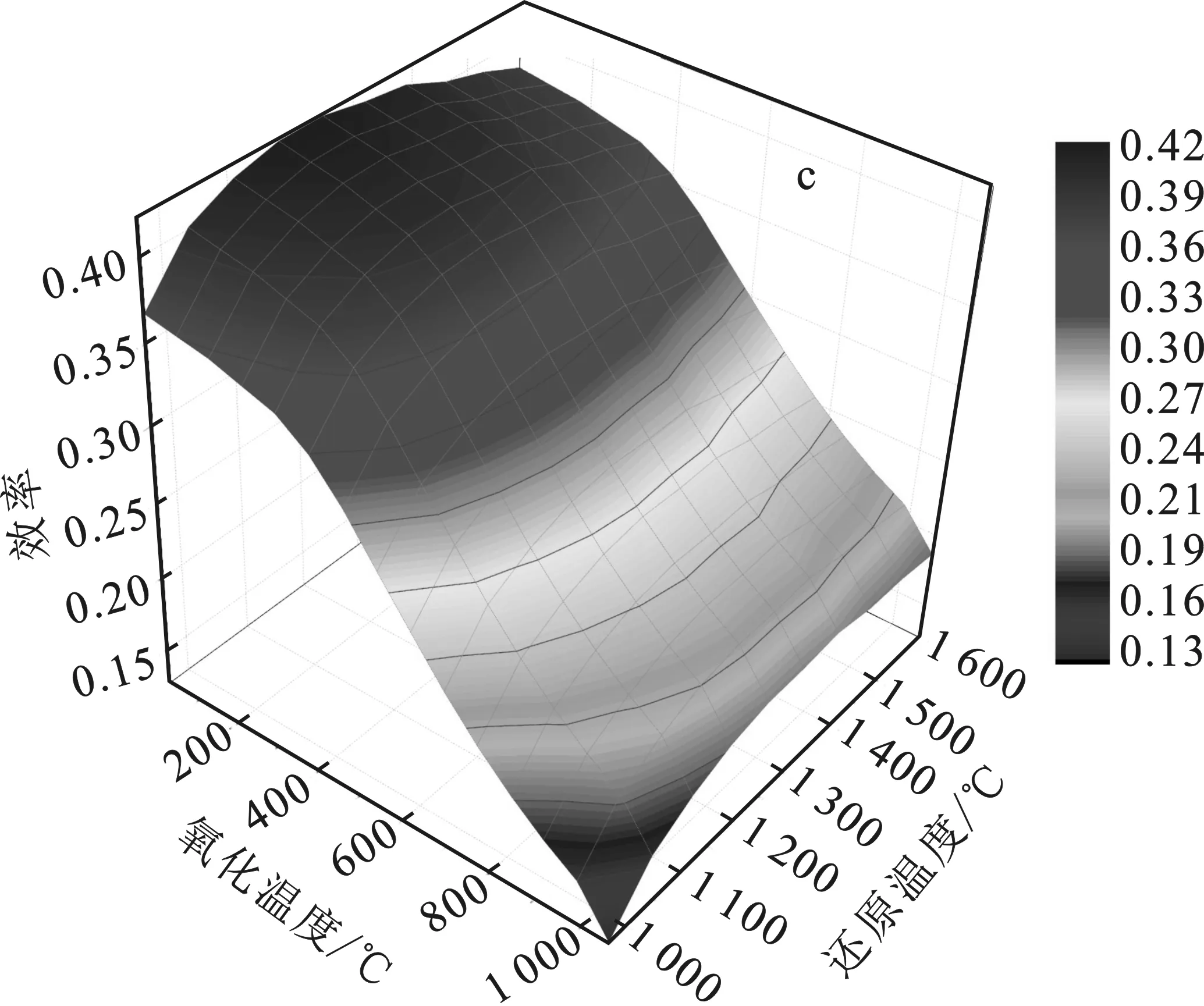
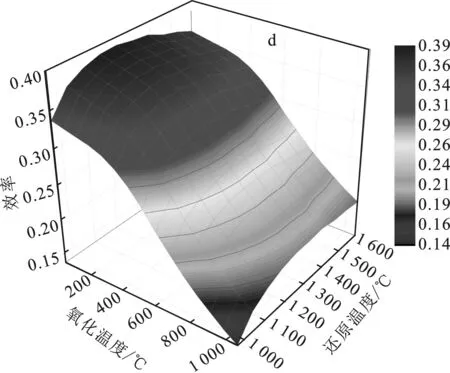
图8研究了R=2、p=0.1 MPa(1 bar)和X=2,4,6,8的太阳能转变为燃料的效率(ηsolar-to-fuel)。
由图8可知,随着还原温度(Tred)的升高,太阳能转变为燃料的效率(ηsolar-to-fuel)先升高后降低。随着Toxi增大,太阳能转变为燃料的效率ηsolar-to-fuel先缓慢下降,到达600 ℃时,太阳能转变为燃料的效率ηsolar-to-fuel急剧下降,这是因为超过该温度时,Sn与H2O的反应受阻,H2产率急剧下降。X=2,4,6,8时,燃料的效率ηsolar-to-fuel的最大值分别为0.5,0.45,0.45,0.39。当X>2时,氧化反应完全,H2产率达到最大值,由于H2O(g)过多,因而加热水的热量增多,从而太阳能转变为燃料的效率有所降低。在1 000 ℃ 图8 R=2、p=0.1 MPa和X=2(a)、4(b)、6(c)、8(d)的太阳能转变为燃料的效率(ηsolar-to-fuel)Fig.8 R=2,p=0.1 MPa and X=2(a),4(b),6(c),8(d) the solar energy transforms into the fuel’s efficiency (ηsolar-to-fuel) 对SnO2/Sn/CH4还原、水分解的两步STC循环进行了热力学研究,发现该循环的还原温度低、燃料选择性高、操作条件广,是一种可行且有潜力的途径。通过热力学模拟计算分析,研究了氧化还原温度、反应物配比、还原反应器中气体压力对物质组分的平衡、能量升级因子(U)和太阳能燃料转化效率的影响。研究结论如下: (1)引入CH4还原,可降低SnO2的还原温度到620 ℃,降低了反应器的设计成本和改善了运行条件。STC循环中,高还原温度有利于还原反应的进行,高压力对还原反应有负面影响,低氧化温度有利于水分解反应的进行。 (2)在还原步骤中,R=2,p=0.1 MPa(1 bar)条件下,950 ℃ (3)随着p升高,H2和CO产率均降低。随着X增大,能量升级因子(U)最大值温度范围逐渐变大,而太阳能燃料转化效率(ηsolar-to-fuel)逐渐降低。在p=0.1 MPa(1 bar),R=2,X=2,Tred=1 260 ℃,Toxi=25 ℃情况下,可获得最大的太阳能燃料转换效率为0.5。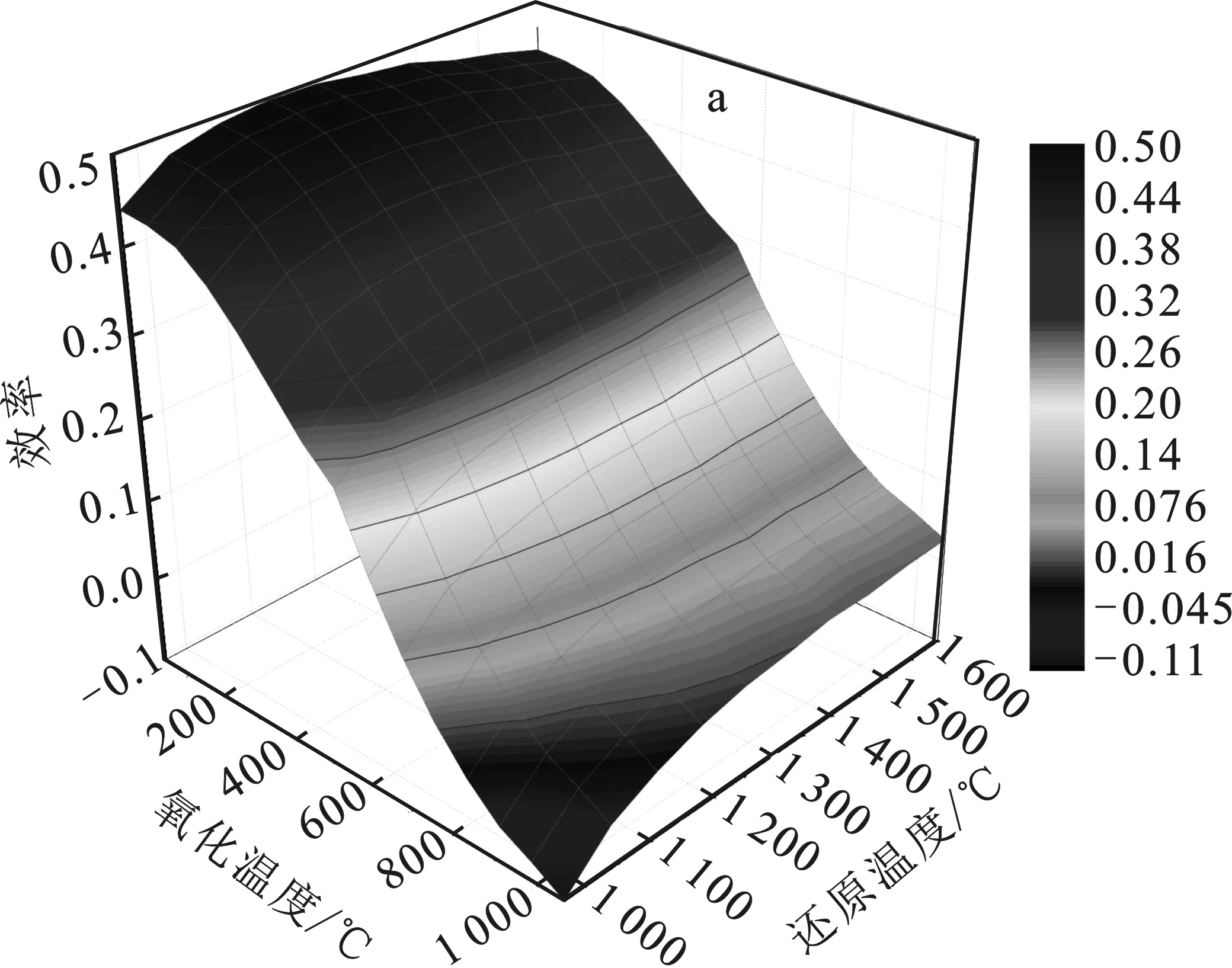

3 结论
