间歇性缺氧通过上调蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路促进S180实体瘤的生长
2021-04-09杨盼成林杰单玮碧艾孜买提肉孜江姚巧玲
杨盼,成林杰,单玮碧,艾孜买提·肉孜江,姚巧玲
作者单位:新疆医科大学基础医学院,新疆维吾尔自治区 乌鲁木齐830011
睡眠呼吸暂停综合征(Obstructive sleep apnea,OSA)是一种以睡眠中反复发生的上呼吸道完全或部分塌陷而造成的通气中断为特征的睡眠障碍性疾病。可导致多个脏器的损害,包括心血管系统损害,代谢功能损害及大脑认知功能障碍,可严重影响患者的生活质量和寿命。其中间歇性缺氧(Intermittent hypoxia,IH)是OSA的主要标志和特征。
将动物暴露于IH 是一种常见的OSA 动物实验模型,有研究表明IH可促进肿瘤的生长和转移。Akt/mTOR(蛋白激酶B/哺乳动物雷帕霉素靶蛋白)信号通路作为肿瘤领域的研究热点,被证明在多种肿瘤中异常激活,调控肿瘤细胞的存活、增殖及迁移。研究发现Akt/mTOR信号通路的活化可为细胞的生长、蛋白质的合成提供有利条件,进而为细胞的抗凋亡提供途径。Akt/mTOR 信号通路和凋亡是否在OSA 合并肿瘤的发生和进展中发挥调控作用,目前国内外均没有报道。2018年3—5月,选用在新疆医科大学动物房购买的8 周龄清洁级昆明鼠制备IHS180实体瘤模型,探讨Akt/mTOR信号通路及凋亡在OSA合并肿瘤发病机制中的作用。
1 材料与方法
1.1 实验动物
8 周龄的昆明小鼠(雄性)16 只,体质量(21±2)g,购自新疆医科大学实验动物中心[许可证号SCXK(新)2018-0001)]。实验期间,室温在22 ℃左右,照明时间为9:00-21:00,小鼠自由饮水和喂食,本研究符合一般动物实验伦理学原则。1.2 实验仪器及试剂
S180实体瘤(赠送),胎牛血清(10091-148),美国Gibco,0.25%胰酶(J112861)、双抗(SV30010)、DMEM 高糖(SH30022.0)购置于美国Hyclone,TUNEL 试剂盒(MK1028)购于博士德生物,BCA 蛋白定量试剂盒(UB276927)、RIPA 裂解液(TK274910)购置于美国Thermo,蛋白激酶B(Akt、#4865)、磷酸化Akt(p-Akt、#4060)、哺乳动物雷帕霉素靶蛋白(mTOR、#2983)、磷酸化mTOR(p-mTOR、#5536)兔来源的单克隆抗体购置于美国CST公司。1.3 实验方法
1.3.1
细胞培养及处理 将S180 实体瘤放于含10%胎牛血清及DMEM 高糖的完全培养基中,置于37 ℃5%二氧化碳培养箱中培养,根据细胞生长情况进行传代,离心去上清,加入完全培养液吹打,使细胞悬浮于完全培养液中,并进行细胞计数,调整浓度为1×10/mL,取3 只正常的小鼠,每只鼠腹腔打0.2 mL 的细胞悬液,制备恶性腹水瘤小鼠模型。10 d 后,选取生长良好的S180 荷瘤小鼠(腹水型)无菌条件下抽取腹水,以完全培养液1∶1 稀释成瘤细胞悬液,制成1×10/mL 的细胞悬液备用,每只小鼠接种0.2 mL(细胞数2×10个)。1.3.2
动物模型的建立 肿瘤接种:用75%乙醇消毒小鼠腋下,细胞悬液在使用前用枪混匀,然后用1 mL无菌注射器吸取0.2 mL的悬液,并将其接种于小鼠左前肢腋下部皮下,形成圆形小皮丘,注射完停10 s,出针。缺氧的暴露:把接种S180实体瘤的小鼠采用随机数字表法随机分为RA 组和IH 组。IH 按照本课题组以往的造模方式进行,小鼠放到缺氧箱中,IH循环由30 s 氮气和30 s 氧气组成,每个IH 循环是1 min,氧的最低浓度为(7±1)%,IH 暴露时间为9:00~21:00,连续2 周。RA 组小鼠在普通鼠笼进行饲养,IH 组和RA 组小鼠在同一房间,实验期间,所有小鼠自由饮水和进食。IH 暴露两周后,小鼠称体质量,用4%水合氯醛麻醉,取肿瘤组织称重,一半组织液氮速冻,保存于-80 ℃备用;另一半组织浸泡在4%甲醛里面,用于石蜡切片。
1.3.3
肿瘤组织细胞凋亡检测 4%甲醛固定后,肿瘤组织常规脱水、透明、浸蜡、包埋、切片;取石蜡切片,按照TUNEL 检测试剂盒说明书进行凋亡检测,每组随机选择5个视野,计数凋亡小体,取均数。1.3.4
Western blotting 检测蛋白表达 取适量肿瘤组织,加入已配好的含蛋白酶和磷酸酶抑制剂的RIPA裂解液,充分混匀,剪碎,超声。冰上裂解30 min,裂解完成后,在4 ℃,12 000 r/min条件下离心20 min,收集上清,BCA法测定蛋白浓度。配胶,依次进行电泳和转膜,随后用1%的BSA进行封闭1 h,一抗孵育,4 ℃过夜(Akt、p-Akt的抗体稀释比为1∶1 000,mTOR、p-mTOR及β-actin抗体稀释比为1∶2 000),TBST洗3次,每次5 min。二抗孵育1 h 后,TBST 洗3 次,采用ECL法显色,将条带置于成像仪中,拍照并保存。蛋白条带灰度值用Image J计算、分析。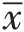
2 结果
2.1 肿瘤组织质量占比情况
小鼠瘤质量RA组和IH 组小鼠肿瘤组织的质量分别为0.22(0.15,2.30)和2.76(1.93,4.14),IH 组肿瘤组织质量高于RA 组(Z
=-2.143,P<
0.05)。RA 组和IH 组肿瘤组织质量占小鼠体质量的比例分别为2.46%和8.87%,IH 组肿瘤组织质量占小鼠体质量的百分比高于RA 组,两组相比差异有统计学意义(Z
=-2.429,P<
0.05)。2.2 肿瘤组织细胞凋亡情况
RA组肿瘤组织切片中相应凋亡小体个数为(129.75±20.20)个,IH组肿瘤组织切片中凋亡小体个数为(81.18±8.92)个;IH组肿瘤组织切片中凋亡小体个数低于RA组(t
=2.424,P<
0.05)。2.3 Western blotting 检测Akt、p
-Akt 在IH 和RA肿瘤组织中的表达
RA 组和IH 组肿瘤组织中Akt的相对表达量分别为(0.79±0.03)、(0.80±0.03),两组表达量差异无统计学意义(t
=-0.128,P>
0.05)。IH 组肿瘤组织中p-AKT 的相对表达量(0.62±0.02)高于RA组(0.50±0.04)(t
=-2.604,P<
0.05)。见图1。2.4 mTOR、p
-mTOR 在IH 组和RA组肿瘤组织中的表达
RA 组和IH 组肿瘤组织中mTOR 的相对表达量分别为(0.64±0.04)、(0.62±0.06),两组差异无统计学意义(t
=0.243,P>
0.05)。IH 组中p-mTOR 的相对表达量(0.35±0.02)高于RA 组(0.26±0.03)(t
=-2.711,P<
0.05)。见图2。
图1 常氧组(RA)与间歇性缺氧组(IH)Western blotting 检测Akt、p-Akt及β-actin的表达

图2 Western blotting检测mTOR、p-mTOR及β-actin的表达
3 讨论
近几年的研究发现OSA模式的间歇性缺氧可以促进肿瘤的生长和转移。2012年西班牙学者Almendros发现暴露在间歇性环境2周的小鼠与正常组比较其黑色素实体瘤的体积、质量均增加。Huang也发现暴露在间歇性环境5周的小鼠与正常组比较其肿瘤的体积、质量均增加。动物实验证明OSA 模式间歇低氧不仅与肿瘤发生有关,且与肿瘤的生长有关。本研究发现间歇性缺氧环境暴露2周后,IH组S180肿瘤的质量明显高于RA组(P<
0.05),IH组S180肿瘤质量占小鼠体质量的百分比高于RA组(P<
0.05),说明间歇性缺氧可促进实体瘤的生长。肿瘤在生长过程中存在着细胞增殖与凋亡的失衡,细胞凋亡受到抑制会使细胞死亡率下降,将导致细胞数目不断增加,表现出生长的优势。因此,我们检测了肿瘤组织中的细胞凋亡情况,结果发现IH 组S180 肿瘤组织切片中相应凋亡小体个数低于RA 组(P<
0.05)。说明IH 所致的肿瘤细胞生长加速与IH条件下细胞的凋亡减少有关。mTOR 信号通路与凋亡、炎症和自噬等多种肿瘤的发病机制有关。研究表明,胰腺癌、白血病、膀胱癌等肿瘤可通过抑制mTOR活化促进细胞凋亡进程。我们的研究发现IH 组S180 肿瘤组织切片中凋亡小体个数低于RA 组(P<
0.05)。说明在本实验条件下,磷酸化mTOR 的激活可能抑制了细胞的凋亡进程,从而促进了肿瘤组织的生长。mTOR 可被PI3K/Akt 途径激活。活化的磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)可在3-磷酸肌醇依赖蛋白激酶1(3-phosphoinositidedependent protein kinase1,PDK1)的协同下磷酸化Akt 使其被激活。活化的Akt 磷酸化结节性脑硬化复合物-2(Tuberous sclerosis complex-2,TSC2),而被磷酸化的TSC2 将从负向调控脑内Ras 同系物(Ras homolog enriched in brain,Rheb)的结节性脑硬化复合物-1(Tuberous sclerosis complex-1,TSC1)/TSC2 复合物中解聚,使Rheb 活性增强,正向调控mTOR 的活性。磷酸化Akt 的增加,mTOR 也增加,因此,Akt与mTOR 可构成Akt/mTOR 通路,Akt 由480 个氨基酸残基组成,具有可催化及可调节活性区域,该区域可使Akt 磷酸化成p-Akt 而发挥各种生理功能。mTOR 是Akt 的下游底物,活化的Akt 可直接激活mTOR 而发挥调控细胞的周期、生长增殖等作用。大量研究表明,多种实体瘤组织中均有Akt、mTOR 蛋白的异常表达。有研究表明Akt、mTOR 磷酸化水平增加可使肿瘤细胞凋亡减少,在我们的研究中,p-mTOR 上调的同时Akt的磷酸化被激活,说明Akt/mTOR 通路被激活,导致肿瘤细胞凋亡减少,这可能是肿瘤细胞凋亡减少的原因。
Akt/mTOR 信号通路不仅与肿瘤的凋亡有关,还可能与肿瘤的预后关系密切,张刚等发现宫颈癌、肺癌和胃癌的发生发展及预后变差与Akt/mTOR信号通路的激活关系密切。我们的结果表明IH暴露后,S180 实体瘤肿瘤组织Akt/mTOR 通路上调,提示IH可能是OSA 导致实体瘤预后变差的原因之一。
综上所述,IH 可促进肿瘤的生长,导致缺氧小鼠肿瘤重量增加,其机制可能同Akt-mTOR 通路在肿瘤组织中的激活,减少肿瘤组织凋亡小体的数量,抑制了肿瘤细胞凋亡有关。
