开花植物CO/FT分子途径的生物学功能和分子进化
2021-04-08罗碧珍罗永海
罗碧珍, 罗永海
(福建农林大学生命科学学院,福建 福州 350002)
开花(flowering)是被子植物从营养生长转变为生殖生长的过程,关系着被子植物能否成功繁衍后代,因而是植物体最重要的生命行为.开花起始受到一系列因子的诱导与调控,主要可以分成两大类:一类是环境信号,如温度和日照时间的长短等;另一类是植物内源性的变化,如幼年到成年的转变、激素水平的变化等.这些相互关联的诱导与调控途径主要包括光周期途径(photoperiod pathway)、春化途径(vernalization pathway)、环境温度途径(ambient temperature pathway)、植物激素途径(plant hormone pathway)和自主开花途径(autonomous flowering pathways).其中,光周期途径对植物的生长发育具有多方面的影响,除了开花,它还影响植物器官的发育(例如马铃薯块茎的形成)、叶片的衰老与脱落等.在光周期途径中,CONSTANS(CO)和FLOWERING LOCUS T(FT)基因是起核心作用的两个基因,形成一个分子途径,参与了多个生物学过程.
1 光周期转录因子CO
1.1 CO在拟南芥中的功能及分子作用机制
CO是拟南芥中首个被发现的CONSTANS-LIKE(COL)基因成员,其mRNA和蛋白的表达受光周期的调控,进而整合生物钟信号和光信号调控开花[3].拟南芥在长日照条件下,COmRNA到达高峰出现在午后,但在短日照条件下却出现在黄昏后[4].研究表明[5],开花时间与拟南芥CO启动子的CTTTACA重复序列个数的自然变异相关,多个与CYCLING DOF FACTORs(CDFs)同源的DNA BINDING WITH ONE FINGER (DOF)转录因子能够结合CO基因的启动子CTTT位点,参与长日照上午时段CO基因转录的抑制.同时,CIRCADIAN CLOCK ASSOCIATED 1(CCA1)和LATE ELONGATED HYPOCOTYL(LHY)能够抑制FLAVIN-BINDING、KELCH REPEAT、F-BOX 1(FKF1)和GIGANTEA(GI)的转录,后几个基因都对CDFs有负调控作用.在长日照的午后阶段,FKF1和GI以依赖蓝光的方式相互作用,从而诱导CDFs降解,导致CO的mRNA能在长日照午后积累[6].此外,有研究表明ZEITLUPE(ZTL)也参与了这个过程,GI在核内与ZTL相互作用,进而使FKF1从ZTL中分离出来,因此,GI通过协调FKF1和ZTL的平衡在精确控制开花中起着关键作用[7].
CO蛋白表达的精细调控对诱导成花素基因FT在长日照午后阶段的表达有重要作用.PHYTOCHROMEB(PHYB)信号和E3泛素连接酶HIGH EXPRESSION OF OSMOTICALLY RESPONSIVE GENES1(HOS1)参与了上午CO蛋白的降解[8].在午后阶段,由于CDFs的降解,CO的mRNA不断积累,CO蛋白的积累出现高峰.CRYPTOCHROME(CRY)会以依赖蓝光的方式与SUPPRESSOR OF PHYA-105 1(SPA1)和CONSTITUTIVE PHOTOMORPHOGENIC 1(COP1)复合物结合从而抑制其活性,使得CO蛋白在午后稳定积累[9].CO蛋白与光敏色素作用因子PHYTOCHROME INTERACTING FACTOR 4(PIF4)相互作用并与FT的启动子结合激活了FT的表达[10].在黄昏以后,尽管COmRNA仍能够有较高水平的积累,但是COP1和SPA1的复合物能够高效地降解CO蛋白[11],导致FT的转录激活不能实现.CO通过一段独特的序列元件能够直接与受体DNA结合,这段独特的序列元件包含一致的TGTG(N2-3)ATG基序,该元件也在FT的启动子中存在,使得CO蛋白能够顺利结合并行使功能[12].
在短日照条件下,CO通过激活开花抑制因子TERMINAL FLOWER 1(TFL1)起抑制开花的作用[13].在生物学上,超级短日照(3 h)或者黑暗(有蔗糖)条件下也能促进开花,说明短日照比超级短日照更能抑制开花这一过程[14].另外,近期研究表明[15],CO对遮荫诱导的开花有加速的作用,他通过调节FAR-RED1(HFR1)的表达量,促进FT、TSF、SOC1和SPLs的表达,导致加速开花.
1.2 CO在不同物种中的功能保守性
CO直系同源基因在众多植物物种广泛存在.水稻光周期敏感基因Heading date 1(Hd1)是拟南芥CO的直系同源基因,在短日照和长日照条件下具有不同的功能.在短日照条件下,Hd1通过诱导Hd3a(拟南芥FT的直系同源基因)促进抽穗,在长日照条件下则抑制抽穗[16].在葡萄中,人们发现VvCO的功能与葡萄开花的季节性周期有关.同时,研究人员也对2个葡萄开花整合基因VFY和VvMADS8(分别是拟南芥LFY和SOC1基因的直系同源基因)进行分析,发现在开花诱导期,潜伏芽中VvCO、VFY和VvMADS8的表达量最高.VvCO主要是在11月表达,VFY和VvMADS8的峰值则分别在1月和12月,提示这些基因之间存在一定时空关联[17].在大麦中,HvCO1的过表达加速了长日照和短日照条件下大麦的开花,并导致长日条件下HvFT1 mRNA的上调.研究人员还发现,大麦中HvCO1的下游存在着其他光周期响应因子Ppd-H1.对HvCO1过度表达和Ppd-H1自然遗传变异分离群体的分析表明,HvCO1可能通过激活HvFT1诱导开花,而Ppd-H1独立于HvCO1 mRNA的表达水平调节HvFT1[18].兰科植物的花期具有重要的市场价值,为了探究光周期对兰花开花的影响,研究人员在分别在墨兰、春兰、建兰中鉴定和分离出CsCOL1、CgCOL和CeCOL基因.在拟南芥中异源表达发现CsCOL1和CeCOL能够促进开花,而CgCOL抑制开花[19].总而言之,随着近年来植物科学的快速发展,人们对很多物种的开花性状展开分子生物学研究并取得进展,诸多物种的CO基因家族已经得到分析.这些研究表明,尽管在不同的物种中CO基因行使功能的分子机制存在分化,但它们均与光周期的响应相关,与高等植物的生殖生长有关,显示其具有古老的系统发生历史、在物种进化中具有高度的功能保守性.
1.3 CO基因家族及其功能分化
CO基因家族属于植物特有的锌指转录因子家族,家族成员(即COL基因)含有2个保守的结构域,一个是B-box结构域,即在氨基末端含有一个锌指结构,是由4个半胱氨酸CX2CX16CX2C所形成的特殊结构,参与蛋白与蛋白间相互作用[20].另一个是CCT(CO, COL, TOC1)结构域,该结构域并不只存在于CO基因家族里,由靠近羧基端的43个氨基酸组成,具有核定位的功能,能与血红素激活蛋白(HAPS)、COP1相互作用,还可能是一个DNA结合区域[21].拟南芥、水稻和大麦等物种基因组的研究发现,包含至少1个B-box和1个CCT结构域的CO祖先基因发生了多次基因重复事件.拟南芥基因组有17个COL基因,水稻有16个COL基因,大麦有9个COL基因[22].根据COL序列信息,CO基因家族可分为3个分支:分支一的成员包含2个B-box(B1和B2)结构域和1个CCT结构域;分支二的成员也包含2个B-box(B1和B2)结构域和1个CCT结构域,但在B2中含有1个额外的锌指结构;分支三的成员仅包含1个B-box(B1)结构域和1个CCT结构域[23].
COL基因的功能众多,就开花性状而言,有促进开花的,也有抑制开花的.例如在拟南芥中,与CO基因不同,COL4是长日照和短日照条件下的开花抑制因子,作用于FT和SOC1等基因[24].在大麦中,HvCO1的过表达和Ppd-H1的自然变异对长日照下的茎伸长有重要影响,HvCO1的过表达转基因植株的茎伸长明显加快,显示其不仅具有影响开花时间的功能[18].在芥菜中,Phytochrome A signal transduction 1(PAT1)与COL13相互作用,由此产生的PAT1-COL13蛋白复合物介导了荠菜芽的分枝,揭示了光敏色素信号与开花途径在调节植物分枝发育过程中新的介导模式,为提高作物产量提供了新的研究方向[25].此外,光敏色素信号与开花途径在生长素水平上也具有一定的调节作用.拟南芥光敏色素(phytochrome B, PhyB)能通过感知红光与远红光的比值(R∶FR)进而调节植物的生命活动.拟南芥COL7是连接光感应和生长素水平变化的关键基因[26],在高R∶FR中促进了编码生长素生物合成抑制因子SUPERROOT2(SUR2)的mRNA表达,但在低R∶FR中并没有促进SUR2的表达,表明COL7以依赖高R∶FR的方式调控植物生长素水平.在矮牵牛中,研究人员鉴定到了与拟南芥COL16的同源基因PhCOL16a、PhCOL16b和PhCOL16c,发现这3个基因的表达模式和叶绿素的含量相关.在矮牵牛过表达PhCOL16a可发现植株的花冠呈淡绿色,其叶绿素含量及叶绿素合成关键酶均明显高于野生型.这说明PhCOL16对叶绿素的合成有正向调节作用[27].此外,近期的研究发现COL基因在调节ROS途径的功能中也发挥着重要作用[28].
总之,尽管CO基因家族并不算大,COL基因的功能分化却很明显,除了涉及到茎的伸长、芽的分枝、生长素的水平、叶绿素的合成、ROS途径的调节外,还能影响花苞的开花、块茎的形成、淀粉的形成、细胞周期的调控等(图1).不同的COL基因是否通过相同或类似的机制在行使功能呢?考虑到CO的功能是被光质、光照长度、光周期和其它外部信号影响或激活的,人们有理由推测其它COL蛋白也通过类似的方式进行调节[29],回答这个问题需要人们研究更多物种、更多COL基因的分子作用机制.
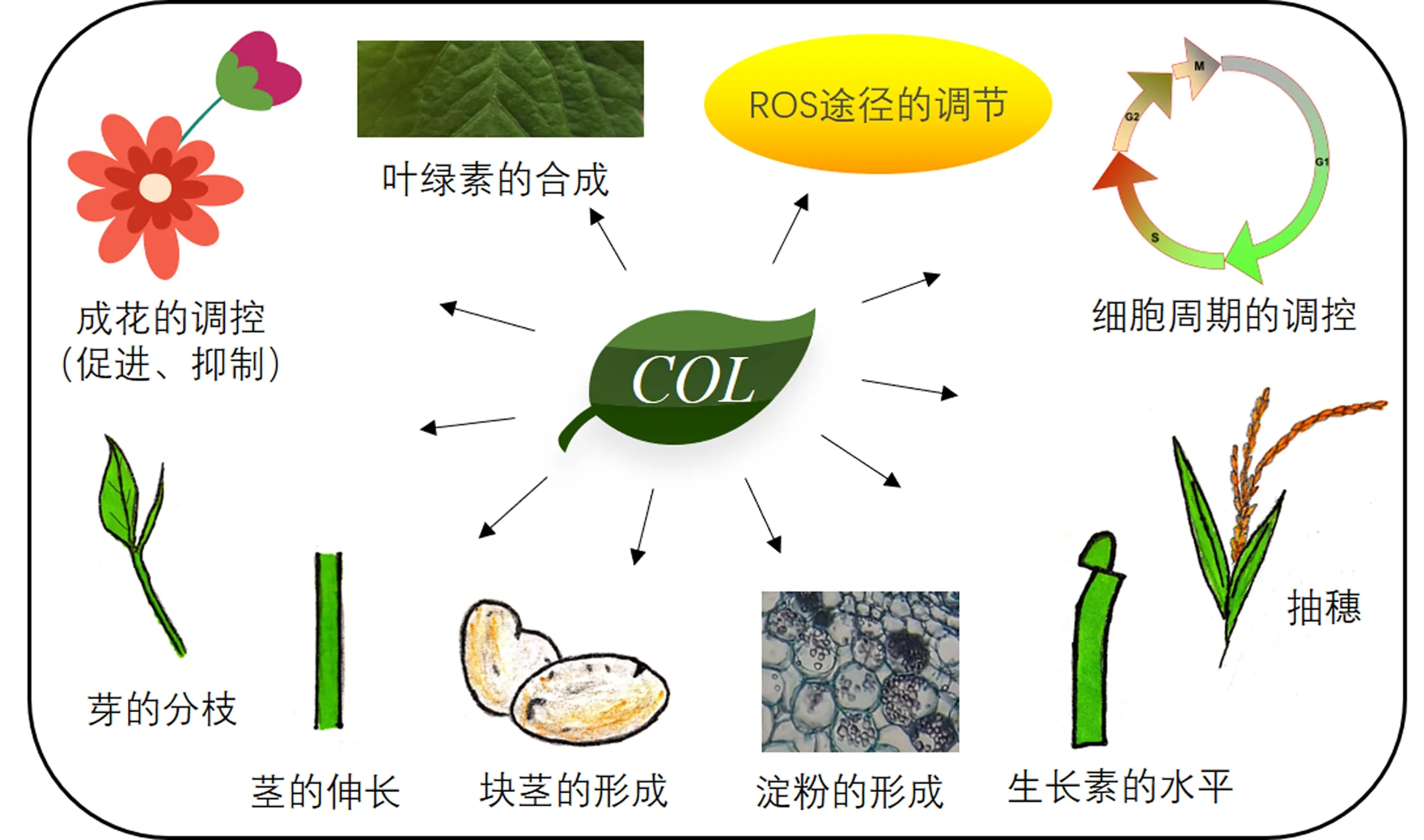
图1 开花植物COL基因的功能分化Fig.1 Functional differentiation of CO -likegenes in flowering plants
2 开花途径整合因子FT
2.1 FT在拟南芥中的功能及分子作用机制
FT蛋白被称为成花素(florigen),是植物开花的关键整合点,可以整合各个开花调控途径信号并将其传递给下游因子,从而调控植物的开花.主要基于拟南芥的研究表明,拟南芥FTmRNA在叶片中被诱导表达,形成的FT蛋白通过维管束系统被运输到顶端分生组织[30];在分生组织中,FT和FLOWERING LOCUS D(FD)、14-3-3s等蛋白结合形成成花素激活复合体(florigen activation complex, FAC),识别并激活包括APETALA 1(AP1)和SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1(SOC1)等花原基属性下游基因,实现植物从营养生长到生殖生长的转变,即诱导开花[31,32].
FT基因的诱导表达是植物开花的关键环节,这个过程受众多上游因子/因素的复合调控,包括一系列的正调控与负调控.其中,CO是FT基因表达的关键正调控因子:CO通过它的CCT结构域结合到FT启动子的CO应答元件上,与同样结合到FT启动子上的NUCLEAR FACTOR Y(NF-Y)一起形成特殊的染色质构象,激活FT基因的表达[12].其他通路的基因也参与了FT基因表达的调控,包括但不仅限于F-BOX1(FKF1)、SALT TOLERANT(STO,又名BBX24)、PHYTOCHROME INTERACTING FACTOR 4(PIF4)、LIKE HETEROCHROMATIN PROTEIN 1(LHP1)、FLOWERING LOCUS C(FLC)和SHORT VEGETATIVE PHASE(SVP)等[33-36].
在拟南芥中,除了FT外,开花抑制子(TERMINALFLOWER1,TFL1)也是重要基因之一.FT和TFL1是同源基因,编码一类磷脂酰乙醇胺结合蛋白(PEBPs)基因,PEBPs在细菌、动物和植物生长和器官分化多种信号途径中发挥重要作用[37].除诱导FT外,CO也可直接或间接诱导TFL1的表达,后者可能通过与FD相互作用、削弱了FT与FD之间的结合,从而抑制FT下游几个基因的表达,如LEAFY(LFY)和AP1,从而延迟茎尖分生组织向生殖发育的转变[38].
总体上,科学家们对FT在植物成花诱导方面的功能研究已比较深入,但对其在叶片中发挥的作用仍不够很清楚.近期,有研究发现FT能够诱导SWEET10的转录,SWEET10在叶脉中编码蔗糖双向转运体,介导蔗糖的转运.该结果表明FT信号通路可能参与了开花植物能源的分配与利用[39].
2.2 FT在不同物种中的功能保守性
研究表明,FT同源基因在多年生木本植物、禾本科植物、豆科植物、杜鹃花科、观赏性植物等多个物种中均具有促进生殖发育和成花转变的功能,显示其具有高度保守的生物学功能[40-44].例如,Endo et al[40]将柑橘CiFT基因cDNA在拟南芥中异源表达,发现其能够促进拟南芥从营养生长到生殖生长的转变;将该基因在枳树中组成型表达,发现转基因植株表现出早花、早果等表型.Wang et al[45]研究表明,在拟南芥中,异源表达银杏FT同源基因GbFT导致拟南芥早开花;RNA-seq和qRT-PCR分析结果表明,GbFT在拟南芥中的异源表达上调了其他与花器官发育、转录因子和乙烯途径有关的内源基因.近期研究表明[46],菟丝子能够“窃听”到寄主植物的开花信号,寄主的FT蛋白能够转运到菟丝子中,与CaFD结合从而启动开花,自身的CaFT则因一个或多个位点的突变导致功能的丧失,无法与CaFD相互作用.系统发育研究表明其共同祖先进化出这种依赖寄主的开花机制.此类研究说明FT蛋白的功能在众多物种中的生物学功能是非常保守的,能够促进植物从营养生长到生殖生长的转变.
除此之外,人们发现FT同源基因具有其他方面的功能.例如,Shenhao et al[47]研究表明,黄瓜基因组的FT基因座区域在驯化过程中保留着被选择的痕迹,显示FT同源基因对黄瓜从热带起源向高纬度地区扩散分布具有重要意义.Pin et al[48]研究表明,甜菜中的2个FT同源基因参与了与春化相关的开花响应.Hsu et al[49]研究表明,杨树依靠2个FT同源基因(PtFT1和PtFT2)协调其对温度的响应和季节性的开花.PtFT1具有起始生殖生长的作用,在高温时其表达受到抑制,在冬季低温时则受到诱导;PtFT2响应温度的升高和日照时间的延长,其表达量升高,有促进营养生长和抑制芽形成的作用.
2.3 FT基因家族及其功能分化
磷脂酰乙酰胺结合蛋白(PEBP)家族是进化上非常保守的蛋白家族,其成员在细菌、动物和植物生长和分化的多种信号途径中发挥作用.在拟南芥中,PEBP基因家族有6个成员,除了FT和TFL1外,其他4个分别是TWIN SISTER OF FT(TSF),BROTHER OFFTANDTFL1(BFT),ARABIDOPSIS THALIANA CENTRORADIALIS HOMOLOG(ATC)和MOTHER OF FT ANDTFL1(MFT)[37].这些同源基因在开花调控中的作用均已有研究.TSF是最接近FT的同源基因,无论是在蛋白质序列、表达模式、受CO的诱导,与FD的结合,过量表达时促进开花等方面都跟FT相似[50].BFT也与FT具有高度的序列相似性和表达模式,但其功能却更接近于TFL1-Like,能够抑制开花和开花相关基因[51].ATC能够抑制短光周期条件下的开花,有证据表明它也是种可移动的蛋白质,能够通过维管系统向顶端运输[52].MFT与FT和TFL1均具有高度同源性,但参与开花诱导,可能与FT有功能冗余[53].
关于FT/TFL1的起源与进化,已有的研究表明,MFT基因很可能是FT和TFL1基因的祖先,因为一些低等植物如苔藓的基因组缺少FT或TFL1的同源序列,却具有MFT的同源序列.在种子植物出现之前,基因复制时事件导致了2种PEBP的出现,MFT-like和FT/TFL1-Like分支,随后两个分支基因功能的进一步多样化.随着被子植物的出现,基因复制事件让FT/TFL1-Like分支分化为相互独立的FT-Like和TFL1-Like分支[54],第1种促进开花,第2种抑制开花(图2).有研究表明[55],FT和TFL1的祖先以TFL1-Like的方式行使功能,FT和TFL1的功能在裸子植物和被子植物分离之后才发生了功能分化.例如,在挪威云杉中,PaFTL1和PaFTL2与FT和TFL1具有序列同源性,但它们的作用更倾向生长抑制性的TFL1,在拟南芥中异源表达PaFTL1和PaFTL2均具有延缓开花的效.因此,可以想象,祖先基因的功能更倾向于TFL1而不是FT,并且FT很可能随着被子植物的进化而出现,其促进开花的作用与有花植物的独特特性相一致.由于植物的生命周期和种子形成受开花时间的影响,FT很可能对有花植物的快速多样化及陆地的快速占领做出了重要贡献.对拟南芥、水稻、土豆、甘薯几个物种的系统发育研究表明在不同的物种中均出现FT重复,表明其具有不同的时空表达模式和不同的功能(图2).

图2 拟南芥、水稻、土豆、甘薯PEBP蛋白的系统发育树和亚家族分类Fig.2 Phylogenetic tree and subfamily classification of PEBP proteins from Arabidopsis thaliana, rice, potato and sweet potato.
在其他一些物种的研究中,部分FT同源基因获得了阻遏开花的功能.甜菜含有2个FT同源基因BvFT1和BvFT2,它们具有相反的功能[48].BvFT1具有抑制甜菜开花的作用,在春化开始前通过抑制开花诱导基因BvFT2从而抑制开花.而春化会降低BvFT1的表达,导致BvFT2的表达被上调,从而诱导开花.其他物种(如向日葵、洋葱、烟草、甘蔗等)的FT同源基因在拟南芥中异源表达也能够延缓拟南芥开花.序列比对分析揭示了2个保守的特征氨基酸位点(S134与S138),它们可能决定了FT同源基因具有诱导或抑制开花的功能.在S134特征位点,具有诱导开花功能的FT同源基因(大豆GmFT5a除外)为酪氨酸,具有抑制开花的FT同源基因(挪威云杉PaFTL1和PaFTL2除外)为非酪氨酸.在S138特征位点,具有诱导开花功能的FT同源基因均为色氨酸,具有抑制开花的FT同源基因(龙眼DlFT2和大豆GmFT4除外)均为非色氨酸[56].这两个特征位点对FT蛋白三维构象及生物学功能的影响仍有待进一步的解析.
除了开花调控方面,FT基因家族成员具有调节地下储藏器官的发育、光诱导气孔开放、胁迫诱导开花、花后生殖发育和种子萌发等功能(图3).例如,在马铃薯中,StSP6A作为可移动的蛋白响应光周期诱导块茎的形成[57].在拟南芥中,FT和TSF通过在蓝光下激活保卫细胞中的H+-ATP酶调节气孔开放[58],也分别影响长日照和短日照下的侧枝发育[59].在大豆中,FT2a和FT5a在其开花诱导中起主要作用,但在花后发育中却发挥着不一样的功能,FT5a在花后抑制茎的生长,且比FT2a的抑制效果明显[60].这些研究数据表明,FT所在的PEBP基因家族成员不多,但具有多方面的生物学功能,在不同物种中的功能分化与分子进化机制仍有待在大数据的基础上做进一步的系统研究.

图3 植物FT-like基因的功能分化Fig.3 Functional differentiation of FT-like genes in flowering plants
3 总结
CO/FT途径处于植物开花调控网络的核心位置,是多种开花植物由营养生长到生殖生长转变的关键控制枢纽,在不同物种中也参与了其他不同的生物学途径或植物器官发育调控,显示CO/FT途径的功能具有多样性.例如,在拟南芥中,FT蛋白除了从叶片运输到顶端分生组织,还被运输至腋芽,与TCP转录因子BRC1相互作用,调控腋芽与茎的发育和分化[61,62].在芥菜中,COL13基因能影响芽的分枝,为提高作物产量提供了新的线索[25].在大麦中,HvCO1的过度表达能影响茎的伸长和生殖分生组织的晚期发育[18].
马铃薯的CO/FT途径还可调控地下储藏器官的发育.Navarro et al[57]研究表明,在长日照下的马铃薯StSP6A过表达株系中StSP6A基因在叶片中的表达量明显升高,其块茎产量也显著提高;在短日照下,马铃薯StSP6A沉默株系中StSP6A在叶片中的表达量降低,其块茎的起始发育时间也大大推迟.通过嫁接试验表明,StCO能够在长日照下抑制匍匐茎中StSP6A基因的表达,在短日照下能缓解这种抑制,表明在短日照条件下马铃薯StCO-StSP6A模块调控了块茎的起始.此外,水稻的Hd3a基因在短日照植物马铃薯中异源表达,通过嫁接试验证实了Hd3a-GFP蛋白的迁移,发现了该基因可诱导马铃薯在长日照条件下形成块茎,显示FT-like基因具有跨远距离物种、对器官发育的控制能力.最近,Abelenda et al[63]研究表明,StSP6A还能和蔗糖转运体StSWEET11相互作用,它们的结合阻止了蔗糖向质外体的渗漏,因而可能促进了蔗糖的共质体运输.StSWEET11和StSP6A蛋白之间相互作用说明了蔗糖运输与储藏和光周期途径之间存在紧密联系,FT-like蛋白的功能扩展到了影响植物的库源分配.另外,Lee et al[64]研究表明,在洋葱中,FT直系同源AcFT4起着抑制鳞茎形成的作用.在鳞茎发育早期,AcFT4通过抑制AcFT1的表达来抑制其形成,当洋葱植株在适当的日照长度下逐渐成熟后,AcFT4的表达下调导致AcFT1表达上调,从而诱导鳞茎的形成.
综上所述,CO/FT途径具有古老的系统发育源头,在物种进化过程中一直处于调控个体生长与繁育的枢纽位置.在现存的高等植物中,CO-FT的功能具有高度多样性,可能仍有很多功能未被揭示,特别是它们在其他物种中的比较分析、与其他基因的互作网络、与家族内的其他成员的协作等,尚有很大的挖掘空间.
