湿地环境中微塑料分布及检测方法研究进展
2021-04-07翟俊晏记侠饶逸飞杨通
翟俊 晏记侠 饶逸飞 杨通
摘 要:微塑料是一种难降解的新兴污染物,广泛分布于海洋、淡水、土壤及湿地系统。湿地是生态环境的重要组成部分,拥有丰富的动物、植物和微生物资源,在维持生物多样性方面发挥着重要作用,微塑料的存在可能对湿地物种多样性构成威胁。通过介绍微塑料在湿地系统中的分布特征及存在形式,分析了微塑料对湿地系统动物、植物及微生物的毒理学影响,在综合前期研究的基础上,总结了湿地环境水体、沉积物及生物体中微塑料的分析检测方法,提出针对湿地环境不同组成部分微塑料的检测方法,并对湿地系统中微塑料未来研究的重点进行展望。通过对湿地环境中微塑料分布及生态毒理学的影响进行分析,可为明晰湿地环境中微塑料现状提供理论依据,并为今后湿地环境中微塑料研究提供新的思路。
关键词:湿地系统;微塑料;分布特征;检测方法
中图分类号:X502 文献标志码:R 文章编号:2096-6717(2021)02-0158-10
Abstract: Microplastics are a new type of pollutants that are difficult to degrade and are widely distributed in the ocean, fresh water, soil and wetland systems. Wetlands are an important part of the ecological environment. They are rich in animal, plant and microbial resources and play an important role in maintaining biodiversity. Therefore, the presence of microplastics may pose a threat to the diversity of wetland species. This article introduces the distribution characteristics and existing forms of microplastics in the wetland system, analyzes the toxicological effects of microplastics on the animals, plants and microorganisms of the wetland system. On the basis of previous research, it summarizes the analysis and detection method of microplastics in the wetland environmental water bodies, sediments and organisms, the detection process of microplastics in different components of the wetland environment is proposed, and the future research focus of microplastics in wetland systems is prospected. By analyzing the distribution of microplastics in the wetland and the impact of ecotoxicology, it can provide a theoretical basis for clarifying the status of microplastics in the wetland environment and provide new ideas for future research on microplastics in the wetland environment.
Keywords:wetlands; microplastic;distribution characteristics; detection methods
“微塑料”一词2004年首次被用于描述海洋沉积物中尺寸小于5 mm的塑料碎片/颗粒[1-2]。目前,学术界对微塑料尺寸下限的界定仍未达成一致[2-3]。Van Cauwenberghe等[3]建议微塑料尺寸下限为20 μm,Gigault等[4]定义了微塑料的尺寸下限为1 μm,然而实际研究中由于检测技术的局限,通常使用的尺寸下限为330 μm或500 μm[2-4],未来随着检测技术的进步,实际研究中可检测到的微塑料尺寸可能会低至1~20 μm。微塑料粒径小,易被鱼类、浮游动物等生物摄食,进而影响其生理活动[3-4];同时,比表面积大,易吸附周围环境中的污染物,如持久性有机污染物(Persistent Organic Pollutant, POPs)和部分重金属(Cd、Pb、Cu和Zn等[5]),这些污染物在环境物理、化学和生物作用下,释放到环境中,通过直接毒害或间接影响生物生存环境的方式,抑制或促进生物生长[6-7]。环境中检测出丰度较高的微塑料类型有聚乙烯(Polyethylene, PE)、聚丙烯(Polypropylene, PP)、聚氯乙烯(Polythylene, PVC)、聚苯乙烯(Polystyrene, PS)、聚酰胺(Polyamide, PA)和聚氨酯(Polyurethane, PU)等[5-7],主要形狀是纤维状、薄膜状、碎片状和球状[8-9]。
目前,已在湿地系统中检测出微塑料[5, 10-14],其可能对湿地动物、植物和微生物生存环境构成威胁。笔者梳理了微塑料在湿地环境中的分布、生态毒理学影响及检测分析技术,这对明晰湿地环境中微塑料研究现状及保护湿地环境具有重要意义。
1 湿地环境中微塑料来源、分布与迁移转化
1.1 湿地环境中微塑料的来源与分布
湿地环境中微塑料来源于初期雨水中携带的轮胎磨损颗粒和道路标记等不溶性物质[15-16]、大气中微塑料沉降[4,15-16]、自然环境中塑料垃圾的分化及污水处理厂出水[17-19]。自然环境中的微塑料也会随风、鸟类进行长距离的迁移,在湿地中累积[15]。
在湿地环境中,微塑料存在于水体、沉积物及动物中,湿地植物及微生物中目前尚未发现微塑料。表1中列举了现有文献报道的部分湿地水体及沉积物中微塑料的分布情况。由表1可知,水体及沉积物中微塑料浓度分别为63.3~710.2个/(m3水)和(7.1~17 049)×104个/(m3沉积物),沉积物中微塑料浓度较高,占比99%以上,水体中微塑料较低,占比不到1%。微塑料在湿地动物中的相关研究较少,目前报道的有鱼类[6-8]和水鸟[9]。Sheng等[7]报道了中国湛江红树林湿地鱼体中的微塑料平均浓度为2.83±1.84个,鱼体中微塑料浓度较低,占比不到1%。Gil-Delgado等[9]在西班牙中部4个湿地水鸟的粪便中发现了塑料碎片,但并未将研究结果数据化。这些研究结果表明,动物也是湿地微塑料的载体,而有关湿地其他动物微塑料的分布仍需进一步探究,这对明确湿地环境中微塑料的分布及微塑料在湿地食物链中的传递具有重要意义。
1.2 湿地环境中微塑料的迁移转化
湿地系统具有较高的物种多样性,微塑料可能在湿地不同的位置、不同的物种间进行迁移和转化。目前,湿地中检测出的微塑料的主要类型有PP、PE和PS。由于PP、PE密度比水略大,易吸附环境中的污染物使其比重增大,从而在水中易沉降,因此,微塑料可从水体中迁移至沉积物中[10-11]。同时,微塑料与许多鱼类等动物的食物量级相似,易于被动物误食[3-4],因此,微塑料可通过摄食行为等在动物、植物及微生物之间进行迁移转化。Loureno等[20]研究发现,湿地中的水鸟通过二次摄食其他已经摄入微塑料的动物或已经吸附微塑料的植物而间接摄入微塑料。这表明,在湿地系统中,微塑料可能从植物转移到动物体中,也可以从动物转移到动物中。湿地中的部分微生物可降解微塑料,因此,微塑料也可从沉积物/水体进入微生物中,经过微生物的代谢后,再转化为其他的物质。基于食物链的微塑料的相关研究仍处于研究初期,此种转移途径还需进一步的佐证。
2 微塑料对湿地生态系统的影响
2.1 微塑料对湿地微生物的影响
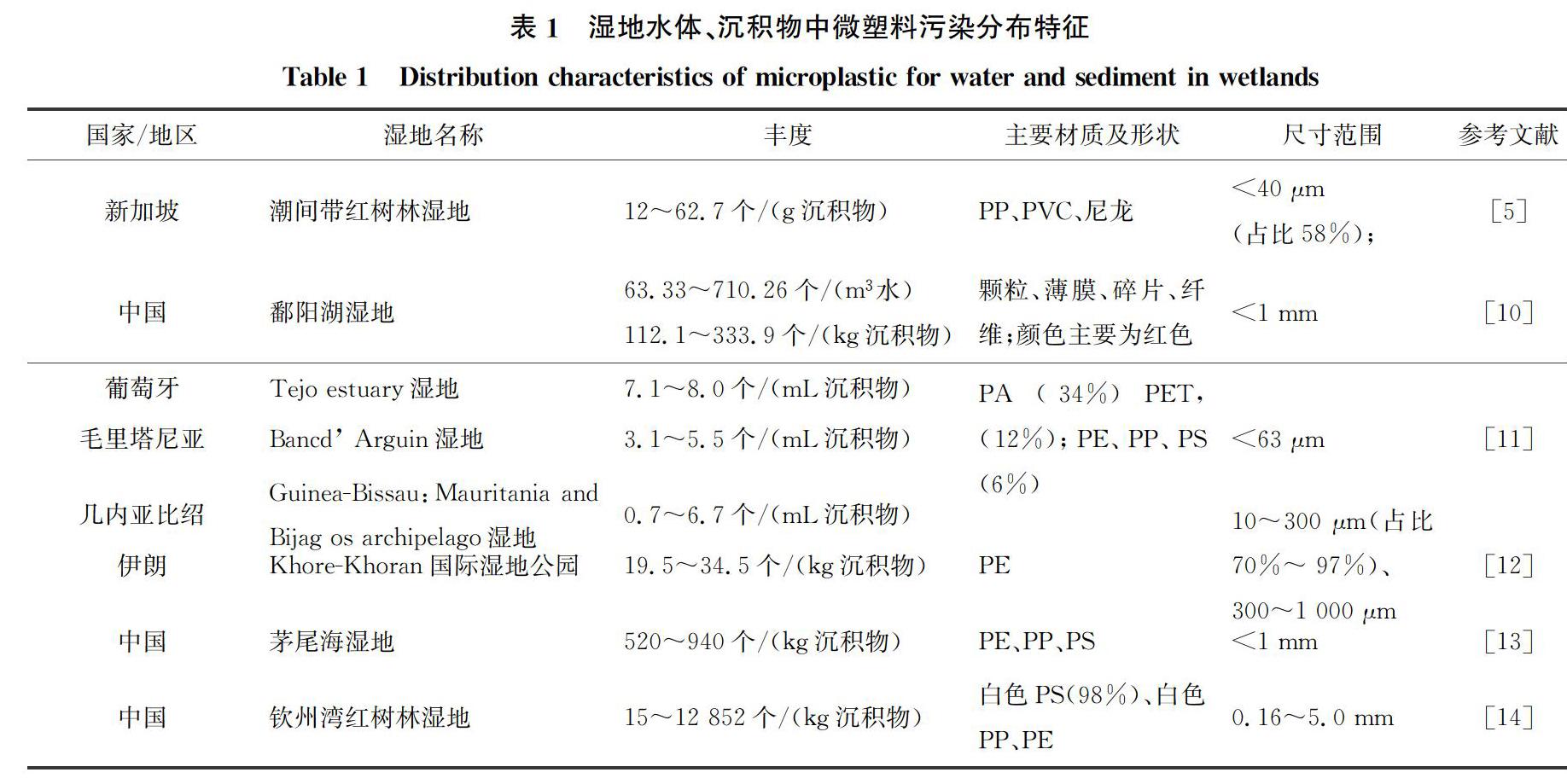
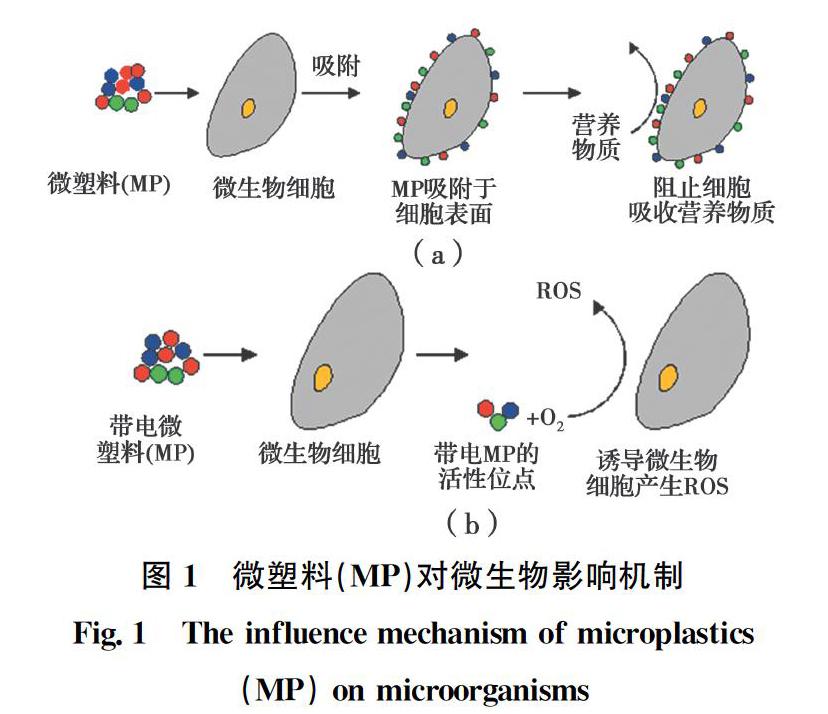
湿地微生物对湿地生态系统至关重要,微生物参与了湿地生态系统中碳、氮、磷和氧等物质的转化和循环过程,在纤维素降解、氮固定等方面起着重要作用[21]。在湿地环境中,微塑料主要通过改变微生物生存条从而件影响微生物生长,具体见图1。
微塑料对微生物的影响表现在以下两个方面:一是微塑料具有疏水亲油的特性,容易被微生物细胞所吸附,从而阻碍微生物细胞吸收营养物质。Awet 等[22]利用分子模拟实验证明纳米PS微塑料易与细胞膜结合,使细胞膜运输营养物质和排出代谢物的功能下降。同时,Su等[23]发现,附着于Cladocopium goreaui藻表面的PS微塑料阻碍微藻的光照及氧气来源,从而影响藻类的光合作用和呼吸速率,使其生长受到抑制。此两项研究结果表明,微塑料的亲脂性较强,易与微生物细胞结合,通过阻碍微生物营养物质的吸收与细胞膜代谢废物的排出而影响微生物生理活性。在湿地环境中,纳米微塑料粒径小,比表面积大,易吸附其他有毒害的污染物,从而形成复合污染物,比单纯微塑料带来的危害更大,因此,探究微塑料生态毒理学效应需要考虑复合污染物。由于检测技术的局限,无法检测到纳米微塑料,因此,此种现象及作用机制有待进一步探究。二是好氧微生物细胞在代谢过程中产生一系列活性氧(Reactive Oxygen Species, ROS),如H2O2及·OH等,微生物在高浓度ROS的环境条件下,细胞会凋亡,甚至导致微生物死亡[24] 。带电微塑料表面上的电子活性位点与O2相互作用使电子被O2捕获,一方面使好氧微生物缺少O2进行新陈代谢;另一方面,诱导好氧微生物细胞生成较多的ROS,危害微生物生长[18]。Bhattacharya等[25] 发现带电的纳米PS微塑料诱导微藻产生大量ROS,高浓度ROS使微藻细胞凋亡。目前也在厌氧环境中发现了这一现象[24],然而,厌氧生物细胞如何产生ROS机理仍不明晰,仍有待进一步研究。
虽然大部分研究指出微塑料对微生物有抑制作用,然而有研究发现,一些细菌、真菌及附着于微塑料上的生物膜可以分解微塑料[26-28]。Paco等[26]从海洋中分离出一种可以降解PE的Zalerion maritimu真菌;Auta等[27]从马来西亚半岛红树林湿地沉积物中获得了两种纯培养的Bacillus sp菌和 Rhodococcus sp菌,在培养40 d后,PP微塑料的重量减轻了6.4%和4.0%,这些研究结果表明,自然环境中存在的一些微生物具有降解微塑料的功能。生物法处理微塑料成本低,不会产生二次污染,因此,在微塑料污染治理方面具有良好前景,然而目前这些微生物都是纯培养,培养周期长、微塑料生物降解率低及降解时间长、可降解的微生物种类少,其降解途径及机理尚不清楚,因此,无法应用于实际環境中塑料垃圾的降解,有待进一步探究其降解机理及研究具有普适性降解微塑料的微生物。
2.2 微塑料对湿地动物的影响
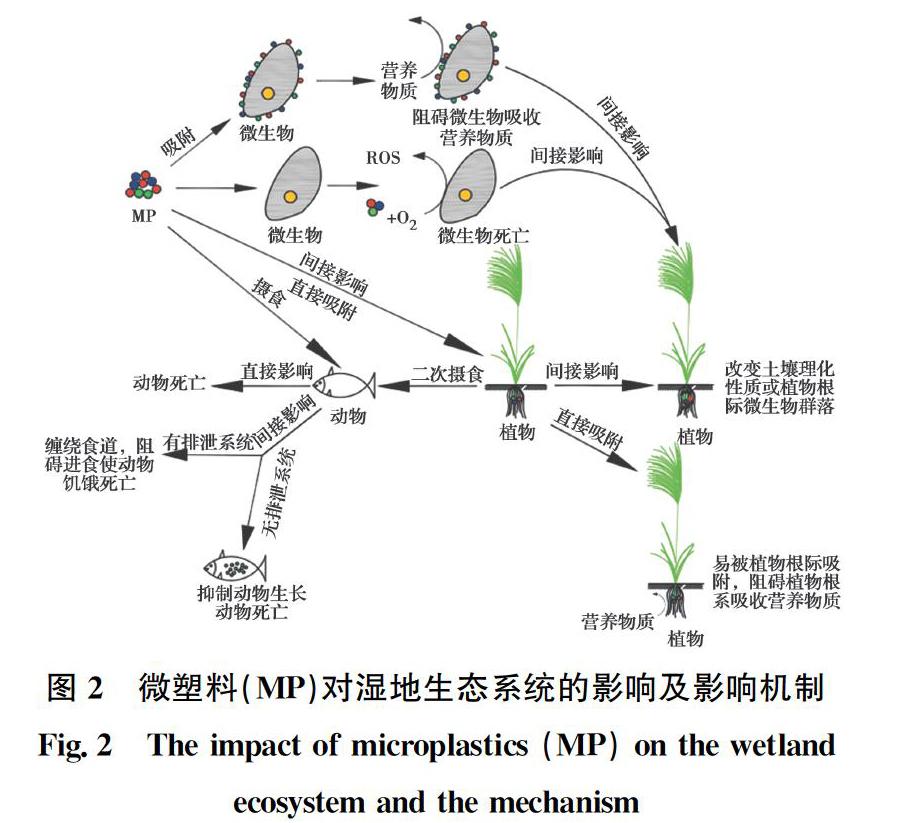
湿地动物主要包括鸟类、鱼类、两栖类和无脊椎动物等。微塑料对湿地动物的影响及其影响机制见图2,主要通过直接毒害和间接影响动物摄食两种方式影响湿地动物的生理活动。
直接毒害作用是指微塑料本身含有的多种有害添加剂及吸附的污染物释放后直接引起动物死亡。Li等[14]发现PVC微塑料中释放的添加剂(三氯生和多溴联苯醚(PBDE-47))和吸附的污染物(壬基酚和菲)使蠕虫个体死亡率上升。
间接作用是指微塑料粒径小,与许多鸟类和鱼类的食物量级相似,易于被这些动物误食[29-30],进而通过摄食行为影响动物正常生理活动。对于有排泄系统的鱼类、鸟类和两栖动物来说,微塑料进入动物体内后,一方面微塑料不能被动物所消化吸收,可能随排泄系统排出,此种途径对动物影响较小。另一方面,纤维状的微塑料可能会缠绕动物的食道,阻塞食管,影响其摄食,从而使动物饥饿而死亡。Boyero等[31]发现PS微塑料经两栖动物蝌蚪摄食后,造成肠道炎症和阻塞,通过影响进食和新陈代谢严重抑制了蝌蚪的生长。对于无排泄系统的无脊椎动物而言,微塑料进入细胞后,不能被动物细胞利用,同时无法排出体内,微塑料在动物体内富集,抑制动物生长或引起动物死亡。
2.3 微塑料对湿地植物的影响
植物是湿地系统的重要组成部分,包括挺水植物、沉水植物及漂浮植物等。微塑料对于植物影响的研究较少,目前,仅报道了在实验室条件下微塑料对植物的影响[32-36]。
微塑料对湿地植物的影响及其影响机制见图2,包括直接影响与间接影响。直接影响指微塑料通过阻碍植物吸收营养物质而抑制植物生长,不同种类、粒径及浓度的微塑料对不同种类植物的影响有差异。Kalˇcíková等[35]发现,PE微塑料通过吸附作用附着于浮萍的根部,阻碍了根部正常营养物质吸收及呼吸作用,从而抑制浮萍生长。Dehaut等[32]发现PS微塑料阻碍了蚕豆根尖吸收营养物质,从而使蚕豆生物量明显减少。这些研究所使用的微塑料浓度(100 mg/L)超过了实际环境中微塑料浓度,同时,微塑料粒径均为纳米级别,但实际环境中纳米塑料的浓度难以衡量。因此,此种作用机制在实际环境中还需要更多的研究进行佐证。
间接影响是指微塑料通过改变植物生存环境的方式影响湿地植物,主要表现在改变土壤理化性质方面。De Souza Machado等[30]发现,PA和PU微塑料会降低土壤容重,从而抑制大葱的生长。Qi等[37]报道农田中的塑料薄膜碎片会使土壤水分增加,土壤通气性变差,使植物干枯。虽然图2中提出微生物影响植物这一影响机制,然而由于土壤中微塑料的研究尚处于起步阶段,因此,土壤中加入微塑料后,是微塑料引起植物生理特性改变还是微塑料引起植物根际微生物变化从而间接改变植物生长,还有待进一步研究。虽然这些研究指出微塑料抑制植物生长,然而这些研究仅限于少数几种微塑料与植物类型,研究结果不具有普适性。同时,目前的研究大部分是在实验室条件下进行,实验室条件下植物的培育与实际环境有较大的差别,这也是研究微塑料对植物毒理学影响需要考虑的因素。
3 湿地环境中微塑料检测分析方法
湿地系统中微塑料存在于湿地水体、沉积物及生物中,因此,需要从湿地的不同组成部分中提取微塑料进行分析,分析步骤包括微塑料的分离提取、纯化及分析鉴别,具体见图3。
3.1 湿地环境中微塑料提取
3.1.1 水体中微塑料的提取
湿地水体体积大,微塑料浓度低,因此,利用体积浓缩法提取微塑料。常用的方法有过滤和筛分法,过滤分为真空抽滤和自然过滤[38],真空抽滤后会使微塑料与滤膜结合紧密,难以将微塑料分离出来;自然过滤滤速慢,效率低。若后续的分析直接用滤膜进行分析,则选用真空过滤法;若需要提取滤膜中的微塑料,则选用自然过滤法。常用的滤膜有玻璃纤维膜、尼龙膜和聚碳酸酯膜等,滤膜孔径范围为0.45~20 μm [39],为了方便后续的顯微镜计数分析,大多数研究中采用1μm孔径的尼龙滤膜[40]。水样过滤后,利用镊子将滤膜中肉眼可见的杂质丢弃,滤膜保存于培养皿中防止污染。筛分法可以对微塑料进行粒径分级,水样一般通过几个孔径由大到小堆叠的筛网,获得几种不同范围粒径的微塑料,常用筛网的孔径范围一般在38~5 000 μm[39-40],筛分法通常用于微塑料粒径分布的研究中。
3.1.2 沉积物中微塑料的提取
沉积物样品中微塑料分离提取的方法包括密度分离与油分离,是指利用盐溶液和油将沉积物离心,形成含有微塑料的混合液,再将混合液过滤而得到目标微塑料。
湿地中丰度较高的微塑料包括PE、PS和PU等[14,16],其密度分别为0.917~0.965、1.04~1.1、1.02~1.05 g/cm3,而沉积物的密度为2.65~2.7 g/cm3[41],利用微塑料与沉积物密度的差异,加入饱和盐溶液进行离心,离心后密度较小的微塑料会浮在盐溶液表面,沉积物会沉在底部,再通过过滤得到目标微塑料。对于采样得到的沉积物样品,可置于60 ℃的烘箱内烘干,烘干后分散均匀,加入饱和盐溶液,用玻璃棒搅拌均匀后,置于4 000 r/min的离心机中离心10 min,得到含有微塑料的混合液,将混合液进行过滤,得到含有微塑料的滤膜,将滤膜置于培养皿中以防止污染,便于后续分析。对于低密度的微塑料,如PE、PS等,加入密度较小的饱和盐溶液如NaCl、CaCl2、ZnCl2等[42-43]进行提取。对于高密度的微塑料,如PVC和PET,可加入碘化钠(NaI, ρ=3.6 g/cm3)[43]、偏钨酸锂溶液(ρ=2.95 g/cm3)[37]密度较高的盐溶液进行提取。本研究采用加标回收的方法,利用NaI溶液分别从细沙中提取2、10 μm的PS微塑料,结果显示,NaI溶液对2 μm PS微塑料第1次提取效率为72.70%,3次总提取效率为85.10%;对10 μm PS微塑料第1次提取效率为73.58%,3次总提取效率为98.25%。然而,在实际操作中NaI溶液容易被氧化析出单质碘,使浮选液变黄,影响后续的观察分析。而且NaI和偏钨酸锂价格昂贵,密度离心后的溶液对水环境有危害,因此限制了其应用。同时,密度分离法容易受到样品杂质的干扰,若样品中杂质多,则分离效果差。
油分离是利用微塑料具有疏水亲油的特性,沉积物中加入植物油后,微塑料与植物油结合,将混合液过滤后,得到目标微塑料。董明潭等[44]利用玉米坯芽油从砂土中提取聚对苯二甲酸乙二醇酯(PET)、PVC、PP和PS,其回收率分别为86.7%±15.3%、96.7%±5.77%、93.3%±11.6%和76.7%±5.77%。对于密度离心法较难提取的高密度微塑料,如PVC和PET,玉米胚芽油从壤土中对其回收率分别为93.3%±11.6%和96.67%±5.77%,从而证明油分离法是有效的微塑料提取方法。然而环境样品中杂质对油分离过程干扰大,因此,油分离法通常用于较为洁净的小样本中微塑料的分离提取。
在沉积物微塑料的分离提取中,可以先利用密度分离法提取低密度微塑料,再利用植物油提取高密度微塑料,一般需要2~3次重复提取,以保证微塑料能够完全分离提取。由于小粒径的微塑料提取需要高密度的浮选液,使得介于微塑料密度与浮选液密度之间的杂质不能去除,因此,密度分离效果差。同时,小粒径的微塑料比表面积大,亲油性极强,使得微塑料与植物油难以分离,因此,目前此两种方法都只适用于较大粒径(>100 μm)微塑料提取,小粒径微塑料的提取方法还需进一步探索。
3.1.3 生物体中微塑料的提取
生物组织主要由蛋白质构成,因此,微塑料提取方法是消解蛋白质组织,将含有微塑料的生物组织置于消解液中,将消解液放置于60~70 ℃下3~14 d后,将含有微塑料的混合液过滤,得到微塑料。目前生物体内提取微塑料的方法有氧化剂消解[45]、强碱消解[45-46]和酶消解[46-47]。各種方法的消解效率见表2。由表2可知,虽然FeSO4+35 % H2O2和HNO3 这两种方法对生物组织中微塑料的提取效率高,但经过此两种溶液消解,目标微塑料的形状会被破坏[45,48]。10% KOH具有消解效率高、试剂对环境无害、易获取的优点,是常使用的消解液,然而KOH消解法所需的消解时间为3~7 d,仅适用于小样本生物组织的消解。因此,开发一种微塑料提取时间短,效率高的方法具有重要意义。
3.2 水体及沉积物样品纯化
有机物的存在会被光谱分析仪器错误识别归为微塑料。为了准确检测微塑料浓度,在光谱分析之前,必须去除混合物中有机质的干扰。常用的提纯方式是消解法。消解的方法与生物体中微塑料的提取方法相同。在进行有机质的消解时,所选取的消解液应具有较高的有机质消解效率、不破坏目标微塑料、价格低、消解条件容易实现等特点。目前常用的消解液是10%KOH[45-46,49],虽然所需的消解时间长,但具有较高的有机质消解效率,且目标微塑料在此溶液中不会破坏,是一种具有前景的有机质消解法。
3.3 微塑料分析鉴别
分离纯化后的微塑料被截留在滤膜上,需要从剩余的混合物中识别微塑料。常用的方法包括目视鉴别法、光谱分析法及热分析法。
3.3.1 目视鉴别法
目视鉴别法是定量识别微塑料常用的方法,利用体式显微镜直接进行计数。利用目视鉴别法鉴别微塑料应遵守以下几个原则:没有细胞或者可见的有机结构和微塑料颗粒始终呈现均匀的颜色[47,20-52]。目视鉴别法易受个人主观因素、显微镜质量和样品基质的影响,随着微塑料尺寸的减小,误差量也增加[52],此种方法适用于杂质少、粒径较大的样品。
3.3.2 光谱分析鉴别法
光谱分析法可以鉴别微塑料类型和反映微塑料表面形貌,是目前常用的鉴定方法。常见的光谱分析法包括傅里叶变换红外光谱(FT-IR)[53-54]、拉曼光谱(Roman)[55]和扫描电子能谱(SEM)[53]。
傅里叶变换红外光谱(FT-IR)是通过化学键、官能团震动吸收确定微塑料类型[53],是一种非破坏性方法,耗时短且检测精度高,最低检测限为20 μm,检测易受环境基质影响,适用于要求精度高、滤膜中杂质少的微塑料分析。拉曼光谱法(Roman)是通过激发分子与样品的辐射相互作用确定微塑料类型[54],最低检测限为1 μm,塑料中的添加剂或色素物质对其干扰大,耗时长,适用于粒径<20 μm的微塑料分析。扫描电子能谱(SEM)通过电子束与样品的相互作用产生样品图,主要是提供颗粒大小与形状的有关信息[50],不能识别微塑料的具体组分。在实际环境中微塑料鉴别时,可以将FT-IR/ Roman与SEM相结合,先利用FT-IR/Roman得到微塑料组分,再通过SEM得到微塑料表面形态的方法进行微塑料的分析鉴定。
3.3.3 热分析鉴别法
热分析法是指在高温下使聚合物分解成小分子物质,再通过质谱(MS)进行分析。在热分析过程中,可以获得微塑料结构信息以及微塑料变化情况[40,54-55]。热分析法是一种破坏性的检测方法,每次分析的样品重量为0.1~0.5 mg[56]。而在热分析过程中,微塑料颗粒必须手动放置在热解管中。由于手工操作只适用于相对较大的颗粒,这就限制了可分析微塑料的最小尺寸。此外,该方法每次循环只能分析一个粒子,耗时长,仪器昂贵。因此,热分析法适用于样品量少,粒径较大的微塑料化学组成分析。
4 结论与展望
对湿地中微塑料的来源及分布、微塑料对湿地动物、植物及微生物的毒理学影响及作用机制和湿地中微塑料的检测技术进行了系统性总结,现有研究表明,湿地环境中微塑料主要分布于沉积物中,占比99%以上,而水体及动物中微塑料浓度较低,占比不到1%,植物与微生物中目前尚未发现微塑料。存在于湿地环境中的微塑料可通过改变微生物生存条件影响湿地微生物,通过直接毒害及间接影响动物摄食两种方式抑制湿地动物生长或使动物死亡;通过阻碍植物吸收营养物质及改变植物生存环境的方式影响其生理活性从而抑制其生长。湿地环境中微塑料的检测流程为微塑料提取样品纯化分析鉴别,针对不同的湿地介质,如水体、沉积物与生物体,根据每种检测方法的适用范围及特点,选择适合的分析鉴别方法。虽然有一些研究已经关注湿地中微塑料污染情况,然而与湿地相关的微塑料研究尚处于初期。因此,未来湿地中微塑料的研究可以从以下几个方面开展:
1)湿地动物是湿地环境的重要组成部分,湿地系统中动物种类多、体系复杂,目前只在鱼类及水鸟中发现微塑料,其余动物中微塑料的污染情况并未明确;同时,大多数研究基于动物个体水平,局限性较大,影响机制未明确。已有学者发现湿地中的动物可通过二次摄食微塑料,未来以食物链为基础,研究整个食物链上微塑料的毒理学影响及影响机制具有重要意义。
2)到目前为止,关于微塑料对淡水植物毒理学研究及其影响机制的报道较少,仅局限于少数几种植物,而且植物培育都是在实验室较为理想的条件下进行,而植物作为湿地的主要组成部分,物种多样,生长条件不一,明确不同种类的植物是否可以吸收微塑料及微塑料在植物体内的迁移转化具有重要意义。同时,由于目前检测技术的局限,尚未在植物体内发现微塑料,因此,未来植物体内的微塑料检测技术及微塑料影响植物的作用机理仍需要进一步探索。
3)隨着环境中微塑料污染越来越严重,微生物降解微塑料研究已经成为热点话题。虽然有学者已经从湿地中离出具有微塑料降解功能的微生物,然而分离出的微生物对微塑料的降解不具有普适性,同时,目前这些微生物都是纯培养,培养周期长、微塑料生物降解率低及降解时间长,其研究仅限于实验室阶段,不能大规模应用。未来可以将重点放在利用分子生物学的手段大规模培养能降解微塑料的微生物,同时开发功能性微生物剂处理微塑料,为实际环境中固体塑料垃圾的处理提供理论依据。
4)存在于自然界的塑料降解时间缓慢、种类多、粒径大小不一,尚未形成标准化的检测方法。检测方法的不统一导致检测结果的正确性难以保证,同类研究之间可比性差。因此,未来的研究可以着重于微塑料,尤其是纳米塑料的检测手段方面,如基于光谱分析的FT-IR技术和荧光染色技术等。
参考文献:
[1] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea:Where is all the plastic? [J]. Science, 2004, 304(5672): 838.
[2] FRIAS J P G L, NASH R. Microplastics: Finding a consensus on the definition [J]. Marine Pollution Bulletin, 2019, 138: 145-147.
[3] VAN CAUWENBERGHE L, DEVRIESE L, GALGANI F, et al. Microplastics in sediments: A review of techniques, occurrence and effects [J]. Marine Environmental Research, 2015, 111: 5-17.
[4] GIGAULT J, HALLE A T, BAUDRIMONT M, et al. Current opinion: What is a nano-plastic [J]. Environmental Pollution, 2018, 235: 1030-1034.
[5] MOHAMED NOR N H, OBBARD J P. Microplastics in Singapores coastal mangrove ecosystems [J]. Marine Pollution Bulletin, 2014, 79(1/2): 278-283.
[6] LIU H Y, TANG L, LIU Y N, et al. Wetland-a hub for microplastic transmission in the global ecosystem [J]. Resources Conservation and Recycling, 2019, 142: 153-154.
[7] HUANG J S, KOONGOLLA J B, LI H X, et al. Microplastic accumulation in fish from Zhanjiang mangrove wetland, South China [J]. Science of the Total Environment, 2020, 708: 134839.
[8] SU L, NAN B X, HASSELL K L, et al. Microplastics biomonitoring in Australian urban wetlands using a common noxious fish (Gambusia holbrooki) [J]. Chemosphere, 2019, 228: 65-74.
[9] GIL-DELGADO J A, GUIJARRO D, GOSLVEZ R U, et al. Presence of plastic particles in waterbirds faeces collected in Spanish lakes [J]. Environmental Pollution, 2017, 220: 732-736.
[10] 刘淑丽, 简敏菲, 周隆胤, 等. 鄱阳湖湿地候鸟栖息地微塑料污染特征[J]. 环境科学, 2019, 40(6): 2639-2646.
LIU S L, JIAN M F, ZHOU L Y, et al. Pollution characteristics of microplastics in migratory bird habitats located within Poyang Lake wetlands [J]. Environmental Science, 2019, 40(6): 2639-2646.(in Chinese)
[11] LOURENO P M, SERRA-GONALVES C, FERREIRA J L, et al. Plastic and other microfibers in sediments, macroinvertebrates and shorebirds from three intertidal wetlands of southern Europe and west Africa [J]. Environmental Pollution, 2017, 231: 123-133.
[12] NAJI A, NURI M, AMIRI P, et al. Small microplastic particles (S-MPPs) in sediments of mangrove ecosystem on the northerncoast of the Persian Gulf [J]. Marine Pollution Bulletin, 2019, 146: 305-311.
[13] LI R L, ZHANG L L, XUE B M, et al. Abundance and characteristics of microplastics in the mangrove sediment of the semi-enclosed Maowei Sea of the South China sea: New implications for location, rhizosphere, and sediment compositions [J]. Environmental Pollution, 2019, 244: 685-692.
[14] LI J, ZHANG H, ZHANG K N, et al. Characterization, source, and retention of microplastic in sandy beaches and mangrove wetlands of the Qinzhou Bay, China [J]. Marine Pollution Bulletin, 2018, 136: 401-406.
[15] TUNAHAN KAYA A, YURTSEVER M, IFTI BAYRAKTAR S. Ubiquitous exposure to microfiber pollution in the air [J]. The European Physical Journal Plus, 2018, 133(11): 1-9.
[16] GUO J J, HUANG X P, XIANG L, et al. Source, migration and toxicology of microplastics in soil [J]. Environment International, 2020, 137: 105263.
[17] LI C R, BUSQUETS R, CAMPOS L C. Assessment of microplastics in freshwater systems:A review [J]. Science of the Total Environment, 2020, 707: 135578.
[18] LI X W, CHEN L B, MEI Q Q, et al. Microplastics in sewage sludge from the wastewater treatment plants in China [J]. Water Research, 2018, 142: 75-85.
[19] SUN J, DAI X H, WANG Q L, et al. Microplastics in wastewater treatment plants: Detection, occurrence and removal [J]. Water Research, 2019, 152: 21-37.
[20] LOURENO P M, SERRA-GONALVES C, FERREIRA J L, et al. Plastic and other microfibers in sediments, macroinvertebrates and shorebirds from three intertidal wetlands of southern Europe and west Africa [J]. Environmental Pollution, 2017, 231: 123-133.
[21] BURNS R G, DEFOREST J L, MARXSEN J, et al. Soil enzymes in a changing environment: Current knowledge and future directions [J]. Soil Biology and Biochemistry, 2013, 58: 216-234.
[22] AWET T T, KOHL Y, MEIER F, et al. Effects of polystyrene nanoparticles on the microbiota and functional diversity of enzymes in soil [J]. Environmental Sciences Europe, 2018, 30(1): 1-10.
[23] SU Y L, ZHANG K D, ZHOU Z, et al. Microplastic exposure represses the growth of endosymbiotic dinoflagellate Cladocopium goreaui in culture through affecting its apoptosis and metabolism [J]. Chemosphere, 2020, 244: 125485.
[24] WEI W, HUANG Q S, SUN J, et al. Revealing the mechanisms of polyethylene microplastics affecting anaerobic digestion of waste activated sludge [J]. Environmental Science & Technology, 2019, 53(16): 9604-9613.
[25] BHATTACHARYA P, LIN S J, TURNER J, et al. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis [J]. Journal of Physical Chemistry C, 2010, 114(39): 16556-16561.
[26] PAO A, DUARTE K, DA COSTA J P, et al. Biodegradation of polyethylene microplastics by the marine fungus Zalerion maritimum [J]. Science of The Total Environment, 2017, 586: 10-15.
[27] AUTA H S, EMENIKE C U, JAYANTHI B, et al. Growth kinetics and biodeterioration of polypropylene microplastics by Bacillus sp. and Rhodococcus sp. isolated from mangrove sediment [J]. Marine Pollution Bulletin, 2018, 127: 15-21.
[28] YUAN J H, MA J, SUN Y R, et al. Microbial degradation and other environmental aspects of microplastics/plastics [J]. Science of the Total Environment, 2020, 715: 136968.
[29] 屈沙沙, 朱會卷, 刘锋平, 等. 微塑料吸附行为及对生物影响的研究进展[J]. 环境卫生学杂志, 2017, 7(1): 75-78.
QU S S, ZHU H J, LIU F P, et al. Adsorption behavior and effect on biont of microplastic [J]. Journal of Environmental Hygiene,, 2017, 7(1): 75-78.(in Chinese)
[30] DE SOUZA MACHADO A A, LAU C W, KLOAS W, et al. Microplastics can change soil properties and affect plant performance [J]. Environmental Science & Technology, 2019, 53(10): 6044-6052.
[31] BOYERO L, LPEZ-ROJO N, BOSCH J, et al. Microplastics impair amphibian survival, body condition and function [J]. Chemosphere, 2020, 244: 125500.
[32] DEHAUT A, CASSONE A L, FRRE L, et al. Microplastics in seafood: Benchmark protocol for their extraction and characterization [J]. Environmental Pollution, 2016, 215: 223-233.
[33] 李连祯, 周倩, 尹娜, 等. 食用蔬菜能吸收和积累微塑料[J]. 科学通报, 2019, 64(9): 928-934.
LI L Z, ZHOU Q, YIN N, et al. Uptake and accumulation of microplastics in an edible plant [J]. Chinese Science Bulletin, 2019, 64(9): 928-934.(in Chinese)
[34] 廖苑辰, 娜孜依古丽·加合甫别克, 李梅, 等.微塑料对小麦生长及生理生化特性的影响[J]. 环境科学,2019, 40(10): 4661-4667.
LIAOY C, GU L, LI M, et al. Effects of microplastics on wheat growth and physiological and biochemical characteristics[J].
Environmental Science, 2019, 40(10): 4661-4667. (in Chinese)
[35] KALˇCKOV G, GAJNAR GOTVAJN A, KLADNIK A, et al. Impact of polyethylene microbeads on the floating freshwater plant duckweed Lemna minor [J]. Environmental Pollution, 2017, 230: 1108-1115.
[36] DE SOUZA MACHADO A A, LAU C W, KLOAS W, et al. Microplastics can change soil properties and affect plant performance [J]. Environmental Science & Technology, 2019, 53(10): 6044-6052.
[37] QI Y L, YANG X M, PELAEZ A M, et al. Macro- and micro- plastics in soil-plant system: Effects of plastic mulch film residues on wheat (Triticum aestivum) growth [J]. Science of the Total Environment, 2018, 645: 1048-1056.
[38] HIDALGO-RUZ V, GUTOW L, THOMPSON R C, et al. Microplastics in the marine environment: a review of the methods used for identification and quantification [J]. Environmental Science & Technology, 2012, 46(6): 3060-3075.
[39] ZOBKOV M B, ESIUKOVA E E. Microplastics in a marine environment: review of methods for sampling, processing, and analyzing microplastics in water, bottom sediments, and coastal deposits [J]. Oceanology, 2018, 58(1): 137-143.
[40] 顾伟康, 杨国峰, 刘艺, 等.环境介质中微塑料的处理与检测方法研究进展[J]. 土木与环境工程学报(中英文), 2020,42(1): 135-143.
GU W K, YANG G F, LIU Y, et al. Treatment and detection methods of microplastics from environmental media: A review [J]. Journal of Civil and Environmental Engineering, 2020,42(1): 135-143. (in Chinese)
[41] HE D F, LUO Y M, LU S B, et al. Microplastics in soils: Analytical methods, pollution characteristics and ecological risks [J]. Trends in Analytical Chemistry, 2018, 109: 163-172.
[42] ZHANG K, SHI H H, PENG J P, et al. Microplastic pollution in Chinas inland water systems:A review of findings, methods, characteristics, effects, and management [J]. Science of the Total Environment, 2018, 630: 1641-1653.
[43] MASURA J, BAKER J, FOSTER G, et al. Laboratory methods for the analysis of microplastics in the marine environment: Recommendations for quantifying synthetic particles in waters and sediments: Technical Memorandum NOS-OR&R-48 [R]. National Oceanic and Atmospheric Administration, U. S. Department of Commerce, 2015.
[44] 董明潭, 羅泽娇, 邢新丽, 等. 基于油提取分离土壤与沉积物中微塑料的方法[J/OL]. 环境科学研究. http://kns.cnki.net/kcms/detail/11.1827.X.20191009.1827.005.html.
DONG M T, LUO Z J, XING X L, et al. Method for separating microplastics in soil and sediment based on oil extraction [J/OL]. Research of Environmental Sciences, http://kns.cnki.net/kcms/detail/11.1827.X.20191009.1827.005.html. (in Chinese)
[45] MUNNO K, HELM P A, JACKSON D A, et al. Impacts of temperature and selected chemical digestion methods on microplastic particles [J]. Environmental Toxicology and Chemistry, 2018, 37(1)91-98
[46] 吴文楠, 高俊敏, 沈茜, 等. 生物体微塑料提取方法比选研究[J]. 中国环境科学, 2019, 39(10): 4343-4349.
WU W N, GAO J M, SHEN Q, et al. Comparison of microplastic extraction methods from organisms [J]. China Environmental Science, 2019, 39(10): 4343-4349.(in Chinese)
[47] COURTENE-JONES W, QUINN B, MURPHY F, et al. Optimisation of enzymatic digestion and validation of specimen preservation methods for the analysis of ingested microplastics [J]. Analytical Methods, 2017, 9(9): 1437-1445.
[48] HELCOSKI R, YONKOS L T, SANCHEZ A, et al. Wetland soil microplastics are negatively related to vegetation cover and stem density [J]. Environmental Pollution, 2020, 256: 113391.
[49] 邹亚丹, 徐擎擎, 张哿, 等. 6种消解方法对荧光测定生物体内聚苯乙烯微塑料的影响[J]. 环境科学, 2019, 40(1): 496-503.
ZOU Y D, XU Q Q, ZHANG G, et al. Influence of six digestion methods on the determination of polystyrene microplastics in organisms using the fluorescence intensity [J]. Environmental Science, 2019, 40(1): 496-503.(inChinese)
[50] HANVEY J S, LEWIS P J, LAVERS J L, et al. A review of analytical techniques for quantifying microplastics in sediments [J]. Analytical Methods, 2017, 9(9): 1369-1383.
[51] 王志超, 孟青, 李卫平, 等. 不同消解方法对微塑料质量及其表面特征的影响[J]. 环境工程学报, 2020, 14(5): 1385-1393.
WANG Z C, MENG Q, LI W P, et al. Effect of different digestion methods on microplastic quality and surface characteristics [J]. Chinese Journal of Environmental Engineering, 2020, 14(5): 1385-1393.(in Chinese)
[52] LI J Y, LIU H H, PAUL CHEN J. Microplastics in freshwater systems: A review on occurrence, environmental effects, and methods for microplastics detection [J]. Water Research, 2018, 137: 362-374.
[53] PENG G Y, XU P, ZHU B S, et al. Microplastics in freshwater river sediments in Shanghai, China: A case study of risk assessment in mega-cities [J]. Environmental Pollution, 2018, 234: 448-456.
[54] DMICHEN E, EISENTRAUT P, BANNICK C G, et al. Fast identification of microplastics in complex environmental samples by a thermal degradation method [J]. Chemosphere, 2017, 174: 572-584.
[55] RODRIGUES M O, ABRANTES N, GONALVES F J M, et al. Spatial and temporal distribution of microplastics in water and sediments of a freshwater system (Antu River, Portugal) [J]. Science of The Total Environment, 2018, 633: 1549-1559.
[56] PENG G Y, BELLERBY R, ZHANG F, et al. The oceans ultimate trashcan: Hadal trenches as major depositories for plastic pollution [J]. Water Research, 2020, 168: 115121.
(編辑 胡玲)
