没食子酸对鼻咽癌体外放射敏感性的影响*
2021-04-06林重华楚婷许美凤李路师盼舒易方瞿家权
林重华,楚婷,许美凤,李路,师盼,舒易方,瞿家权,,
(1.吉首大学医学院医学影像技术系,湖南吉首 416000;2.重庆市黔江中心医院肿瘤科,重庆 409000;3.中国人民解放军陆军军医大学第一附属医院消化内科,重庆 400038;4.中国人民解放军陆军军医大学第一附属医院肿瘤科放疗室,重庆 400038)
没食子酸(gallic acid,GA)又称为五倍子酸或棓酸,是一种具有多酚结构有机酸[1],主要存在于五倍子、漆树、金缕梅、茶叶、橡树皮等植物中,药用或工业提取没食子酸的主要途径是通过水解五倍子。五倍子药材的有效成份主要是没食子酸,具有抗氧化、抗菌和抗病毒作用,有较高畜牧水产养殖和药用开发价值[2]。小剂量没食子酸抑制ras癌基因信号活化和免疫调节的作用,但其抗肿瘤作用具体机制不明[3-4]。鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南方地区高发的头颈部恶性肿瘤,以低分化未分化癌为主要组织学类型,对放化疗均敏感[5]。放射治疗完全缓解后肿瘤复发和远处转移是晚期鼻咽癌治疗棘手的问题,获得性放疗抵抗被认为是鼻咽癌复发和转移的关键影响因素[6]。因此,本研究采用放疗增敏药物筛选模型检测没食子酸对鼻咽癌细胞增殖和体外放疗敏感性影响,并初步探讨没食子酸增加放疗诱导的肿瘤细胞杀伤作用的分子机制,为进一步定向筛选放疗协同增效候选化学实体和天然多酚和黄酮类抗肿瘤分子靶点研究提供依据。
1 材料与方法
1.1材料
1.1.1受试物 没食子酸一水合物(货号:398225)购于Sigma-Aldrich公司,含量≥98.0%,符合美国化学协会标准。没食子酸一水合物用磷酸盐缓冲液溶解后,经0.45 μm无菌滤器过滤,配制成母液浓度为500.0 μmol·L-1的溶液,置于-20 ℃冰箱中保存备用。
1.1.2细胞 人鼻咽癌细胞系HNE-1从中南大学湘雅医学研究中心购买,10%胎牛血清RPMI-1640完全培养基(HyClone公司,货号:SH30809.01),置于5%二氧化碳恒温37 ℃细胞培养箱,常规消化传代,对数生长期制成单细胞悬液备用。放疗抵抗鼻咽癌细胞株参考文献[7]采用深部X射线多分次亚致死剂量暴露法构建。本研究采用的放疗抵抗HNE1-IR和对照组放疗敏感HNE1细胞株均为多轮亚致死照射后4~15传代并通过下文的放射克隆存活法鉴定。
1.1.3试剂 RPMI-1640培养基(HyClone公司,货号:SH30809,01);胎牛血清(以色列Biological Industries公司,批号:04-121-1A);胰蛋白酶、RIPA细胞裂解液、Hoechst33258荧光染料溶液、0.5%结晶紫染料购于碧云天生物技术有限公司(批号:C0203,P0013K,C1018,C0121);Annexin V-FITC/7-AAD双染细胞凋亡检测试剂盒(美国BD Biosciences公司,货号:556547),噻唑蓝(MTT)、二甲亚砜(DMSO)均为美国Sigma公司(货号:M2128,472301);蛋白酶和磷酸化酶抑制剂为美国Roche公司(货号:4693159001,4906837001);β-actin和程序性死亡配体1(programmed dealth-ligand 1,PD-L1)人单克隆抗体,抗兔和抗鼠二抗均为美国Santa Cruz公司(货号:sc-8432,sc-293425,sc-2357,sc-516102),STAT3和STAT3(Tyr705)位点磷酸化和c-Jun(Ser63)位点磷酸化单克隆抗体为美国CST公司(货号:#12640,#9145,#91952)。
1.1.4仪器 双目倒置相差显微镜,日本Olympus,CKX41型;二氧化碳细胞培养箱,美国Thermo Fisher,Forma Serises 3 Water Jacketed型;双目倒置荧光显微镜,日本Olympus;酶标仪(iMark型号),美国Biorad有限公司;6~10 MeV,双光子射线,Varian Clinac 2100 C/D医用直线加速器为美国Varian公司产品。
1.2方法
1.2.1MTT比色法 取对数生长期HNE1和HNE1-IR细胞,以每孔约1000个HNE1-IR细胞/180 μL接种于96孔培养板中,分别加入20 μL没食子酸工作液(母液浓度为40 mmol·L-1),使其终浓度分别为5.0,10.0,25.0,50.0,100.0,200.0 μmol·L-1,溶媒对照组每孔加入20 μL PBS溶液的完全培养基,采用顺铂(DDP)作为阳性对照组(终浓度为10.0 μmol·L-1);每组设5个复孔,分别培养48和72 h。终浓度2.5 μmol·L-1没食子酸给药预处理HNE1和HNE1-IR细胞24 h后,联合分割放疗(DT:4Gy,2Gy/F,1F/d×2)后继续培养24和48 h,每孔加入5 mg·mL-1的MTT液20 μL,测定细胞抑制率并拟合曲线获得半数抑制浓度(IC50),实验重复3次。
1.2.2Hoechst染色凋亡检测法 取对数生长期HNE1和HNE1-IR细胞,以每孔约10 000个细胞接种于6孔板中,完全培养基细胞接种过夜后,次日开始给予单剂量的2.5 μmol·L-1没食子酸联合分割放疗(DT:6 Gy,1.2 Gy/F,1F/d×5)处理细胞,对照组细胞给予假照射处理,继续培养24 h,收集贴壁细胞,多聚甲醛冰上固定30 min,5 μg·mL-1Hoechst 33258溶液重悬细胞避光孵育10 min,离心洗涤后,再重悬细胞制备细胞涂片,荧光显微镜下观察典型的凋亡细胞在形态学上可出现染色质固缩,核碎裂以及核发泡等改变。凋亡细胞百分比计算方法为:在6个随机显微镜视野下选取细胞400个计算其中的凋亡细胞数目,重复3次。
1.2.3流式细胞术7-AAD/Annexin V-FITC双染色凋亡检测法 取对数生长期细胞,以每孔约10 000个细胞接种于6孔板中,完全培养基细胞接种过夜后,次日开始给予单剂量的2.5 μmol·L-1没食子酸联合分割放疗(DT:6 Gy,1.2 Gy/F,1F/d×5)处理细胞,对照组细胞给予假照射处理,继续培养24 h,收集贴壁细胞,按Annexin V-FITC/7-AAD双染细胞凋亡检测试剂盒操作说明如下:加入Annexin V-FITC染色液5 μL,避光孵育15 min,随后加入7-AAD染色液5 μL后轻轻混匀于2~8 ℃避光条件下孵育5 min,上机采用流式细胞仪检测细胞凋亡,实验重复3次。
1.2.4放射克隆存活实验 常规6孔培养板按3种细胞密度接种(每孔500,1000,2000个),待细胞贴壁后,培养板上层覆盖补偿胶1.0 cm,皮源距100 cm,等中心照射,剂量深度2.5 cm,剂量建成区野与6孔板细胞的投影面积重合,吸收率为200 cGy·min-1,分别暴露于0(灯光野假照射),1.0,2.0,4.0,6.0,8.0 Gy的梯度剂量的X-射线下(6 MeV,X-射线,Varian Clinac 2100直线加速器),照射后静置于细胞培养箱中继续培养14~18 d,0.5%结晶紫染色,细胞50个以上克隆计数。按公式计算:克隆效率=存活克隆数/接种细胞数,生存分数=克隆效率处理组/克隆效率对照组,其中0 Gy射线暴露为对照组。采用GraphPad Prism 5.0版软件,按照线性二次方程模型S=e-αD-βD2拟合剂量反应曲线,其中S为生存分数,α和β为常数,D为剂量,计算存活曲线下面积(area under the curve,AUC)和放射保护因子(radiation protection factor,RPF),重复3次。
1.2.5免疫印迹法 处理细胞加蛋白酶和磷酸化酶抑制剂的RIPA细胞裂解液,于冰上裂解30 min,4 ℃,10 000×g离心20 min,吸取上清液,BCA 法蛋白定量,常规煮沸变性5 min,样品蛋白上样量为每泳道30 μg,10% SDS-PAGE 变性凝胶电泳,电泳条件:积层胶50 V,分离胶120 V恒定电压电泳分离,电转移条件:采用恒定电流(100 mA,1.5 h)至厚度0.22 μm PVDF 膜上。5%脱脂牛奶在室温下封闭1~2 h,孵一抗4 ℃过夜,β-actin抗体浓度为1:5 000,PD-L1抗体浓度为1:500,STAT3和磷酸化STAT3抗体及磷酸化c-Jun浓度均为1:1 000,室温下孵二抗(1:5 000)1.5 h,加发光剂后压片(3~15 min),显影定影(3~5 min),采用Alpha Image图像分析系统对胶片扫描分析。
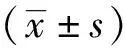
2 结果
2.1放疗抵抗的鼻咽癌细胞株筛选及鉴定 放射克隆存活实验分析鼻咽癌细胞放疗敏感性结果显示,与放疗敏感HNE1细胞株比较,HNE1-IR细胞株放疗敏感性显著降低[AUC(HNE1-IR)2.119vs.AUC(HNE1)1.491,P<0.05;放射保护因子=1.421](图1)。
2.2没食子酸对鼻咽癌细胞放疗敏感性的影响 没食子酸对鼻咽癌HNE1-IR和HNE1细胞株的增殖具有抑制作用,其IC50值分别为12.58和11.17 μmol·L-1。单纯放疗对HNE1-IR和HNE1细胞株抑制率分别为:(66.2±8.4)%,(79.3±8.4)%,差异有统计学意义(P<0.05)(图2 B);而2.5 μmol·L-1没食子酸同期联合放疗对HNE1-IR和HNE1细胞株抑制率分别为:(87.3±5.1)%,(91.3±6.4)%,差异无统计学意义(P>0.05)。放射克隆存活实验线性二次方程靶模型结果显示,与对照组HNE1细胞比较,没食子酸联合放疗处理HNE1-IR细胞线性二次方程拟合克隆存活曲线下面积差异值显著增加[AUC(HNE1-IR+GA)1.726vs.AUC(HNE1+GA)1.341,ΔAUC(HNE1-IR+GA)0.393vs.AUC(HNE1+GA)0.150,t=2.714,P<0.05](图2A)。上述结果提示,小剂量没食子酸可能具有非依赖细胞毒的鼻咽癌体外放疗增敏作用。

A.线性二次模型拟合放射存活曲线及曲线下面积差值比较没食子酸对放疗增敏作用的影响;B.平皿培养18 d没食子酸联合放疗4 Gy处理对不同放疗敏感性的鼻咽癌细胞存活克隆染色数量和大小比较。
2.3没食子酸联合放疗处理对鼻咽癌细胞凋亡的影响 为了进一步分析单纯放疗或同期联合没食子酸对鼻咽癌细胞凋亡的影响,本研究采用Hoechst染色凋亡检测法分析细胞凋亡形态学改变,结果证实,与对照组比较,2.5 μmol·L-1没食子酸同期联合放疗处理HNE1-IR细胞凋亡率的差值显著增加[Δ凋亡率(HNE1-IR+GA+RT)-(HNE1-IR+GA)=14.2%vs.Δ凋亡率(HNE1+GA+RT)-(HNE1+GA)=6.1%,t=4.799,P<0.05](图3C)。相似地,流式细胞凋亡检测法分析结果证实,与对照组HNE1细胞株比较,2.5 μmol·L-1没食子酸同期联合放疗处理HNE1-IR细胞凋亡率的差值显著增加[Δ凋亡率(HNE1-IR+GA+RT)-(HNE1-IR+GA)=13.7%vs.Δ凋亡率(HNE1+GA+RT)-(HNE1+GA)=10.3%,t=2.231,P<0.05](图3D)。上述结果提示,没食子酸通过诱导细胞凋亡,增加鼻咽癌细胞株的放疗敏感性。

A.典型的Hoechst染色荧光显微镜下观察细胞凋亡形态学改变,白色箭头显示典型的凋亡形态学改变高染色的核固缩、核碎裂、核边集等改变;B.流式细胞术双荧光染色分析鼻咽癌细胞凋亡形态学改变;C.Hoechst染色荧光显微镜观察比较各组细胞凋亡率差异;D.流式细胞术双荧光染色比较各组细胞凋亡率差异。①与HNE1比较,P<0.01;②与对照组比较,P<0.01。
2.4没食子酸联合放疗处理对鼻咽癌细胞STAT3和c-Jun信号活化及PD-L1蛋白表达水平的影响 为分析低浓度没食子酸增加鼻咽癌细胞株放疗敏感性的分子机制,本研究采用免疫印迹法分析了没食子酸对放疗诱导的细胞信号传导和免疫检查点抑制分子的影响,结果证实,与对照组比较,低浓度没食子酸联合放疗处理显著下调HNE1-IR细胞株STAT3和c-Jun磷酸化水平,但并不能完全逆转放射线诱导的HNE1-IR细胞PD-L1蛋白表达上调。结合上述结果提示,没食子酸联合放疗处理可能部分抑制鼻咽癌细胞STAT3和c-Jun信号活化,但不影响放疗诱导的肿瘤免疫检查点负调控PD-L1蛋白水平的表达,见图4。

A.典型的免疫印迹图片比较鼻咽癌细胞STAT3和c-Jun信号磷酸化和PD-L1表达水平;B.半定量分析鼻咽癌细胞STAT3,c-Jun活化水平和PD-L1表达水平;①与HNE1-IR/RT+vehicle比较,P<0.01。
3 讨论
放射治疗(radiotherapy,RT)是包括鼻咽癌在内的头颈部肿瘤的首选和基础性的治疗措施[5]。鼻咽癌放疗后病灶中残留生存的肿瘤细胞可复发和远处转移,最终导致治疗失败,已成为制约鼻咽癌疗效改善的瓶颈[6]。目前暂无作为A类证据用于鼻咽癌临床治疗的非细胞毒放疗增敏剂,且少数几种其他肿瘤放疗增敏的候选药物也处于临床前评估阶段[7]。因此,定向测试放疗增敏的候选化学实体,筛选高效低毒的放疗增敏候选药物,特别是低细胞毒药物可与目前放疗和(或)免疫治疗药物联用,对克服肿瘤放疗抵抗和改善鼻咽癌疗效具有临床价值[8]。本研究通过定向筛选策略和放疗体外模型初步证实,没食子酸具有鼻咽癌体外放疗增敏作用,放疗增敏的分子机制可能是通过抑制STAT3和c-Jun信号活化而并不阻断PD-L1蛋白水平表达,增加放射性诱导的细胞凋亡,上述结果为进一步筛选并鉴定潜在放疗增敏剂的研究提供依据。
本研究成功构建放射敏感性差异的2株鼻咽癌细胞模型。常规分割放疗或亚致死性分割放疗,可通过健存肿瘤细胞加速再群化(repopulation)在放疗间期使部分肿瘤细胞亚群呈现快速增殖状态,从而诱导出放疗抗拒的亚克隆,最终使肿瘤产生获得性放疗抵抗[9]。因此,放射生物学基础研究通常模拟临床的分割放疗模式,采用多轮亚致死放疗暴露法筛选出放疗抵抗的肿瘤细胞株,进而构建放疗抵抗细胞模型。本研究也采用此类模型并通过随后实验证实,低浓度没食子酸(2.5 μmol·L-1)对2株放疗反应性不同的鼻咽癌细胞具有相似的细胞毒作用,没食子酸对放疗抵抗HNE1-IR细胞的增敏效应高于放疗敏感细胞株HNE1;没食子酸增加放疗诱导的凋亡效应也高于放疗敏感细胞株HNE1。上述结果提示,低浓度没食子酸可能具有非依赖细胞毒的放疗增敏作用。研究提示,黄酮和多酚类的放疗增敏[10]可能与细胞毒非依赖性作用相关。本研究所报道的小剂量没食子酸具有鼻咽癌细胞体外放疗增敏作用与上述报道类似。
一般而言,放射线及其诱导产生的活性氧物质(reactive oxygen species,ROS)损伤DNA等生物大分子,诱导肿瘤细胞凋亡,发挥放射治疗作用[11]。亚致死剂量放射线在诱导分割放疗获得性的肿瘤放疗抵抗相关[12],通过激活健存肿瘤细胞自身防御功能和细胞生存信号通路包括NF-κB信号通路、STAT3信号通路和PI3K/AKT信号通路,进而诱导DNA损伤修复能力增强而对抗放射线杀伤。本研究分析单纯放疗或同期联合没食子酸处理对鼻咽癌细胞增殖、存活、免疫检查点信号分子表达的影响,结果证实,低浓度没食子酸可显著阻断放疗抵抗鼻咽癌细胞STAT3信号活化。提示,没食子酸可能通过抑制STAT3信号活化,调控亚致死剂量放射诱导的细胞生存信号,发挥非细胞毒放疗增敏效应。此结果与大量的关于STAT3信号通路活化参与头颈部鳞癌和鼻咽癌获得性放化疗抵抗研究一致,而STAT3也可能是没食子酸放疗增敏作用的潜在分子靶点。同样的,根据鼻咽癌组织和正常鼻咽上皮表达谱芯片在公共数据库的表达差异分析研究的线索[13],促生存和抑制凋亡的信号通路和转录因子调控网络节点分子c-Jun可能作为肿瘤的生物标志物。本研究证实,没食子酸联合放疗处理下调鼻咽癌细胞磷酸化c-Jun信号。国内其他研究组采用裸鼠人鼻咽癌细胞移植瘤模型结果[14]与本研究的结果一致,抑制c-Jun表达或采用基因沉默方式敲低c-Jun表达可抑制放射抵抗鼻咽癌移植瘤的生长及血管生成。因此,c-Jun作为多种转录因子网路系统节点分子可能参与没食子酸对鼻咽癌细胞放疗增敏过程。肿瘤免疫治疗被认为是克服放疗抵抗的一种有效策略,肿瘤组织高表达PD-L1是免疫治疗疗效预测的重要标志物[15]。普通分割放疗和免疫治疗联用的临床前数据和早期披露的临床试验数据存在分歧,一方面,亚致死剂量放疗可促进暴露的肿瘤组织释放新抗原,甚至可观察到肿瘤免疫激活和放疗远隔效应(abscopal effect)[16],发挥免疫治疗增效作用;另一方面,亚致死剂量放疗诱导细胞STAT3信号活化,诱导PD-L1表达上调[17],抑制效应T淋巴细胞免疫杀伤作用,促进肿瘤发生免疫逃逸。本研究结果初步证实,低浓度没食子酸并不抑制亚致死剂量放疗诱导的PD-L1蛋白表达水平上调。然而,没食子酸是否协同免疫治疗增效作用以及是否协同效应T细胞肿瘤的免疫杀伤作用,仍需要采用免疫治疗和放疗体内外模型进一步验证。
综上所述,本研究初步证实小剂量没食子酸可能抑制鼻咽癌细胞STAT3和c-Jun信号活化,增加放射线诱导的细胞凋亡,发挥细胞毒非依赖性的放疗增敏作用。没食子酸抑制STAT3活化但并不阻断PD-L1蛋白水平,可与鼻咽癌综合治疗策略联合,发挥协同增效作用的潜力。
