氮杂环丙烷[3+3]环加成反应研究进展
2021-04-02朱文庆张紫薇韩文勇
朱文庆,张紫薇,韩文勇
(1.西安工程大学 环境与化学工程学院 陕西 西安 710048;2.遵义医科大学 药学院 贵州省生物催化与手性药物合成重点实验室 贵州 遵义 563006;3.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室 贵州 遵义 563006)
在新物质的合成过程中,杂环化合物扮演着极其重要的角色,是现代药物分子结构中的重要组成。杂环类药物因其杂环结构的特殊性而广泛受到从事化学、药学和生命科学研究科学家的高度关注,比如药物分子中杂环结构的存在不仅影响药物分子与受体之间的相互作用,而且可以降低药物分子的亲油性,从而有利于提高药物分子的溶解度[1]。因此,如何快速并高效地进行杂环化合物的多样性合成,一直以来都是有机化学家研究的热点。值得注意的是,在含氮杂环化合物中,氮杂环丙烷作为最小且具有高度环张力的三元氮杂环化合物,是一类构建多种复杂氮杂环化合物非常重要的合成砌块和中间体,被广泛应用于许多天然产物和药物分子合成中[2-4]。由于其结构的特殊性使其不仅可以与含碳、氮、氧、硫、卤素等亲核试剂发生开环反应生成开环产物[5-10],而且还可以与含烯基、炔基、羰基、氰基等多种底物发生[2+2]、[3+1]、[3+2]、[3+3]、[4+3]以及[5+2]等环加成反应,生成相应的多元氮杂环化合物[11-15]。本文将重点对氮杂环丙烷与多种不饱和键化合物的[3+3]反应进行系统地归纳与总结,以期为氮杂环丙烷在环加成反应中的应用提供理论参考,同时为促进创新药物的研发与其新型合成技术的发展增添新的内容。
环加成技术的快速发展促使三亚甲基甲烷(TMM)金属络合物以及过渡金属介导的TMM对不饱和键环加成反应引起了各研究学者的广泛关注[16-18]。鉴于催化物种Pd-TMM的亲核特性,Bambal和Kemmitt等[19]于1989年首次报道了2-[(三甲基硅基)甲基]-2-丙烯-1-乙酸酯1在Pd(PPh3)4作用下原位生成的三亚甲基甲烷钯络合物(Pd-TMM)与氮杂环丙烷2的[3+3]环加成反应(Scheme 1),以中等产率获得了哌啶类化合物3。这一开创性的工作为后续Pd-TMM参与其它类型的环加成反应的发展奠定了基础。

Scheme 1
基于Trost等[16,20,21]发现非碱性亚磷酸配体的加入可提高Pd-TMM配合物反应活性的认识,Harrity等[22]于2001年报道了在钯催化下以P(OPr-i)3作配体,n-BuLi作还原剂,在温和的条件下实现了原位生成的三亚甲基甲烷钯络合物(Pd-TMM)与手性氮杂环丙烷4的[3+3]环加成反应(Scheme 2)。在此工作基础上,2003年该课题组[23]进一步探索了不同取代基的氮杂环丙烷6与Pd-TMM的[3+3]反应(Scheme 3)。发现氮杂环丙烷上的N-取代基R是该反应成功的关键,只有取代基R为4-甲苯磺酰基(Ts)和4-甲氧基苯磺酰基(PMBS)活化的氮杂环丙烷才能顺利进行反应,而无芳基磺酰基活化的氮杂环丙烷不能参与此反应。同时,利用该方法学可将所得产物用于天然生物碱(-)-Pseudoconhydrine[22-23]和Indolizidine[24]的合成(Chart 1)。

Scheme 2

Scheme 3
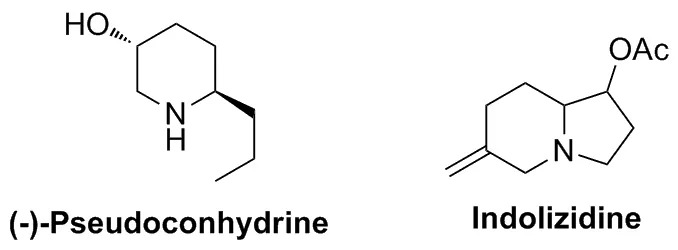
Chart 1
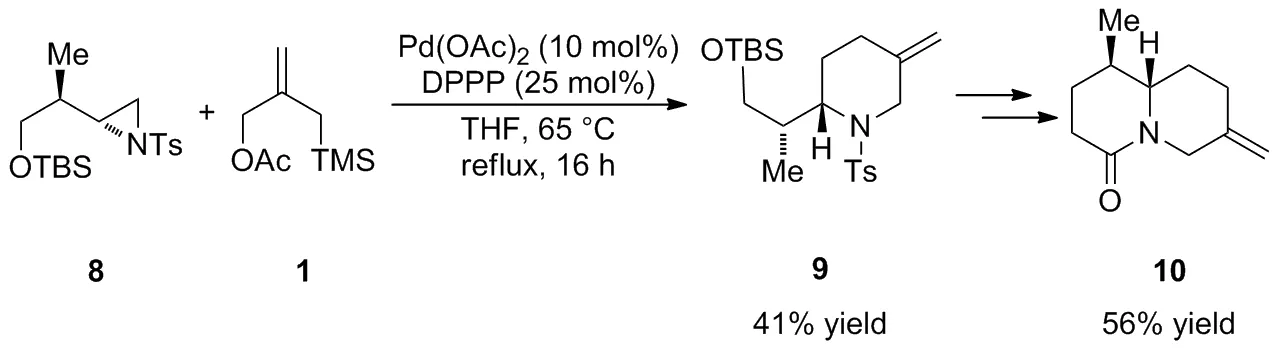
2003年,Harrity等[25]基于对Pd-TMM络合物的反应特点的认识进一步采用钯催化的[3+3]反应立体选择性实现了哌啶衍生物9的合成(Scheme 4)。研究发现,单膦配体P(OPr-i)3会抑制Pd-TMM络合物与N-对甲苯磺酰基氮杂环丙烷8的[3+3]环加成反应,而使用富电子的双膦配体DPPP可以加速反应的进行,尽管以较低的产率(41%)获得了环加成产物9,但经过后续的脱保护,Swern氧化和Wittig反应得到重要中间体10,可以进一步实现生物碱(-)-Deoxynupharidine1的合成(Chart 2)。
Scheme 4

Scheme 5
Scheme 6

Chart 2
鉴于上述Pd-TMM络合物参与[3+3]环加成反应在哌啶类化合物合成中存在产率低的不足,寻求其他类型TMM等价物实现哌啶类化合物的高效合成是亟待解决的科学问题。2005年,该课题组[26]改进了哌啶类化合物的合成方法,通过2-甲基丙烯醇11在MgBr2作用下形成格式试剂与氮杂环丙烷8发生开环反应,随后经分子内Mitsunobu反应,以87%的产率获得了哌啶化合物9(Scheme 5)。同时高效地实现了中间体10的合成,进而实现生物碱(-)-Deoxynupharidine1,(-)-Castoramine2和(-)-Nupharolutine3的合成(Chart 2)。
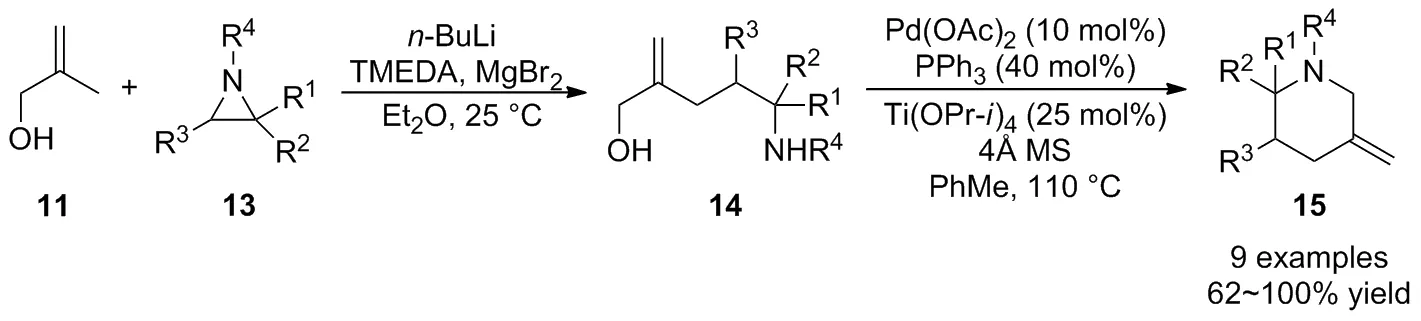
同年,该课题组[27]进一步通过2-甲基丙烯醇11在MgBr2作用下形成格式试剂与氮杂环丙烷13的开环反应,接着采用钯催化的偶联反应实现了哌啶类化合物15的高效构建(Scheme 6)。与先前开发的Pd-TMM介导的环加成反应相比,此法可用于反应活性较低的氮杂环丙烷,这极大地扩大了氮杂环丙烷参与[3+3]反应的底物范围。
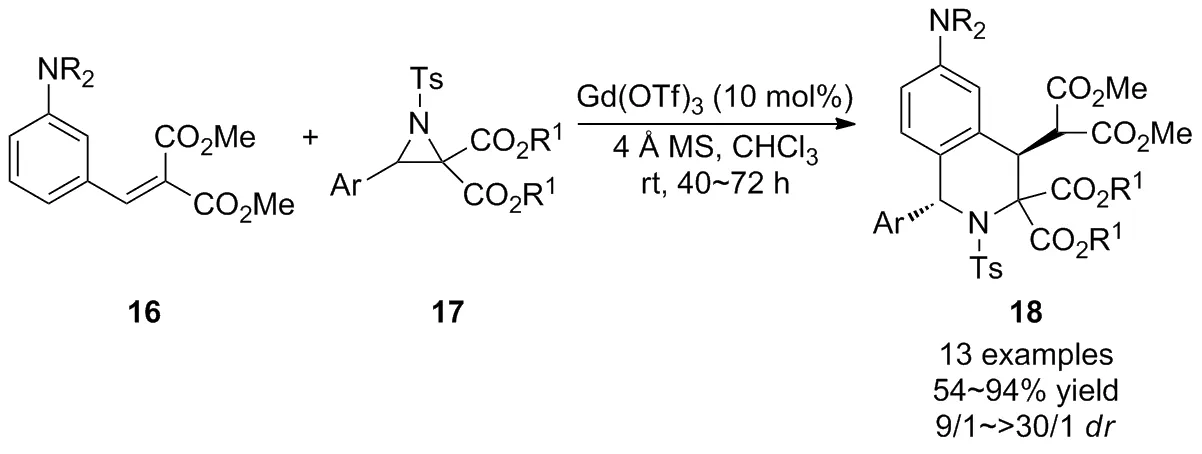
由于氮杂环丙烷具有较高的能量势垒,关于其选择性C—C键裂解生成偶氮甲亚胺叶立德进一步与亲偶极分子发生[3+3]环加成反应的研究较少。2018年,Kim等[28]报道了Gd(OTf)3催化的N,N-二烷基-3-乙烯基苯胺16与D-A氮杂环丙烷17立体选择性Friedel-Crafts/Michael串联反应,通过D-A氮杂环丙烷选择性C—C键裂解制备了高度官能化的四氢异喹啉衍生物18(Scheme 7)。基于上述研究成果,该课题组[29-30]利用相同的策略在温和的条件下立体选择性地获得了具有1,4-碳立体中心的高官能化1,3,4-三取代的四氢异喹啉衍生物。
Scheme 7
Scheme 8
Scheme 9

Scheme 10
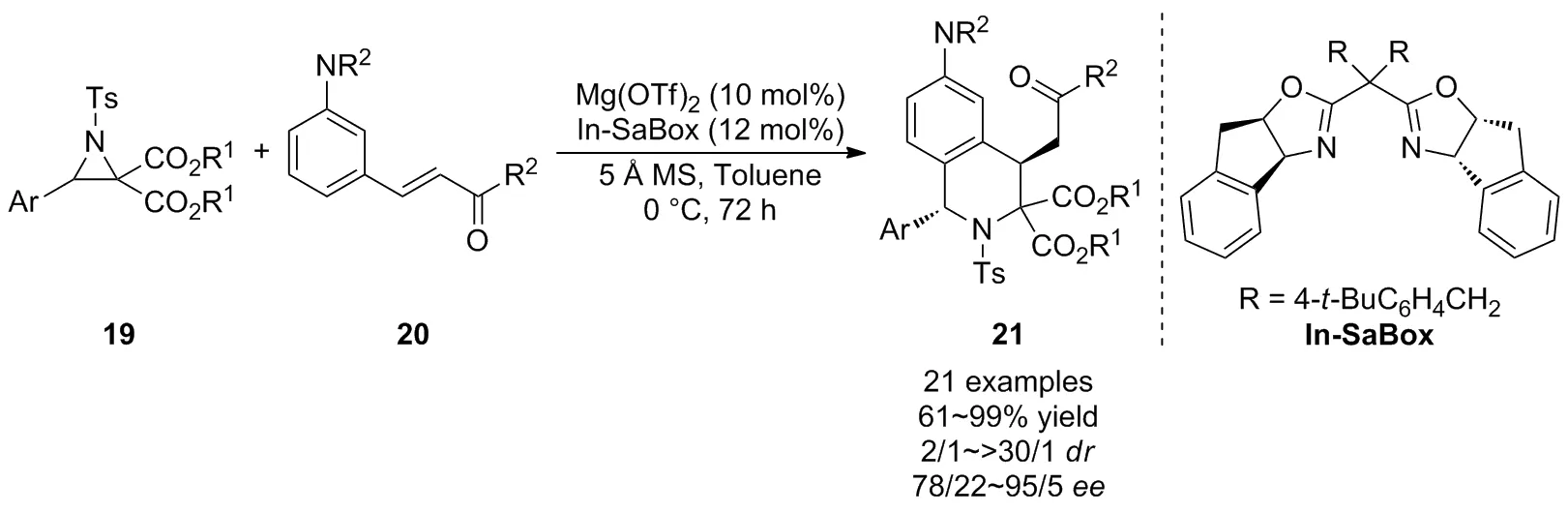
近年来,开发不对称催化合成手性1,4-二取代四氢异喹啉衍生物的方法仍然具有挑战性,2019年,Kim等[31]在前期工作的基础上进一步报道了D-A氮杂环丙烷19与N,N-二烷基-3-乙烯基苯胺20的不对称[3+3]环加成反应(Scheme 8)。以手性噁唑啉In-SaBox为配体,Mg(OTf)2为Lewis酸,在温和条件下实现了产物的立体选择性合成,以高达99%的产率,>30/1的非对映选择性和95/5的对映选择性获得了一系列四氢异喹啉衍生物21。
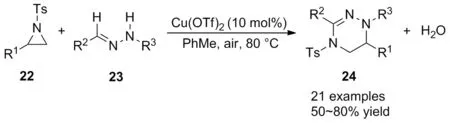
2009年,王彦广和林旭峰[32]报道了在Cu(OTf)2催化下实现了氮杂环丙烷22与腙23的亲核开环/分子间串联氧化胺化反应(Scheme 9),以高达80%的产率合成了四氢三嗪类化合物24。该反应使用廉价的Cu(OTf)2为催化剂,空气为氧化剂,温和条件下实现[3+3]反应,水为唯一副产物。相比于Tsuge等[33]报道的氮杂环丙烷与腈亚胺合成四氢三嗪类化合物的策略,该方法更高效、绿色。
Scheme 11

Scheme 12

Scheme 13
1,2,4-噁二嗪烷是一类尚未开发的重要氮氧杂环化合物,其合成方法步骤繁琐,且多用于产物的构象研究和药物活性评价[34]。因此,Selander等[35]于2015年开发了一种InCl3催化氮杂环丙烷25与硝酮26的[3+3]环化反应(Scheme 10),以较高的产率和优良的选择性合成了六元1,2,4-噁二嗪烷衍生物27。
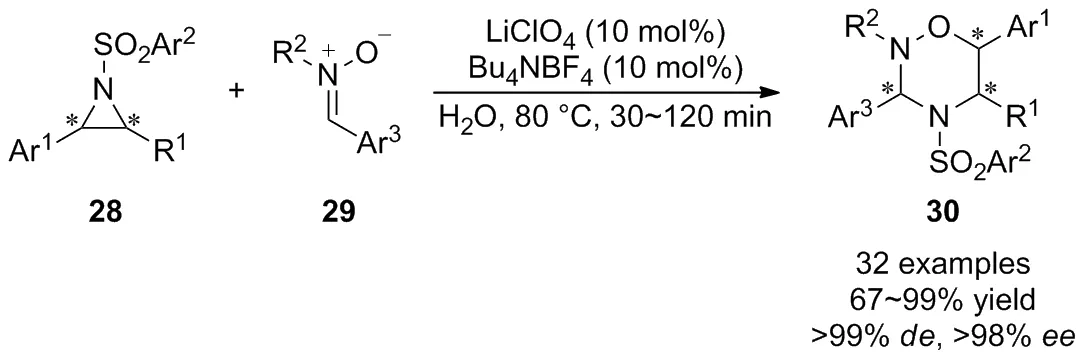
由于上述研究在反应步骤、底物范围、立体选择性控制等方面仍然存在着一定的局限性,开发一种新的合成策略实现手性1,2,4-噁二嗪烷衍生物的高效合成显得非常必要。2017年,Ghorai等[36]首次在LiClO4/Bu4NBF4催化体系下通过活化的氮杂环丙烷28与硝酮29的[3+3]环化反应,实现了1,2,4-噁二嗪烷衍生物30的化学选择性和立体选择性合成(Scheme 11)。该反应成功地克服了氮杂环丙烷的竞争性氧化开环问题,反应条件温和,底物范围广。
目前,关于氮杂环丙烷与杂原子的开环反应已经得到了广泛报道,而与含碳亲核试剂的开环反应仍然研究较少。2011年,Ghorai等[37]报道了t-BuOK介导活化氮杂环丙烷31与芳基乙腈32的SN2型开环,随后在钯催化下实现分子内C—N键偶联反应,高效合成了多取代四氢喹啉衍生物33(Scheme 12)。底物普适性研究表明,不管是芳基取代的氮杂环丙烷还是烷基取代的氮杂环丙烷,均以优异的产率及立体选择性获得相应的四氢喹啉衍生物。作者还将该方法应用于多种外消旋和非外消旋的四氢喹啉衍生物的合成,产率高达99%,对映选择性及非对映选择性均可高达99%。
2018年,该课题组[38]进一步报道了路易斯酸BF3·OEt2介导的活化氮杂环丙烷34与α-异氰化物35的[3+3]环加成反应,经历α-碳负离子的SN2型开环反应和分子内6-endo-dig环化反应,以优良的产率以及优异的立体选择性获得1,4,5,6-四氢嘧啶类化合物36(Scheme 13)。
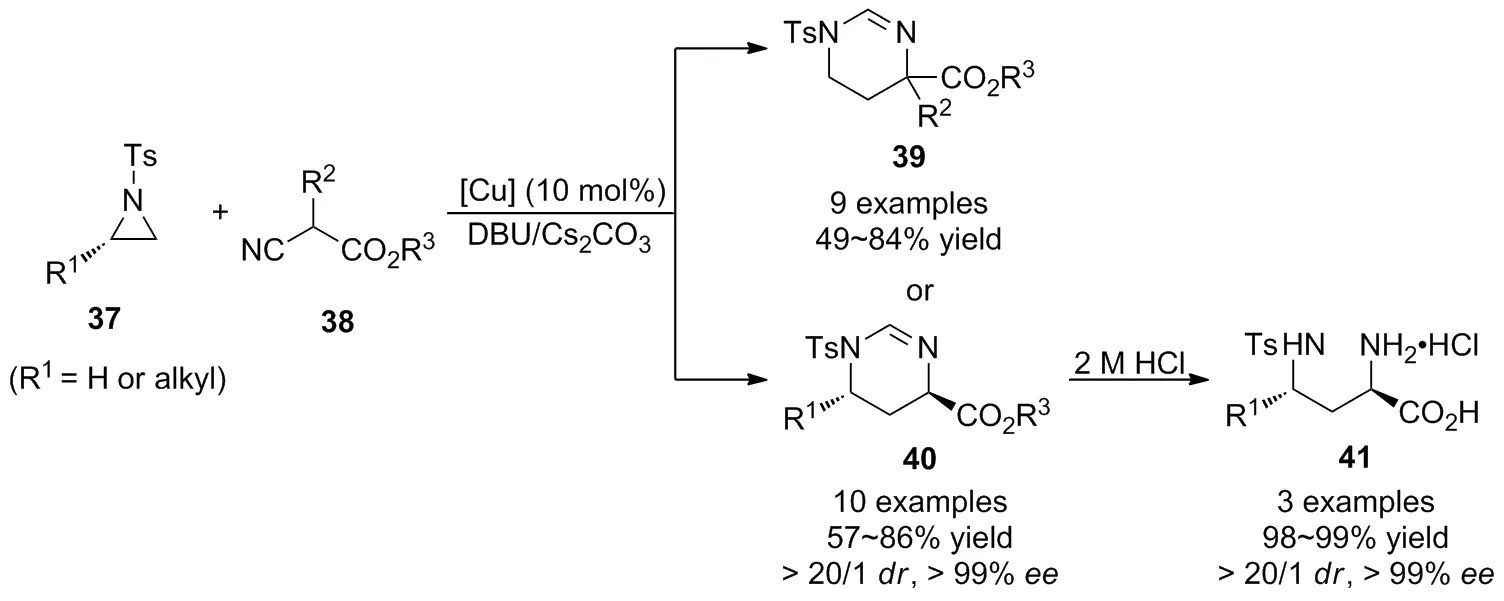
同年,赵宇等[39]又进一步报道了铜催化氮杂环丙烷37与异氰基乙酸酯38的[3+3]环加成反应(Scheme 14),以优异的立体选择性获得了1,4,5,6-四氢嘧啶衍生物39。经底物普适性考察发现,烷基取代以及芳基取代的异氰基乙酸酯具有良好的官能团耐受性,但其产率随着异氰基乙酸酯中酯基位阻的增大而降低。为实现产物的对映选择性控制,作者还筛选了大量的手性膦配体,氮配体以及二胺类配体,但仍未获得预期的结果。为解决该科学问题,作者以对映体纯的单取代氮杂环丙烷为底物,通过手性诱导策略,基于发展的铜催化[3+3]环加成反应实现了二取代四氢嘧啶单一立体异构体40的合成,经过简单的水解过程即可获得重要中间体手性α,γ-二氨基酸41的合成。
Scheme 14
Scheme 15

Scheme 16
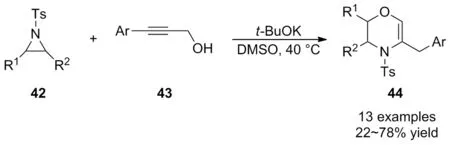
鉴于串联反应在实现“一锅煮”的多步反应中具有优越性,周永贵等[40]于2009年首次报道了温和条件下t-BuOK介导氮杂环丙烷42与芳基炔丙醇43的开环/关环串联反应(Scheme 15)。该反应意外的合成了羟嗪类化合物44,这一发现为六元羟嗪衍生物的合成提供了一种新方法。底物广谱性表明,苄基取代的氮杂环丙烷参与反应所得产率偏低,原因可能是空间位阻造成的,而其它取代基的氮杂环丙烷和炔丙醇底物均具有良好的耐受性,可以中等至良好的产率获得相应的目标产物。
同年,Sujit等[41]报道了[Ag(COD)2]PF6催化氮杂环丙烷45与炔丙基醇46的开环/环化串联反应(Scheme 16),构建了多种六元或八元N,O-杂环化合物。对照实验发现,Cs2CO3对环化反应具有促进作用。值得注意的是,使用非末端炔丙基醇或空间位阻较大的氮杂环丙烷反应时可以良好的产率获得1,4-恶嗪衍生物47。
2009年,Kwon等[42]首次报道了膦作亲核试剂介导氮杂环丙烷48与联烯酸酯49的[3+3]环化反应(Scheme 17),进一步扩大了亲核膦催化反应的范围。该反应在温和条件下进行,以良好至优异的产率及非对映选择性获得了多官能团化的四氢吡啶类化合物50。机理研究表明,反应经历了两步:分子内芳香亲核取代反应以及SO2释放的过程。

Scheme 17
Scheme 18
Scheme 19
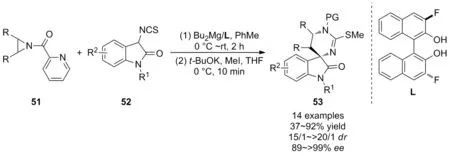
2015年,王锐等[43]首次报道了(R)-3,3′-F-BINOL/Mg络合物催化的N-(2-吡啶基)氮杂环丙烷51与3-NCS氧化吲哚52的不对称[3+3]反应(Scheme 18)。底物51和52在手性(R)-3,3′-F-BINOL/Mg催化剂作用下进行对映选择性开环,进而在碱的作用下顺利实现关环,以高达92%的产率,>20/1的dr值和>99%的ee值获得了六元杂环化合物53。除此之外,开环的中间产物还可以进一步转化为手性氨基酸、多肽和双功能催化剂。
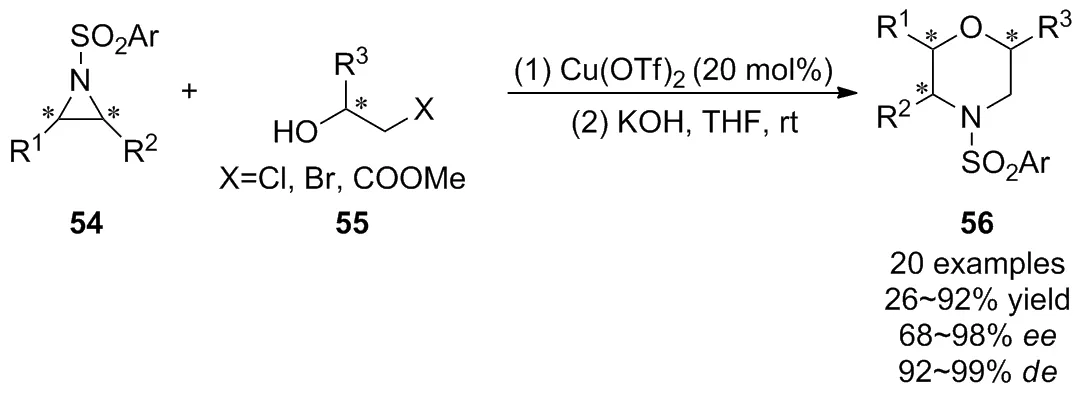
2009年,Ghorai等[44]报道了Lewis酸Cu(OTf)2催化氮杂环丙烷54与β-卤代醇55进行SN2开环,接着通过“一锅法”在室温下进行分子内关环的高区域选择性和立体选择性的[3+3]反应,以优异的产率和对映选择性构建了六元N,O-杂环化合物56(Scheme 19)。
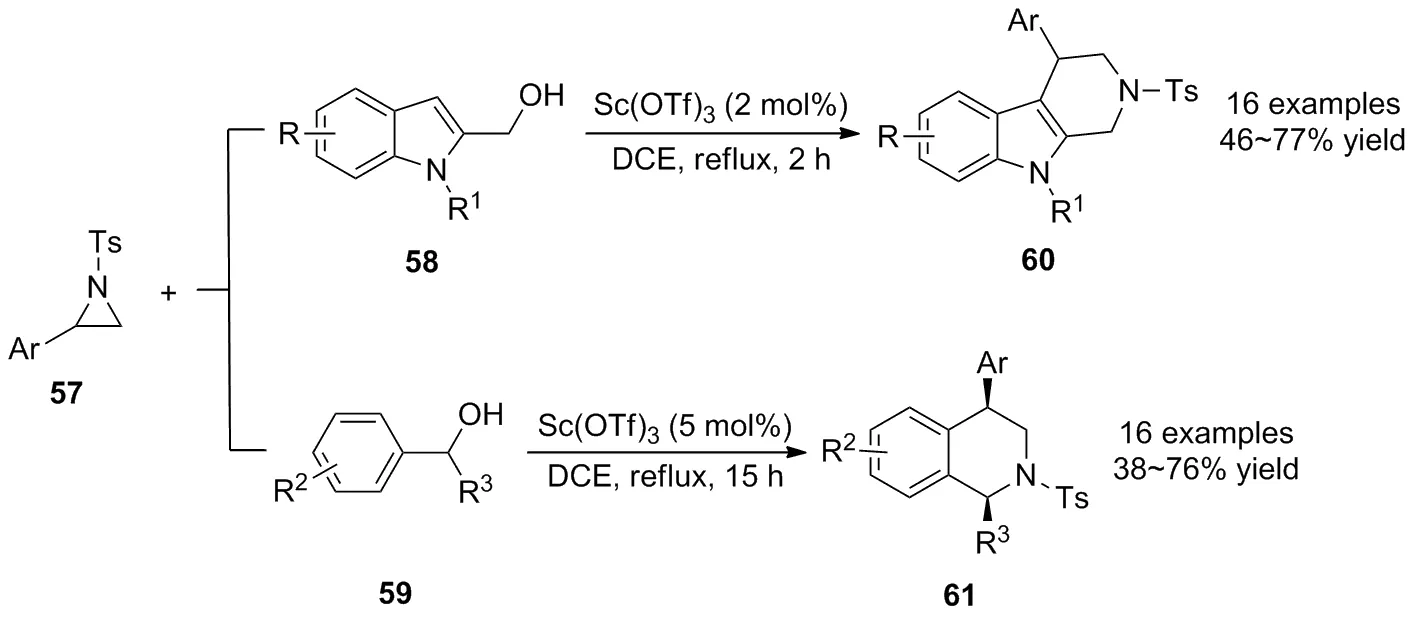
2013年,王绍武等[45]报道了Lewis酸Sc(OTf)3催化氮杂环丙烷57与N-烷基-2-吲哚甲醇类58和苄醇类59化合物的[3+3]环化反应(Scheme 20)。在温和的条件下以简单的原料获得了四氢-β-咔啉衍生物60和四氢异喹啉衍生物61。底物广谱性表明,对于不同取代基的氮杂环丙烷,均可获得良好的收率。值得注意的是,芳基的存在有助于氮杂环丙烷的开环,而脂肪族的氮杂环丙烷则不发生反应;对于不同取代基的苄基醇,富电子的苄基醇与N-烷基-2-吲哚甲醇相比,其反应活性较低。最后,作者提出了该反应可能的机理,涉及到苄基醇与氮杂环丙烷的亲核开环,中间体分子内胺化及Friedel-Crafts烷基化反应过程,是对Pictet-Spengler反应的进一步补充。
Scheme 20

Scheme 21
Scheme 22
Scheme 23
2017年,Banerjee等[46]通过Lewis酸MgI2催化D-A氮杂环丙烷62与1,4-二硫-2,5-二醇63的[3+3]反应,在室温下实现了功能化噻嗪衍生物64的合成(Scheme 21)。底物普适性研究表明,含有吸电子取代基的氮杂环丙烷可快速转化为目标产物,且对溴苯基取代的D-A氮杂环丙烷的反应活性高于邻溴苯基取代的D-A氮杂环丙烷。重要的是,活性较低的苯基和萘基取代氮杂环丙烷也可以较好的产率获得噻嗪类化合物;然而,含强给电子基取代的氮杂环丙烷稳定差,不能使环加成反应顺利进行。有趣的是,作者在用含不同酯基的氮杂环丙烷考察酯基基团大小对反应转化的影响发现,酯基的立体位阻对该反应的影响不大,均能以优异的产率获得相应的环化产物。
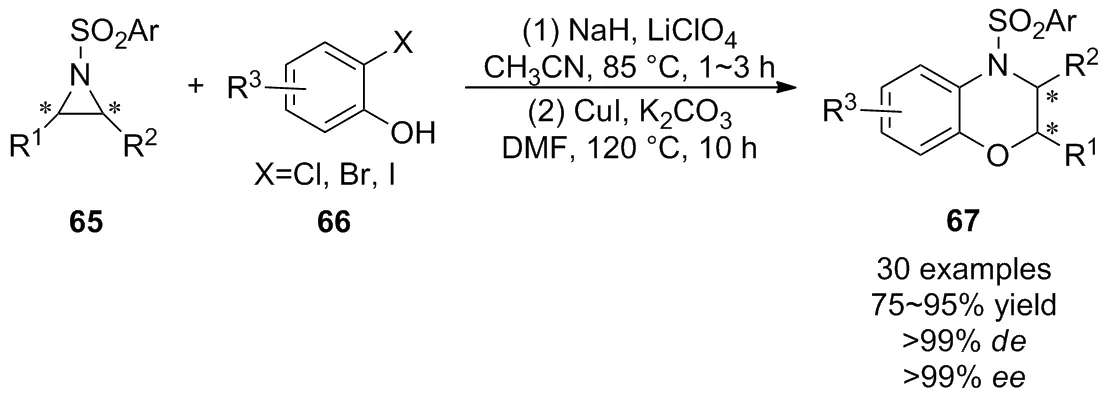
2018年,Ghorai等[47]开发了一种Lewis酸催化活化氮杂环丙烷65与2-卤代酚66的SN2型开环反应,接着通过“一锅法”实现了铜(I)催化分子内C—N键偶联的[3+3]环化反应(Scheme 22),以良好至优秀的产率及优异的立体选择性获得了多种外消旋和非外消旋的二氢-1,4-苯并恶嗪衍生物67。
Scheme 24
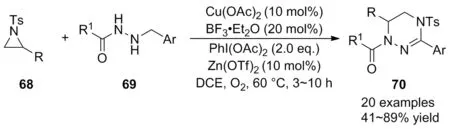
2019年,霍聪德等[48]在温和的反应条件下首次实现了Cu(OAc)2催化氮杂环丙烷68与苄基肼类化合物69的氧化脱氢[3+3]环化反应,高效构建了功能化四氢-1,2,4-三嗪类化合物70(Scheme 23)。经底物普适性考察发现,苄基肼芳环上无论是给电子基团还是吸电子基团,都能以良好的产率得到相应的产物;多种N-Ts氮杂环丙烷苯环上的官能团也具有良好的耐受性。为说明该方法的实用性,产物还可通过脱保护和氧化脱氢过程转化为更稳定的芳构化产物。
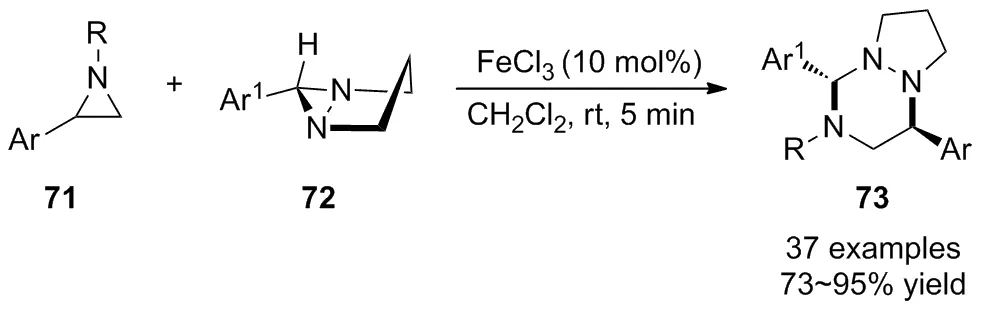
2020年,Sarkar等[49]报道了廉价FeCl3催化氮杂环丙烷71与二氮杂双环[3.1.0]己烷72的立体选择性[3+3]环化反应(Scheme 24),在室温下高效合成了1,2,4-三嗪类化合物73。经研究发现,底物扩展到多种含吸电子基团或给电子基团取代的二氮杂双环[3.1.0]己烷均表现出良好的官能团耐受性,含不同取代基的氮杂环丙烷均能参与此反应,以良好至优秀的产率得到相应的1,2,4-三嗪类化合物。作者还将该方法进一步应用到二氮杂双环[3.1.0]己烷的环二聚体与N-烷基氮杂环丙烷底物的偶联反应中,高产率地获得了单一的非对映异构体。为了揭示其立体选择性,用具有光学活性的氮杂环丙烷进行偶联反应,结果表明该方法具有立体专一性,可获得高光学纯度的1,2,4-三嗪化合物。该报道为两种不同三元环的环化反应提供了一种具有潜在应用价值的方法,进而为新型杂环化合物的高效合成提供了物质基础。
综上所述,经过化学研究工作者的不懈努力,实现了氮杂环丙烷与含C=C、C=N、C≡N、C≡C和C═·═C等基团化合物的[3+3]环加成反应,底物多样性得到了进一步拓展,功能化多元氮杂环化合物的合成方法也得到了极大的改进与创新。但是目前仍然存在着底物范围受限,反应活性较低及立体选择性不理想等问题。随着对含氮杂环化合物的不断研究及其参与反应机理的探索,氮杂环丙烷与氧杂吖丙啶,环丙烷,亚硝基芳烃,N-亚磺酰基苯胺,环丙烯酮以及苯基烯酮等多种不同类型底物的[3+3]反应还有待进一步拓展,且构建高效的催化体系以实现氮杂环化合物的立体选择性合成为药物化学领域增添创新性成果显得尤为重要。
