基于网络药理学探究“黄芪-当归”治疗慢性再生障碍性贫血的作用机制*
2021-03-31杨志文刘增慧麦喆钘
杨志文,何 靖,刘增慧,麦喆钘
(1. 广州中医药大学第一附属医院血液科,广州 510405; 2. 广州中医药大学第二临床医学院,广州 510405)
再生障碍性贫血(AA)是一种由多病因引起的造血衰竭综合征,主要以贫血、感染和出血为临床表现,其发病率在我国为0.74/10万[1]。AA主要分为重型再生障碍性贫血(SAA)和慢性再生障碍性贫血(CAA)[1],其中SAA病情危重,若无及时积极的治疗,多导致患者死亡[2],而CAA治疗疗程长,给患者及社会带来沉重的经济负担[3]。目前针对AA的治疗手段主要有造血干细胞移植(HSCT)和免疫抑制治疗(IST),但是HSCT受到多条件限制,并非所有患者均适用[1],而IST虽适用于大部分患者,但是长期接受IST会增加严重感染的风险[2]。而在近年的研究中发现,中医药在治疗CAA上具有独到之处,可增强治疗效果,改善患者生存质量[4-5]。
CAA在中医古籍中并无此病名,但根据其临床表现,属于中医学“虚劳”范畴,病机主要是气阴亏虚,治疗原则为健脾益气、滋阴养血[6]。根据本研究团队对于临床的观察并结合中医大家的经验,发现黄芪-当归药对在治疗CAA中运用最多[7]。然而,现在仍缺少对于黄芪-当归药对治疗CAA的机制研究,同时由于中药成分复杂,在体内作用靶点众多,作用机制十分复杂,单凭动物或细胞实验进行机制研究是较难实现的。因此,本研究团队基于网络药理学原理,对黄芪-当归的有效成分、作用靶标及相关信号通路进行分析,通过网络分析的方法揭示其治疗CAA的作用机制。
1 资料与方法
1.1 获取黄芪-当归的活性成分
分别以“黄芪”和“当归”为关键词,在中药系统药理学分析平台(http://lsp.nwu.edu.cn/,TCMSP)检索黄芪和当归的所有化学成分。根据毒药物动力学原理指导,设定“OB(口服度)≥30%”和“DL(类药性)≥0.18”为筛选条件[8],筛选出可作为药物被人体吸收的化学成分,作为黄芪-当归的活性成分。
1.2 获取成分-疾病靶标
1.2.1 获取活性成分靶标 从TCMSP数据库获取活性成分(1.1项)Pubchem CID录入Pubchem数据库,获取该活性成分的化学结构式和平面结构图。将各化学结构式输入SwissTargetPrediction服务器,基于反向分子对接法,获得各成分的可作用靶标,并根据probability(结合概率)值由大到小排名,选取前15位的可作用靶标作为活性成分靶标[9],并获取活性成分靶标对应的Uniprot ID。
1.2.2 获取疾病靶标 以“chronic aplastic anemia”或“CAA”为关键词在Genecards数据库上检索CAA的相关靶标,取2次检索结果的合集结果作为疾病靶标。
1.2.3 获取成分-疾病靶标 筛选出活性成分靶标与疾病靶标的交集部分,作为黄芪-当归治疗CAA中可发挥作用的靶标,即成分-疾病靶标。
1.3 获取有效成分-成分-疾病靶标网络
筛选出活性成分(1.1项)中可作用于成分-疾病靶标的成分(1.2.3项),作为有效成分。将有效成分和成分-疾病靶标及两者间的对应关系(1.2.1项)导入Cytoscape 3.6.0软件,构建有效成分-成分-疾病靶标网络,通过读图进行分析与研究。
1.4 获取核心靶标
1.4.1 获取潜在核心靶标 将成分-疾病靶标(1.2.3项)的Uniprot ID(1.2.1项)导入String数据库,限定物种条件为“Homo sapiens”,并将结果导入Cytoscape 3.6.0软件绘制成分-疾病靶标的相互作用网络(Protein-protein interactions,PPI),利用该软件的网络分析工具通过Degree值算法,筛选出黄芪-当归治疗CAA时发挥作用最大的5个潜在核心靶标。根据Degree值大小调整节点的面积,绘制PPI网络图,其中Degree值越大则节点面积越大,并通过读图进行分析与研究。
1.4.2 分子对接验证潜在核心靶标与有效成分的结合力 通过System Dock Web Site 服务器(http://systemsdock.unit.oist.jp/iddp/home/index),对潜在核心靶标的真实性进行验证。从Uniprot数据库(https://www.uniprot.org/)获取成分-疾病靶标的PDB ID,再将成分-疾病靶标的PDB ID与有效成分的平面结构式(1.2.1项)输入到System Dock Web Site服务器进行分子对接,得到对接评分。根据对接评分大小评价两者之间的结合潜力,分析核心靶标的真实性。当对接评分>7.0时,表示其结合能力很高;当对接评分>5.0时,表示其结合能力较高;当对接评分>4.25时,表示分子和靶标具有一定的结合能力[10]。
1.5 GO分析和KEGG分析
将成分-疾病靶标(1.2.3项)导入DAVID数据库(https://david.ncifcrf.gov/),限定标识符为“UNIPROT ACCESSION”,列表类型条件为“Gene List”,得出KEGG通路富集分析和GO分类富集分析的结果。GO分类富集分析包括生物过程、细胞组分和分子功能三部分。选取满足KDR值少于0.05的信号通路,作为黄芪-当归治疗CAA的相关通路,结合相关文献进行分析。
1.6 绘制有效成分-成分-疾病靶标-重要通路网络图
通过阅读文献,筛选出目前研究认为与CAA发病及治疗相关的通路,作为重要通路。取富集于重要信号通路上的靶标与成分-疾病靶标(1.2.3项)的交集部分;将交集靶标与有效成分(1.3项)相配对,将三者的配对关系导入Cytoscape 3.6.0软件,构建有效成分-成分-疾病靶标-重要通路的网络,通过读图进行分析与研究黄芪-当归治疗CAA的特点。
2 结果
2.1 黄芪-当归活性成分的筛选
表1示,检索到黄芪-当归的化学成分有212个,符合纳入条件的活性成分共20个,包括豆甾醇、谷固醇、槲皮黄酮、叶酸等。

表1 黄芪-当归活性成分比较
2.2 成分-疾病靶标的筛选
表2示,黄芪-当归的20个活性成分在SwissTargetPrediction服务器中共获得靶标300个;在Genecards数据库中获取CAA相关靶标5557个,与300个成分靶标取交集后获得成分-疾病靶标144个。

表2 成分-疾病靶标
2.3 有效成分-成分-疾病靶标网络
表1示,筛选出有效成分共20个,即活性成分均为有效成分。图1示,有效成分-成分-疾病靶标网络图,其中有164个节点,包括20个有效成分(矩形节点)和144个成分-疾病靶标(圆形节点);有边线266条,代表20个有效成分与144个靶标之间具有266种作用关系,表示同一靶标可对应不同的有效成分,不同的有效成分也可作用于不同的靶标,由此看出,黄芪-当归治疗CAA具有多成分、多靶标的特点。
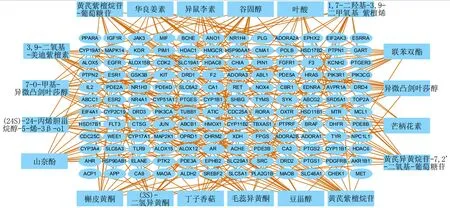
图1 有效成分-成分-疾病网络
2.4 核心靶标
图2示,PPI网络图包括节点141个,边线1023条。图中圆形节点表示作用靶标,边表示靶标之间的相互作用关系。由于CA1、PDE8B、RORA 3个靶标与其他靶标之间未有相互作用关系,所以未在图中表示。表3示,其中连接度最高的5个分别是VEGF、EGFR、IFN、TNF、AR。分子对接验证结果为18种对接关系的对接评分>7.0,占比18%;有42种对接关系的对接评分在 7.0~5.0之间,占比42%;有33种对接关系的对接评分在5.0~4.25之间,占比33%;有7种对接关系的对接评分<4.25,占比7%。因此,上述5个靶标确为核心靶标。PPI网络图也证明,黄芪-当归治疗CAA不仅是通过广泛作用多个靶标而发挥疗效,还可通过靶标之间的相互影响产生复杂的网络调节效果。
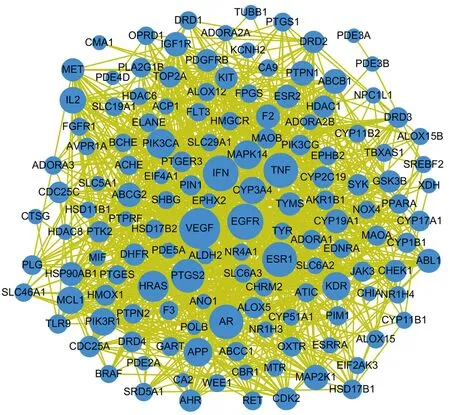
图2 PPI网络图

表3 核心靶标信息比较
2.5 GO分析结果
表4示,GO分类富集分析结果中符合筛选条件的生物过程有20个;表5示,细胞组分有10个;表6示,分子功能有15个。
表4 生物过程分析结果比较

表5 细胞组分分析结果比较

表6 分子功能分析结果比较
2.6 KEGG结果与分析
表7示,KEGG通路富集分析结果中符合筛选条件的信号通路有20条。阅读相关文献后,本团队认为黄芪-当归治疗冠心病主要通过调控PI3K-Akt信号通路和VEGF信号通路发挥疗效。
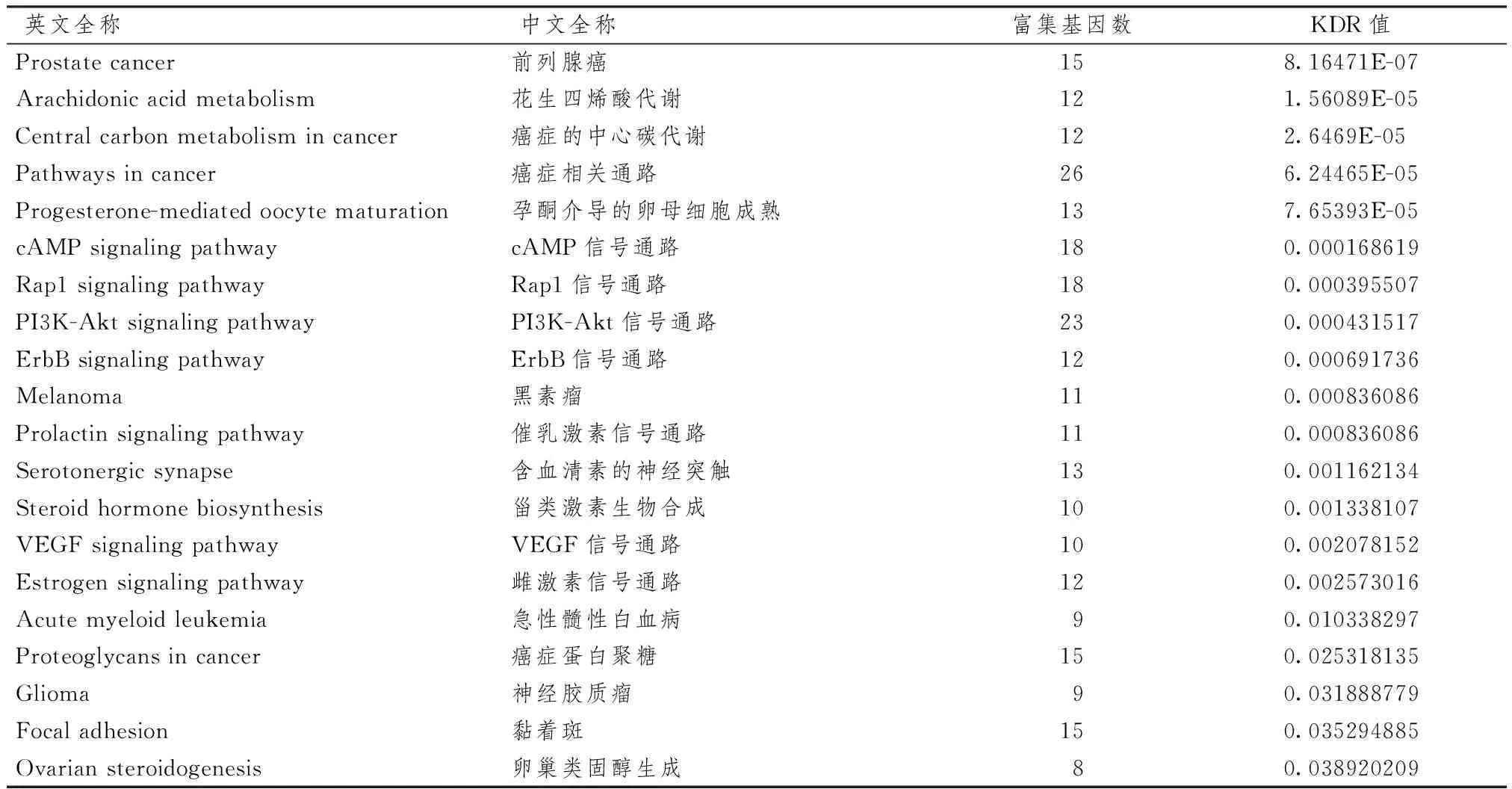
表7 KEGG通路富集分析结果
2.7 有效成分-成分-疾病-重要通路网络构建
图3示,图中有节点41个,代表2个药物(三角形),12个有效成分(六边形),25个成分-疾病靶标(圆形),2条重要通路(矩形)。黄芪-当归治疗CAA的作用机制主要是由12个有效成分作用于25个成分-疾病靶标,进而调控PI3K-Akt通路和VEGF通路。
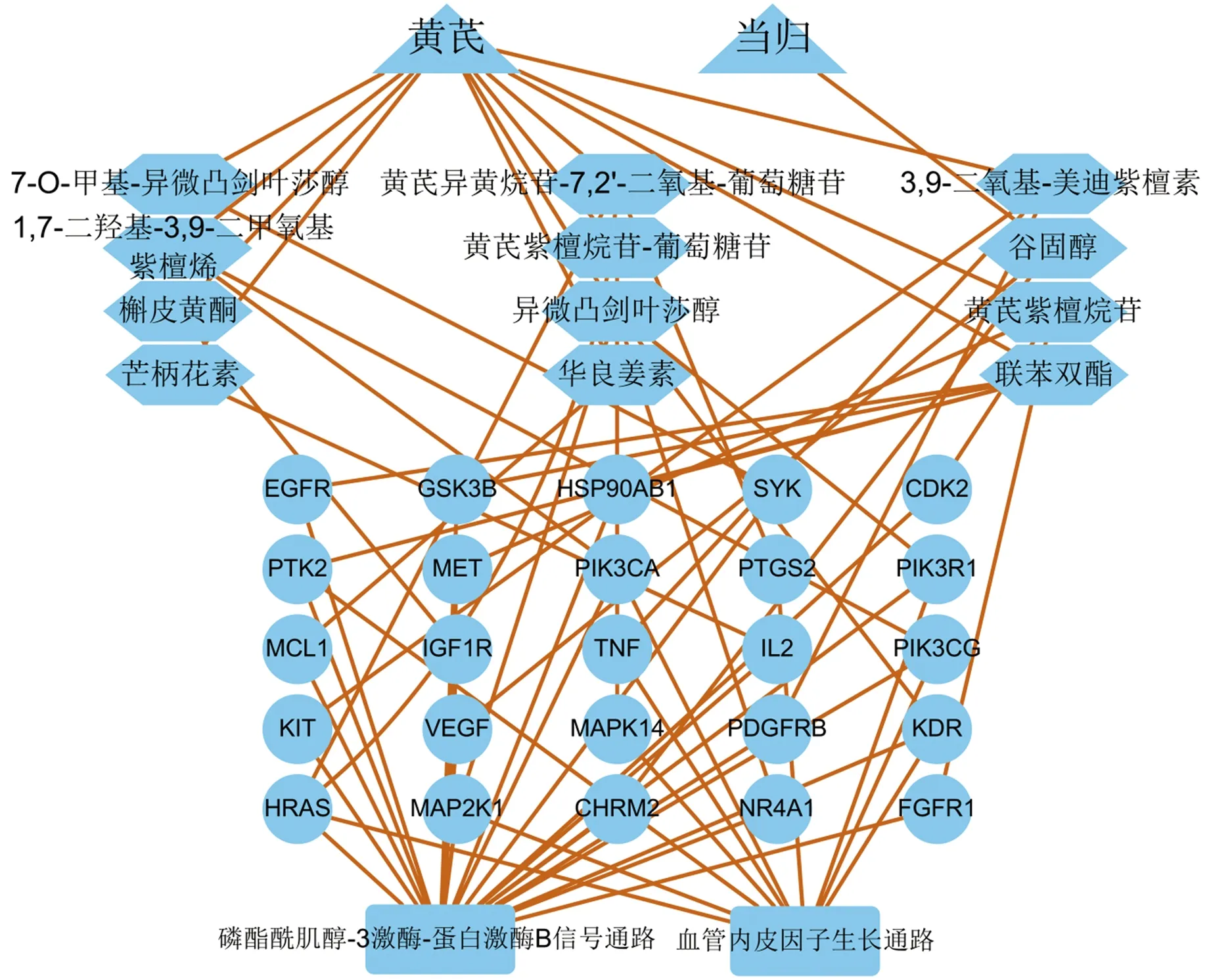
图3 有效成分-成分-疾病-重要通路网络
3 讨论
再生障碍性贫血属于中医学“虚劳”范畴。本团队发现,临床上多用黄芪-当归药对治疗。据报道,黄芪具有调节机体免疫、增加骨髓造血的作用;当归可以减少细胞凋亡,改善造血微环境,从而发挥促进造血的作用[11]。
图1示,黄芪-当归治疗CAA的有效成分为括叶酸、槲皮黄酮、谷固醇、豆甾醇等。研究发现,AA患儿体内的叶酸水平较正常儿童低,对AA患儿常规治疗后,叶酸水平有所升高,但仍低于正常水平[12]。因此本团队考虑,黄芪-当归可通过直接补充叶酸来治疗CAA。本团队发现,对于大部分的有效成分,国内外尚缺少治疗CAA的药理学研究,这提示研究者可从中药单体切入进行更进一步的研究。除此以外,从图1中还可以直观的发现,黄芪-当归治疗CAA具有多成分、多靶标的特点。
从PPI网络图可得,各成分-疾病靶标之间存在复杂的相互作用关系,表明黄芪-当归的治疗机制复杂多样,不仅是有效成分作用于某一靶标发挥作用,同时成分-疾病靶标之间的相互作用也可有影响。研究得出VEGF、IFN、TNF、AR、EGFR为核心靶标,分子对接结果也验证了核心靶标的真实性。本团队认为,核心靶标在治疗过程中可发挥较为重要的作用,该推论也与既往研究相符。研究发现,VEGF是体外诱导骨髓间充质干细胞向内皮细胞分化的重要因子之一。VEGF的高表达可促进骨髓微血管的形成,为造血细胞的成熟与分化提供有利环境,促进AA患者造血功能的恢复[13-14]。因此本团队推测,黄芪-当归可能是通过促进VEGF的高表达来发挥疗效。IFN是一种负性造血调控因子,在AA患者中表达异常,导致机体体液免疫出现异常,抑制机体造血干/祖细胞增殖,从而导致AA的发生[15]。研究发现,中药复方联合常规用药治疗AA患者后,可明显减低IFN的表达,抑制T细胞向Th1细胞分化,逆转AA中的Th1优势,进而改善免疫功能和造血微环境[16-17]。同时TNF也是一种负性造血调控因子,在AA的发病机制中具有与IFN类似的作用,可加快造血干/祖细胞凋亡[18-19]。其相关研究也证明,药物治疗后AA患者体内的IFN和TNF水平均会下降[20-21],所以本团队认为黄芪-当归可通过降低IFN和TNF的表达活性来治疗CAA。对于造血系统,AR主要分布在骨髓基质细胞、血小板和红系祖细胞[22],与雄激素结合后可刺激促红细胞生成素的分泌,从而改善造血功能[23]。对此,本团队推测黄芪-当归可通过增加AR的表达,从而充分发挥雄激素的生物功能,或者发挥类雄激素效果直接作用于AR,促进促红细胞素的生成。本研究发现,EGFR在治疗CAA中为核心靶标之一,但目前在CAA方面尚未对该靶标具体的药理学研究,提示研究者可以此为切入点,进行更深一步的探究。
图3示,由KEGG通路富集分析结果和有效成分-成分-疾病靶标-信号通路网络图可看出,现有研究认为黄芪-当归可通过调控PI3K-Akt信号通路和VEGF信号通路来治疗CAA。PI3K-Akt通路下游还有众多通路,其中PI3K-Akt-mTOR通路在调节造血干细胞增殖与分化中发挥着重要作用[24-25]。程明秀[26]等在骨髓间充质细胞(BMSCs)与骨髓单个核细胞(BMNCs)共培养体系中加入滋肾生血药物后发现,药物可促进BMSCs分泌SDF-1,结合造血干细胞的CXCR4受体,激活PI3K-Akt-mTOR通路促进血管的生成,加强造血作用。VEGF信号通路在调控血管生成上发挥着重要作用[27]。研究发现,当VEGF水平升高后可激活VEGF通路的下游Notch通路,促进血管的形成与发育,并改善BMSCs的分化能力[28]。本团队分析,黄芪-当归治疗CAA主要是调控PI3K-Akt-mTOR通路的活性,同时调控VEGF通路,促进BMSCc向血管内皮细胞分化,增加新生血管,调节造血功能,改善血象与症状。
由GO分类富集分析结果可得,黄芪-当归治疗CAA除影响免疫功能和造血功能外,还会对体内多种分子功能、细胞组分、生物过程产生影响。这可能是中医“整体观”的具体表现。
综上所述,本研究体现了黄芪-当归治疗CAA的过程中涉及多个有效成分、成分-疾病靶标及多条信号通路,证实其作用机制复杂的观点。本研究大部分结论与现有研究结果相一致,但同时仍有部分结果未能有相关研究支持,这可能是多次对数据进行交互分析产生的误差,但也不否认这是由于研究不全面所导致的,所以本研究为研究者提供了新的研究切入点。本研究仅从理论层面研究黄芪-当归治疗CAA的作用机制,尚未考虑中药煎煮中发生的成分变化,所以仍需更多的临床试验与相关细胞、分子实验对结论进行验证。
