玉米自交系响应高温、干旱胁迫的关键基因及通路
2021-03-25姚启伦霍仕平张俊军
姚启伦 霍仕平 张俊军

摘要: 以4个不同的玉米自交系为材料,对高温、干旱处理后的苗期植株进行转录组测序。玉米自交系响应高温和干旱胁迫的差异表达基因(DEGs)分别为6 966和6 272个,在高温和干旱胁迫下4个玉米自交系相同的DEGs分别是705和871个。同时响应高温和干旱的DEGs有100个。在耐旱、耐热性强的玉米自交系中鉴定出18个特异的DEGs,其中锌指转录因子、WRKY转录因子、GT转录因子和B2热激转录因子在胁迫响应中发挥关键的调控作用。KEGG通路分析结果表明,耐旱、耐热性强玉米自交响应高温干旱胁迫的DEGs富集在生物学过程、分子功能、代谢过程、遍在蛋白代谢和氮代谢途径5条通路。热带、亚热带玉米种质的耐旱、耐热性强于温带玉米种质,可在热带、亚热带玉米種质中有效筛选耐旱、耐热基因。
关键词: 玉米自交系;高温、干旱胁迫;转录组;差异表达基因;通路
中图分类号: S513 文献标识码: A 文章编号: 1000-4440(2021)01-0029-09
Key genes and pathways of maize inbred lines responding to heat and drought stress
YAO Qi-lun1, HUO Shi-ping2, ZHANG Jun-jun3
(1.School of Advanced Agriculture and Bioengineering, Yangtze Normal University, Chongqing 408100, China;2.Chongqing Three Gorges Acodemy of Agricultural Science, Chongqing 404100, China;3.Heilongjiang Hetian Fengze Agriculture Science and Technology Development Co., Ltd., Harbin 067500, China)
Abstract: Transcriptome sequencing of the four different maize inbred lines subjected to high temperatures and water deficits, was performed at the stage of seedling. In total, 6 966 heat-responsive and 6 272 drought-responsive differentially expressed genes(DEGs) were identified in the four maize lines. In addition, 705 and 871 DEGs were identified as being commonly associated with heat and drought stress, respectively. There were 100 DEGs responding to both heat and drought stress. Eighteen DEGs were identified in maize inbred lines with strong drought tolerance and heat tolerance. The zinc finger transcription factor, WRKY transcription factor, GT transcription factor and B2 heat shock transcription factor played key regulatory roles in stress response. Analyses of KEGG pathway enrichment showed that the pathways such as biological process, molecular function, metabolic process, protein ubiquitination metabolism and nitrogen metabolism were the most highly enriched in the maize lines tolerant to heat and drought. It can be concluded that tropical and subtropical maize is tolerant to heat and drought, implying that it is plausible to screen goal genes in the tropical and subtropical germplasm.
Key words: maize inbred lines;heat and drought stress;transcriptome;differentially expressed genes(DEGs);pathways
高温和干旱是抑制玉米生长发育、制约玉米产量的主要非生物胁迫因子[1]。在干旱、半干旱区,玉米往往受到高温干旱复合胁迫的不利影响[2-3]。全球有43 %的干旱、半干旱耕地,中国干旱、半干旱土地面积约占全国土地面积的近50 %[4-5]。随着温室效应加剧,预计到本世纪末地表气温将上升1~5 ℃,1980-2008年,高温胁迫导致全球玉米产量下降3.8%[6-7]。因此,筛选玉米耐旱、耐热基因,培育耐旱、耐热品种一直是玉米育种界面临的重大课题。迄今关于高温、干旱胁迫对玉米植株形态、生理生化和产量品质不利影响的研究已有较多文献报道。研究结果表明,高温、干旱胁迫下,玉米叶片伸长速率减慢,叶面积减小,茎秆变细[8-9];高温、干旱会减少玉米叶绿素含量、扰乱光合系统,抑制光合作用[10-12];高温、干旱会降低ADP-葡萄糖焦磷酸化酶、淀粉合成酶及分支酶活性,从而抑制碳水化合物合成[13-14];玉米灌浆期,高温、干旱打破植株体内激素间的平衡,减缓细胞分裂速率,缩小籽粒库容,导致产量和品质下降[15]。利用高通量转录组测序(RNA-seq)技术在分子水平解析植物对逆境胁迫的响应是生物技术研究的热点。通过分析生物细胞中转录组的变化规律,可在分子水平探究特定生物学过程中基因组转录调控机制[16-17]。玉米在传播过程中逐渐分化形成了适应其栽培环境的热带、亚热带和温带种质,在分子水平研究不同玉米种质的逆境响应机制,可有效指导耐逆玉米基因的发掘与利用[18]。尽管转录组测序(RNA-seq)技术已成功应用于玉米逆境胁迫研究[19-20],但在逆境胁迫研究中往往只涉及单个胁迫因子以及单一玉米自交系和杂交种。本研究选取热带、亚热带和温带种质,且具有耐旱、耐热性差异的玉米自交系为供试材料,设置高温、干旱2个胁迫处理,结合高温、干旱胁迫下不同玉米种质的生理特性分析,在转录组水平分析不同种质对高温、干旱胁迫的分子响应机制,以丰富植物逆境胁迫研究的数据资料,并为玉米耐旱、耐热基因的筛选提供理论支撑。
1 材料与方法
1.1 试验材料
以长江师范学院选育的4个玉米自交系Suwan-3、Suwan-10、Cim-5和Cim-16为供试材料,Suwan-3和Suwan-10分别以热带和亚热带玉米地方品种为基础材料选育而成, Cim-5和Cim-16以国际玉米小麦改良中心(CIMMYT)的温带玉米群体为基础材料选育而成。2016-2018年田间鉴定玉米自交系的耐旱、耐热性,参照张丽梅等[21]的方法,分别计算各自交系经济产量的耐旱指数(DTI)和耐热指数(HTI),即干旱(或高温)胁迫下经济产量与正常条件(CK)下经济产量的比值,根据经济产量的DTI和HTI筛选出具有明显耐旱耐热性差异的热带、亚热带和温带玉米自交系Suwan-3、Suwan-10、Cim-5和Cim-16。 热带、亚热带玉米自交系Suwan-3、Suwan-10耐旱耐热性强,经济产量的DTI分别为0.86和0.83,HTI分别为0.91和0.93;温带玉米自交系Cim-5和Cim-16耐旱耐热性弱,经济产量的DTI分别为0.57和0.51,HTI分别为0.55和0.49。Suwan-3和Suwan-10作为耐旱、耐热性强的玉米自交系(基因型)试验材料,Cim-5和Cim-16作为耐旱、耐热性弱的玉米自交系(基因型)试验材料。
1.2 胁迫处理
高温、干旱胁迫处理在人工气候箱中进行,4个玉米自交系种子浸种催芽后在控制条件下培养,培养温度29 ℃(昼)/23 ℃(夜),相对湿度70%,每天光照12 h。待幼苗生长至5叶1心,4个自交系各种植18株,其中6株作对照、6株作高溫胁迫处理、6株作干旱处理,共72株(每株1个营养钵)。作对照的4株自交系幼苗置于上述人工气候箱内继续生长;作高温处理的4个自交系幼苗在40 ℃(昼)/34 ℃(夜)、相对湿度70%、每天光照12 h的高温条件下生长7 d;作干旱处理的4个自交系幼苗在温度29 ℃(昼)/23 ℃(夜)、相对湿度20%、每天光照12 h的控水条件下生长7 d。取每个自交系各个处理3株植株的叶片,叶片剪碎后分成2份分别用作生理指标测定和mRNA转录组分析。
1.3 生理指标测定
利用便携式光合仪(LI-6400XT)室外检测待测植株旗叶的叶绿素荧光参数值:光反应最大荧光(F′m)、光反应最小荧光(F′o)、暗适应最大荧光(Fm)、暗适应最小荧光(Fo)和稳态荧光(Fs);基于F′m、F′o、Fm、Fo和Fs,计算PS II潜在光量子产量(Fv/Fo)、PS II最大光化学量子产量(Fv/Fm)、PS II 有效光化学量子产量(ΦPSII)和光化学荧光淬灭系数(QP) [22-27]。采用李小芳等[28]的方法室内检测叶绿素含量、丙二醛(MDA)含量、过氧化物酶(POD)活性和超氧化物歧化酶(SOD)活性。数据分析采用Microsoft Excel 2010和DPS软件。
1.4 叶片RNA提取
采用TRIzol(Invitrogen, Carisbad, CA, USA)法提取对照、高温处理和干旱处理下的4个自交系的叶片RNA,用无RNA的DNA酶Ⅰ去除样品中的DNA,同时检测样品中RNA浓度及其完整性(要求RNA完整值大于6.5),共构建12个mRNA文库。
1.5 转录组文库构建与测序
经片段化后的mRNA反转录合成cDNA,筛选300~500 bp大小的cDNA片段进行PCR扩增,转录组文库质量经Agilent 2100 Bioanalyzer(Agilent Technologies Santa Clata, CA, USA)检测合格后,在Illumina HiSeq 2500测序平台(海元莘生物医药技术有限公司)上进行。测序的基本原理是边合成边测序,采用Illumina novaseq 6000测序,双端测序读数150 bp、读长300 bp。在测序的流式细胞中加入4种荧光标记的 dNTP、DNA 聚合酶以及接头引物进行扩增,在每一个测序簇延伸互补链时,每加入一个被荧光标记的 dNTP 就能释放出相对应的荧光,测序仪通过捕获荧光信号,并通过计算机软件将光信号转化为测序峰,从而获得碱基序列信息。
1.6 转录组序列分析
过滤掉接头污染、低质量(Q<30)和位置碱基氮含量> 5%的初始序列,获取过滤后序列作后续分析。过滤后序列比对到玉米B73参考基因组(https://download.maizegdb.rg/Zm-B73-REFERENCE-GRAMENE-4.0/Zm00001d.2.genomic. fa),利用RSEM(0.9.3版本)软件作基因表达量估算。以P<0.05和|log2FC|≥1为标准,用edgeR软件作差异表达基因(DEGs)分析 [29]。在NCBI的玉米基因数据库中获取DEGs的功能信息,基于内部perl脚本在maizeGDB网站上获取DEGs的GO注释。
1.7 差异表达基因(DEGs)的定量验证
以持家基因Actin为标准,选择8个差异表达基因进行实时定量(qRT-PCR)分析,利用Primer 5.0软件在线设计qRT-PCR反应引物(表1),qRT-PCR反应程序按照ABI2100反应体系(Applied Biosystems, CA, USA)的操作要求进行。各个试验设置3次重复,采用相对定量(2-△△Ct)法[30]估算基因表达量。
2 结果与分析
2.1 玉米自交系对高温、干旱的生理响应
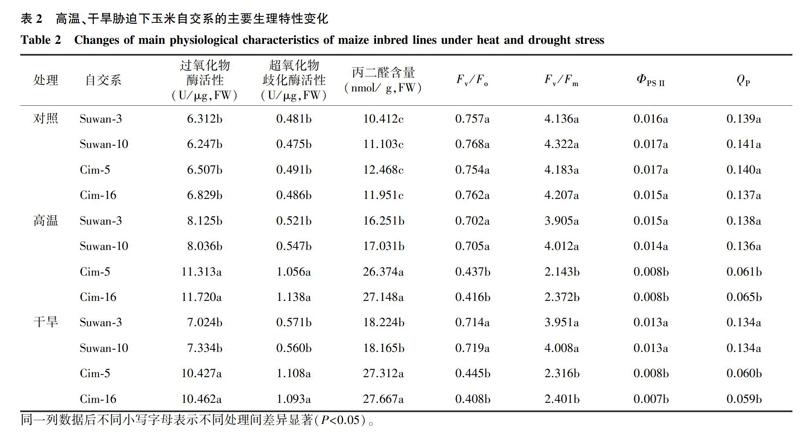
由表2可知,供试材料在单一胁迫因子高温或干旱条件下,玉米自交系Cim-5和Cim-16 的过氧化物酶、超氧化物歧化酶活性以及丙二醛含量较对照显著增加, 4个叶绿素荧光参数值(Fv/Fo、Fv/Fm、ΦPS II和QP)较对照显著下降;热带、亚热带玉米自交系Suwan-3和Suwan-10 除丙二醛含量较对照显著增加外,过氧化物酶、超氧化物歧化酶活性及4个叶绿素荧光参数值则无显著变化,这表明在生理上热带、亚热带玉米种质的耐旱、耐热性强于温带种质。
2.2 玉米自交系响应高温、干旱胁迫的转录组分析
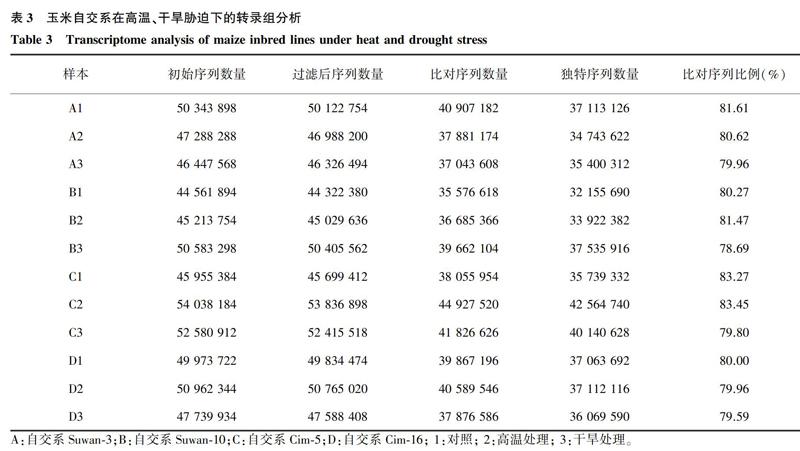
由表3可知,测序得到的初始序列经过除去接头污染、低质量(Q<30)和位置碱基氮含量> 5%的过滤处理后,4个自交系在对照、高温和干旱处理条件下的过滤后序列变幅为44 560 000~54 040 000条,其过滤后序列占初始序列的比例在97.5 %以上,说明转录组文库质量良好。
在4个玉米自交系转录组中共检测到6 966个响应高温胁迫的差异表达基因,自交系Suwan-3、Suwan-10、Cim-5和Cim-16分别有1 444、1 281、2 509和1 732个差异表达基因(图1A);在4个玉米自交系转录组中共检测到6 272个响应干旱胁迫的DEGs,自交系Suwan-3、Suwan-10、Cim-5和Cim-16分别有1 843、1 841、1 414和1 174 个差异表达基因(图1B);4个玉米自交系在高温、干旱和高温干旱胁迫下相同的DEGs分别是705、871和100个, 分别占差异表达基因总数的42%、52%和6%(图1C)。总体上,温带玉米自交系响应高温、干旱胁迫的差异表达基因数(6 829)高于热带、亚热带玉米自交系(6 409)。这表明在分子水平,高温、干旱胁迫对温带玉米自交系的影响更大。
2.3 热带、亚热带玉米自交系在高温、干旱胁迫下特异的差异表达基因
为探明玉米自交系中的耐旱、耐热关键基因,用在FPKM(1 000 000条序列中单个基因的数目)中比对上的Reads数目来度量基因表达水平,在P<0.05和|log2FC|≥1标准下,在耐旱、耐热性强的热带、亚热带玉米自交系Suwan-3和Suwan-10 中筛选特异的差异表达基因。由表4可知,在耐旱、耐热性强的玉米自交系Suwan-3和Suwan-10中有18个特异的差异表达基因同时响应高温和干旱胁迫。这18个差异表达基因极显著差异表达,其中锌指转录因子、WRKY转录因子、GT转录因子和B2热激转录因子一致上调,这4个转录因子在玉米响应高温、干旱胁迫中可能发挥关键的遗传调控作用。
采用qRT-PCR技术,选择8个响应高温、干旱的关键基因Zm00001d053913、Zm00001d018803、Zm00001d035139、Zm00001d002801、Zm00001d012325、Zm00001d015743、Zm00001d017597和 Zm00001d020614,验证转录组中差异表达基因的表达结果,尽管基因Zm00001d012325、Zm00001d015743、Zm00001d017597和 Zm00001d020614在转录组测序中差异表达不显著,但这4个基因在植物响应高温、干旱中发挥重要作用。由图2可见,基因Zm00001d053913、Zm00001d002801、Zm00001d015743和Zm00001d017597上调表达,而基因Zm00001d018803、Zm00001d035139、Zm00001d012325和 Zm00001d020614下调表达,实时定量试验数据与转录组测序数据(RNA-Seq prolifing)结果一致。基因Zm00001d035139 (编码MA3结构域蛋白)在转录组测序中上调表达,而在差异表达基因的定量验证中下调表达,这可能是在基因的定量验证中以持家基因Actin作参照的结果。
2.4 玉米自交系差异表达基因的GO注释
通过对差异表达基因的GO(Gene Ontology)分析,可确定与差异表达基因相关的基因本体项(GO terms),追溯差异表达基因的GO分类条目,揭示差异表达基因与其功能调节关系。根据Kim等[29]的方法,显示4个玉米自交系差异表达基因的GO分类注释结果,由图3中的A2 Vs A1和B2 Vs B1可见,热带、亚热带玉米自交系Suwan-3和Suwan-10响应高温胁迫的差异表达基因在腺嘌呤核苷结合、腺嘌呤脱氧核苷结合、脱氧核苷结合、核苷结合、细胞大分子代谢、细胞内细胞器部分(Intracellur organelle part)、细胞器部分(Organelle part)、初级代谢过程、分子功能、催化活性、大分子代谢途径和生物学过程12个基因本体项同时上调(A2 Vs A1和B2 Vs B1);响应干旱胁迫的差异表达基因在生物学过程、大分子代谢途径、分子功能、代谢途径、质膜、胁迫响应、蛋白质代谢途径以及碱基、核苷、核苷酸和核酸代谢途径8个基因本体项共富集(A3 Vs A1和B3 Vs B1);热带、亚热带和温带玉米自交系响应高温、干旱胁迫的差异表达基因仅在分子功能和生物学过程2个基因本体项同时上调,这表明高温、干旱胁迫主要影响玉米分子功能和生物学过程。
2.5 热带、亚热带玉米自交系差异表达基因的KEGG通路
KEGG通路分析结果(图4)表明,高温、干旱胁迫下自交系Suwan-3和Suwan-10有30个通路受到调控,涉及16个生物学途径、9个细胞组分和5个生物学功能通路,生物学过程、分子功能、代谢过程、遍在蛋白和氮代谢途径5条通路上有大量差异表达基因富集。显著性检验阀值(P值)显示,大量极显著的差异表达基因富集在分子功能、代谢过程、遍在蛋白代谢、氮代谢途径和生物学调节通路。由此推测这些通路在玉米响应高温、干旱胁迫中发挥主要作用。
3 讨论
3.1 不同玉米种质响应高温、干旱胁迫的关键基因
生产上高温往往伴随干旱,不同基因型的玉米种质存在耐旱、耐热性差异[4,7]。本研究转录组测序结果显示,高温、干旱胁迫下不同种质来源的4个玉米基因型存在大量差异表达基因,4个玉米基因型均有100个相同的同时响应高温和干旱胁迫的差异表达基因,在耐旱、耐热性强的玉米自交系中有18个特异的差异表达基因,由此推测这18个差异表达基因调节玉米对高温、干旱胁迫的适应性。植物对高温、干旱胁迫的分子响应是一个包括众多转录调控因子的调控网络[31]。热激转录因子(HSFs)在玉米响应高温、干旱胁迫中发挥重要作用,植物中的HSFs包括A、B和C 3类,除响应高温胁迫外,HSFs還参与其他逆境胁迫的响应[32]。本研究发现,高温、干旱胁迫下,一个B类HSFs在耐旱、耐热性强的玉米自交系中显著上调。GT转录因子、WRKY转录因子和锌指转录因子也是玉米响应非生物胁迫的主要调控因子[33]。这3个转录因子同样存在于本研究18个特异的差异表达基因编码中。转录组分析结果表明,除转录调控因子外,还有一些基因参与玉米响应高温、干旱胁迫,这些基因编码重要的结构蛋白和功能蛋白,其中Zm00001d035139和Zm00001d035475基因分别编码MA3结构域蛋白和异戊烯辅酶A脱氢酶。
3.2 不同玉米種质响应高温、干旱胁迫的通路
通路分析是胁迫生物学中常用的方法。通路即代谢途径,通过调控植物体内物质合成、生理活性和光合产物转运,进而响应逆境胁迫[34]。生物学过程、代谢过程和生物学调节是植物体内重要的代谢通路,参与能量物质和生理活性物质的合成与运输[35]。Zenda等[36]研究发现,耐旱玉米自交系在干旱胁迫下生物学过程、代谢过程和生物学调节通路上的差异表达基因高度富集,这与本研究KEGG通路分析结果一致。氮代谢途径是植物生长发育过程中的一条主要的生理代谢通路,直接参与植物细胞成分合成与细胞活性调节[33]。氮代谢途径是旱生植物响应干旱胁迫的关键通路,遍在蛋白作为调控因子参与植物逆境胁迫响应,在高温、干旱等逆境胁迫下遍在蛋白代谢通路上的差异表达基因高度富集[37]。本研究KEGG通路分析结果发现,耐旱、耐热性强的玉米基因型在高温、干旱胁迫下,氮代谢和遍在蛋白代谢通路上的差异表达基因显著富集。
综上,在高温、干旱胁迫下,不同玉米种质耐旱、耐热基因通过差异表达调控其代谢通路,从而显现生理上的耐旱、耐热性差异,使玉米耐旱、耐热基因的筛选成为可能。基于前期田间鉴定及本研究结果,热带、亚热带玉米种质耐旱、耐热性强于温带玉米种质,在热带、亚热带玉米种质中筛选耐旱、耐热基因更有效。
参考文献:
[1] KADAM N N, XIAO G, MELGAR R J, et al. Agronomic and physiological responses to high temperature, drought, and elevated CO2 interactions in cereals[J]. Advances in Agronomy, 2014, 127: 111-156.
[2] LOBELL D B, SCHLENKER W, COSTA-ROBERTS J. Climate trends and global crop production since 1980[J]. Science, 2011, 333: 616-620.
[3] GONG F, YANG L, TAI F, et al. “Omics” of maize stress response for sustainable food production: opportunities and challenges[J]. OMICS, 2014, 18: 714-732.
[4] 王晓琴,袁继超,熊庆娥. 玉米抗旱性的研究及展望[J]. 玉米科学,2002,10(1):57-60.
[5] 齐 健,宋凤斌,刘胜群. 苗期玉米根叶对干旱胁迫的生理响应[J]. 生态环境,2006,15(6):1264-1268.
[6] 吴 昊,李燕敏,谢传晓. 作物耐热生理基础与基因发掘研究进展[J]. 作物杂志,2018(5):1-9.
[7] 刘克禄,陈卫国. 植物耐热相关基因研究进展[J]. 植物遗传资源学报,2015,16(1):127-132.
[8] 付 景,孙宁宁,刘天学,等. 高温胁迫对玉米形态、叶片结构及其产量的影响[J].玉米科学,2019,27(1):46-53.
[9] KARIM M A, FRACHEBOUD Y, STAMP P. Effect of high temperature on seedling growth and photosynthesis of tropical maize genotypes[J]. Agronomy and Crop Sci, 2000, 184: 217-223.
[10]HASANUZZAMAN M, NAHAR K, ALAM M M, et al. Physiological, biochemical, and molecular mechanisms of heat stress tolerance in plants[J]. Int J Mol Sci, 2013, 14: 9643-9684.
[11]BIAT C A, GERATS T. Plant tolerance to high temperature in a changing environment: scientific fundamentals and production of heat stress-tolerant crops[J]. Front Plant Sci, 2013, 4: 273.
[12]KARIM M A, FRACHEBOUD Y, STAMP P. Photosynthetic activity of developing leaves of Zea mays less affected by heat stress than that of developed leaves[J]. Plant Physiol, 1999, 105: 685-691.
[13]BERRY J, BJOKMAN O. Photosynthetic response and adaptation to temperature in higher plants[J]. Annu Rev Plant Physiol, 1980, 98(673): 491-543.
[14]WATERS A J, MAKAREVITCH I, NOSHAY J. Natural variation for gene expression responses to abiotic stress in maize[J]. The Plant Journal, 2017, 89: 706-717.
[15]裴志超,张伟强,周继华,等. 干旱胁迫对不同基因型玉米产量及其构成因素的影响[J]. 玉米科学,2019,27(4):115-124.
[16]MCGETTIGAN P A. Transcriptomics in the RNA-seq era[J]. Curr Opin Chem Biol, 2013, 17: 4-11.
[17]CASARETTO J A, El-KEREAMY A, ZENG B, et al. Expression of OsMYB55 in maize activates stress-responsive genes and enhances heat and drought tolerance[J]. BMC Genomics, 2016, 17: 312-327.
[18]MEYER R S, PURUGGANAN M D. Evolution of crop species: genetics of domestication and diversification[J]. Nat Rev Genet, 2013, 14: 840-852.
[19]张 健,唐 露,张雅洁,等. 转录组测序技术在植物水淹胁迫研究中的应用[J]. 分子植物育种,2019,17(4):1191-1202.
[20]LI P C, CAO W, FANG H M, et al. Transcriptic profiling maize (Zay mays L.) leaf response to abiotic stresses at the seedling stage[J]. Front Plant Sci, 2017, 8: 290-305.
[21]张丽梅,贺立源,李建生. 玉米自交系耐低磷材料苗期筛选研究 [J]. 中国农业科学,2004,37(12): 1955-1959.
[22]HORTENSTEINER S. Chlorophyll degradation during senescence[J]. Annu Rev Plant Biol, 2006, 57:55-77.
[23]CHEN J P, BURKE J J, XIN Z G. Chlorophyll fluorescence analysis revealed essential roles of FtsH11 protease in regulation of the adaptive responses of photosynthetic systems to high temperature[J]. BMC Plant Biology, 2018, 18: 11-24.
[24]DABROWSKI P, BACZEWSKA A H, PAWLUSKIEWICZ B, et al. Prompt chlorophyll a fluorescence as a rapid tool for diagnostic changes in PSII structure inhibited by salt stress in perennial ryegrass[J]. J Photochem Photobiol B, 2016, 157: 22-31.
[25]SU L Y, DAI Z W, LI S H. A novel system for evaluating drought-cold tolerance of grapevines using chlorophyll fluorescence[J]. BMC Plant Biology, 2015, 15: 82-94.
[26]SCHREIBER U, SCHLIWA U, BILGER W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer[J]. Photosynth Res, 1986, 10: 51-62.
[27]YU Q, SHEN Y, WANG Q, et al. Light deficiency and waterlogging affect chlorophyll metabolism and photosynthesis in Magnolia sinostellata[J]. Trees, 2019, 33: 11-22.
[28]李小芳,張志良. 植物生理学实验指导 [M]. 北京:高等教育出版社,2015.
[29]KIM D, LANGMEAD B, SALZBERG S L. HISAT: A fast spliced aligner with low memory requirements[J]. Nature Methods, 2015, 12(4): 357-360.
[30]WU T D, NACU S. Fast and SNP-tolerant detection of complex variants and splicing in short reads[J]. Bioinformatics, 2010, 26: 873-881.
[31]BIANCHI V J, RUBIO M, TRAINOTTI L, et al. Prunus transcription factors: breeding perspectives[J]. Front Plant Sci, 2015, 6: 443-449.
[32]ZENDA T S, LIU S T, WANG X, et al. Comparative proteomic and physiological analyses of two divergent maize inbred lines provide more insights into drought-stress tolerance mechanisms[J]. Int J Mol Sci, 2018, 19: 3225.
[33]WANG H, WANG H, SHAO H, et al. Recent advances in utilizing transcription factors to improve plant abiotic stress tolerance by transgenic technology[J]. Front Plant Sci, 2016,7:67-73.
[34]LUO M, ZHAO Y, WANG Y, et al. Comparative proteomics of contrasting maize genotypes provides insights into salt-stress tolerance mechanisms[J]. J. Proteome Res, 2018, 17: 141-153.
[35]SHINDE H, TANAKA K, DUDHATE A, et al. Comparative de novo transcriptomic profiling of the salinity stress responsiveness in contrasting pearl millet lines[J]. Environ Exp Bot, 2018, 155: 619-627.
[36]ZENDA T S, LIU S T, WANG X, et al. Key maize drought-responsive genes and pathways revealed by comparative transcriptome and physiological analyses of contrasting inbred lines[J]. Int J Mol Sci, 2019,20:1268.
[37]AHMADI A, EMAM Y, PESSARAKLI M. Biochemical changes in maize seedlings exposed to drought stress conditions at different nitrogen levels[J]. J Plant Nutr, 2010, 33: 541-556.
(責任编辑:陈海霞)
收稿日期:2020-03-17
基金项目:国家自然科学基金项目(31371633);重庆市教委优秀成果转化项目(KJZH17133)
作者简介:姚启伦(1964-),男,重庆万州人,博士,教授,主要从事玉米遗传育种研究。(Tel)13908253365;(E-mail)yql641@aliyun.com
