饮用水中新型环状消毒副产物的毒性研究进展
2021-03-25魏文哲罗家怡赵佳焱楚文海董慧峪周庆施鹏潘旸
魏文哲,罗家怡,赵佳焱,楚文海,董慧峪,周庆,施鹏,潘旸,*
1. 污染控制与资源化国家重点实验室,南京大学环境学院,南京210023 2. 污染控制与资源化国家重点实验室,同济大学环境科学与工程学院,上海200092 3. 中国科学院饮用水科学与技术重点实验室,中国科学院生态环境研究中心,北京100085
饮用水消毒被誉为是20世纪公共卫生领域的重大进步之一[1],但消毒剂会与水中的天然有机物(natural organic matter, NOM)以及溴离子等发生反应生成消毒副产物(disinfection byproducts, DBPs)。自1974年Rook等发现第一个DBP三氯甲烷(trichloromethane, TCM)以来[2],至今在饮用水中已有超过700种DBPs被发现[3]。Wagner和Plewa[4]对100多种DBPs进行了系统的毒理学研究,表明DBPs具有显著的细胞毒性和遗传毒性。同时流行病学研究也显示饮用水DBPs与人类出生缺陷[5-6]以及膀胱癌[7-8]、结肠癌和直肠癌[9-11]等发生率都存在相关关系。鉴于DBPs表现出的高生物毒性效应和致癌风险,美国国家环境保护局(US EPA)和世界卫生组织(World Health Organization, WHO)分别对其中11种和14种DBPs进行了监管[3,12]。
目前发现的DBPs只占总有机卤素(total organic halogen, TOX)的30%~50%[13],表明仍有许多DBPs未探明。最近研究人员在模拟消毒饮用水中鉴定出了许多新型环状类DBPs[14-22],且多为溴代消毒副产物(Br-DBPs)和碘代消毒副产物(I-DBPs),以往研究表明,环状DBPs比链状DBPs、I-DBPs和Br-DBPs往往比氯代消毒副产物(Cl-DBPs)具有更高的细胞毒性、遗传毒性、发育毒性以及生长抑制作用[4,23-25],此外,新型环状DBPs也会部分降解为受监管的链状DBPs[17-18,21,26-27],因此对饮用水水质的影响不容忽视。
1 新型环状消毒副产物的鉴定及暴露水平(Identification and exposure levels of new cyclic disinfection byproducts)
1.1 新型环状消毒副产物的鉴定
目前在模拟消毒饮用水中检测到的新型环状DBPs主要为卤代苯酚类和卤代苯醌类,表1汇总了近年来新型环状DBPs的鉴定情况。2010年Pan等[28]在模拟氯胺消毒饮用水中鉴定了6种新型碘代苯酚类DBPs,包括3-碘-4-羟基苯甲酸(3-I-4-HB)、3,5-二碘-4-羟基苯甲醛(3,5-DI-4-HBA)、3,5-二碘水杨醛(3,5-DI-2-HBA)、3,5-二碘水杨酸(3,5-DI-2-HB)、2,6-二碘-4-硝基苯酚(2,6-DI-4-NP)和2,4,6-三碘苯酚(2,4,6-TIP)。2011年Zhai和Zhang[14]运用超高效液相色谱/电喷雾电离-三重四极杆质谱前驱体离子扫描技术在模拟氯化消毒饮用水中发现了2,4,6-三溴苯酚(2,4,6-TBP)以及3,5-二溴-4-羟基苯甲酸(3,5-DB-4-HB),随后几十种新的卤代苯酚类DBPs陆续在模拟消毒饮用水中被鉴定出[15-16,18-19]。苯酚以及卤代苯酚类物质是消毒过程中形成卤代苯醌类物质重要的前驱体[29-30],2010年首次在消毒后的饮用水中检测到2,6-二氯-1,4-苯醌(2,6-DCBQ)[20],同年2,6-二氯-3-甲基-1,4-苯醌(2,6-DCMBQ)、2,3,6-三氯-1,4-苯醌(2,3,6-TCBQ)和2,6-二溴-1,4-苯醌(2,6-DBBQ)也在饮用水中被检测到[22]。直至今日,仍有许多新型环状DBPs不断被鉴定出,2020年Hu等[17]鉴定出3种新的碘代苯醌类DBPs,分别是2,6-二碘-1,4-苯醌(2,6-DIBQ)、2-氯-6-碘-1,4-苯醌(2,6-CIBQ)和2-溴-6-碘-1,4-苯醌(2,6-BIBQ),这是首次在模拟氯胺消毒的饮用水中检测到碘代苯醌类DBPs,而I-DBPs往往具有更高的毒性效应[23-24]。近期氯苯乙腈类DBPs和卤代氨基酸类DBPs也被鉴定出[31-33]。
1.2 饮用水中新型环状消毒副产物的暴露水平
表2汇总了近10年来国内外各地实际饮用水样中新型环状DBPs检出量水平。研究者分别于2010年[22]、2012年[30]和2014[34]在美国和加拿大的多处饮用水厂中检测到2,6-DCBQ、2,6-DCMBQ、2,3,6-TCBQ和2,6-DBBQ这4种卤代苯醌,浓度范围分别为nd~274 ng·L-1、nd~6.5 ng·L-1、nd~20 ng·L-1和nd~37.9 ng·L-1,2020年Hu等[17]在中国上海和南京的12处龙头水样品中检测到了2,6-DCBQ(4.0~41.2 ng·L-1)和2,6-DBBQ(0.8~4.9 ng·L-1),此外还首次检测到了2,6-DIBQ和2,6-CIBQ这2种碘代苯醌类DBPs,浓度分别为0.4~1.8 ng·L-1和0.7~1.3 ng·L-1,实际饮用水样中检出的苯醌类DBPs主要以2,6-DCBQ为主,溴代和碘代苯醌类DBPs含量较少。此外苯醌类DBPs也在泳池水样中被检出,其中2,6-DCBQ浓度高达299 ng·L-1,是其进水浓度的100倍[35]。
Pan等[28]在中国长三角地区9个城市的水源水和龙头水样品中检测到了4种新型环状DBPs,分别是2,6-DI-4-NP(0.17~3.9 ng·L-1)、3,5-DI-4-HBA(nd~0.67 ng·L-1)、2,4,6-TIP(nd~0.43 ng·L-1)和2,4-二碘6-硝基苯酚(2,4-DI-6-NP, 0.12~24 ng·L-1),硝基苯酚类DBPs普遍检出可能是由于长江水源水中溶解性有机氮浓度较高。在另一项针对中国东部(长三角以及太湖流域)8个城市的水源水和龙头水调查中检测到12种新型环状DBPs,其中2,4,6-三氯苯酚(2,4,6-TCP)的检出浓度最高,达到了215.0 ng·L-1[18]。Zhang等[36]在对深圳的饮用水厂进行调查时检测到12种新型环状DBPs,其中2,6-二氯-4-硝基苯酚(2,6-DC-4-NP)、2,6-二溴-4-硝基苯酚(2,6-DB-4-NP)和2-溴-4-氯-6-硝基苯酚(2-Br-4-Cl-6-NP)首次在实际氯化饮用水中检测到,单个DBP浓度范围为4.9~8.3 ng·L-1。
2 新型环状消毒副产物的生物毒性(Toxicity of new cyclic disinfection byproducts)
2.1 新型环状消毒副产物的细胞毒性和遗传毒性
卤代苯醌类DBPs的细胞毒性远高于卤代甲烷、卤乙醛、卤代硝基甲烷和亚硝胺类DBPs[4]。Hung等[37]用人结肠细胞(CCD841CoN)和人肝癌细胞(Hep G2)评价了2,6-DCBQ的急性毒性,半数抑制浓度(IC50)分别为472 μmol·L-1和557 μmol·L-1,即2,6-DCBQ暴露1 h的急性细胞毒性与很多链状DBPs的慢性细胞毒性(72 h)相当甚至更强[4]。Du等[38]用膀胱癌细胞(T24)对2,6-DCBQ、2,6-DCMBQ、2,3,6-TCBQ和2,6-DBBQ进行24 h暴露的细胞毒性实验,MTS细胞活力检测显示IC50值分别为95、110、151和142 μmol·L-1,2,6-DCBQ显示出最大的细胞毒性。此外,乳酸脱氢酶法(LDH)检测显示加入抗氧化剂N-乙酰-L-半胱氨酸(NAC)后细胞毒性明显降低,表明暴露于苯醌类DBPs后使细胞内产生活性氧(reactive oxygen species, ROS),支持氧化应激(oxidative stress, OS)是苯醌类DBPs产生细胞毒性的作用机制,用中性红摄取法(NRU)和实时细胞-微电子传感细胞毒性实验法(RT-CES)测得2,6-DCBQ、2,6-DCMBQ、2,3,6-TCBQ和2,6-DBBQ的IC50分别为11.4、148、113和45.7 μmol·L-1和1.9、58.7、95.6和21.4 μmol·L-1[39],尽管存在着测定方法上的差异,但均显示2,6-DCBQ的细胞毒性最大。
异构体和卤素取代基类型会显著影响细胞毒性大小。Li等[40]用RT-CES法评价了中国仓鼠卵巢细胞(CHO-K1)分别暴露于2,5-二氯-1,4-苯醌(2,5-DCBQ)和2,6-DCBQ不同时间段的细胞毒性,2,5-DCBQ的细胞毒性均明显强于2,6-DCBQ的细胞毒性。此外,卤素取代基类型也会影响细胞毒性,暴露24 h后,细胞毒性大小为2,3-二碘-1,4苯醌(2,3-DIBQ)>2,6-DBBQ>2,6-DCBQ,类似的结论在Hep G2细胞中也得到了证实[17]。这一趋势与已报道的其他DBPs的细胞毒性是一致的,如卤乙酸类DBPs中碘乙酸(IAA)>溴乙酸(BAA)>氯乙酸(CAA)[41-42]。
卤代苯酚类物质也是近期新检出的一类新型环状DBPs。Vlastos等[43]研究了2-氯苯酚(2-CP)对海洋细菌费舍尔弧菌的发光抑制效果,IC50为(16±1.0) μg·mL-1,根据欧洲立法建立的毒性分类,2-CP被归类为对水生生物有害的化合物。Chen等[44]用发光青海弧菌Q67评价了7种卤代苯酚类DBPs的急性毒性,毒性大小为2,5-二溴对苯二酚(2,5-dibromohydroquinone, 2,5-DBHQ)>2,4-二溴苯酚(2,4-DBP)>4-溴-2-氯苯酚(2-Cl-4-BP)>2,6-DB-4-NP>2,6-DC-4-NP>2-溴-4-氯苯酚(2-Br-4-CP)>4-溴苯酚(4-BP),混合物效应研究表明7种卤代苯酚类DBPs之间毒性协同作用的概率随着其浓度水平的升高而升高,在啶脲和镉的混合物毒性研究中也观察到此现象[45]。

表2 国内外地区饮用水中部分新型环状消毒副产物浓度水平Table 2 Concentration levels of new cyclic DBPs in drinking water in some areas at home and abroad
卤素取代基数量和类型同样会影响芳香族DBPs细胞毒性大小,Zhang等[46]用CHO-K1细胞测得4-BP和2,4-DBP的IC50分别为30.8 μmol·L-1和10.9 μmol·L-1,表明卤素取代基越多细胞毒性越大。Liberatore等[47]用CHO-K1细胞测试了2-碘苯酚(2-IP)、4-碘苯酚(4-IP)和2,4,6-TIP的细胞毒性,IC50分别为601、216和43.7 μmol·L-1,同样符合多卤代化合物毒性高于单卤代化合物的规律。Zhang等[36]更加全面地测定了15种新型环状DBPs的CHO-K1细胞毒性,毒性顺序为2,6-DB-4-NP>2,6-DC-4-NP>2-Br-4-Cl-6-NP>2,4,6-TBP>3,5-二溴-4-羟基苯甲醛(3,5-DB-4-HBA)>2,6-二溴-4-氯苯酚(2,6-DB-4-CP)>2,6-二氯-4-溴苯酚(2,6-DC-4-BP)>3,5-二溴-2-羟基苯甲酸(3,5-DB-2-HB)>3-溴-5-氯-4-羟基苯甲醛(3-Br-5-Cl-4-HBA)>2,4,6-TCP>3,5-二氯-4-羟基苯甲醛(3,5-DC-4-HBA)>3-溴-5-氯-2-羟基苯甲酸(3-Br-5-Cl-2-HB)>3,5-二氯-2-羟基苯甲酸(3,5-DC-2-HB)>3,5-DB-4-HB>3,5-二氯-4-羟基苯甲酸(3,5-DC-4-HB),毒性规律为卤代硝基苯酚>卤代苯酚>卤代苯甲醛>卤代苯甲酸,I-DBPs>Br-DBPs>Cl-DBPs,含氮DBPs>不含氮DBPs。类似的规律在Hep G2细胞毒性实验中也得到了证实[16,26]。
遗传毒性是评估外源化合物、辐射等对生物体遗传相关过程产生有害作用的重要指标。Zuo等[48]测定了2,6-DCBQ和5种常规DBPs对线虫的遗传毒性,结果显示,暴露于300~500 μmol·L-1的2,6-DCBQ中可引起线虫DNA显著损伤,同等浓度的N-亚硝基二甲胺、三氯乙酸、二溴乙酸、二氯乙酸和一溴乙酸均对线虫的DNA没有影响,当N-亚硝基二甲胺浓度增加到25 mmol·mL-1时才对线虫造成明显的DNA损伤。Vlastos等[43]的研究表明,2-CP会显著增加鲫鱼外周红细胞和人淋巴细胞的微核率,引起DNA损伤。这是第一次在较低浓度下(16 μg·mL-1)观测到2-CP对人体细胞的遗传效应,以往的研究虽证实了人牙龈成纤维细胞暴露于2-CP后DNA断裂的可能性,但暴露浓度较高,达到了0.5 mg·mL-1[49]。Yin等[50]发现斑马鱼肝脏基因组p53在连续10 d暴露于5 μg·L-1的2,4,6-TCP时基因点突变增加,表现出较强的遗传毒性,提示2,4,6-TCP可能通过诱导基因点突变而导致癌症的发生。类似的遗传毒性效应在中国仓鼠V79细胞中也被观察到[51],WHO已将2,4,6-TCP归类为B2,即疑似具有致癌特性的化合物[52]。
Du等[38]用T24细胞研究了饮用水中4种典型的卤代苯醌类DBPs的遗传毒性,发现均能够诱导8-羟基脱氧鸟苷(8-OHdG)的产生,大小顺序为2,6-DCMBQ>2,6-DCBQ>2,6-DBBQ>2,3,6-TCBQ,其中2,6-DCMBQ诱导产生的8-OHdG约为对照组的10倍,8-OHdG作为一种重要且最丰富的氧化损伤形式,可导致基因组DNA的点突变[53]。暴露时间对物质诱导遗传毒性的大小具有显著影响[40],CHO-K1细胞暴露在8种卤代苯醌类DBPs约12 h和24 h后,8-OHdG的产生量和p53基因的表达水平均有显著差异。暴露12 h后仅2,5-二溴-1,4-苯醌(2,5-DBBQ)和2-氯-1,4-苯醌(2-CBQ)诱导CHO-K1细胞产生8-OHdG,2,5-DBBQ和2,3-DIBQ增加了p53基因的表达,其他卤代苯醌与对照组相比均无显著差异;暴露24 h后CHO-K1细胞内8-OHdG产生的水平大小为2,6-DCBQ>2,3,6-TCBQ>2,6-DBBQ≥2,5-DBBQ>2-CBQ≈2,3-DIBQ≈2,3,5,6-四氯-1,4-苯醌(2,3,5,6-TCBQ)≈2,5-DCBQ,此时2,5-DBBQ、2,3-DIBQ、2,6-DCBQ和2,5-DCBQ均能够增加p53基因的表达,一旦p53基因被激活,p53蛋白将进一步调节细胞周期停滞、凋亡或衰老[54-55]。对异构体进行分析发现相对于2,5-二卤代苯醌,2,6-二卤代苯醌能够诱导细胞产生更多的8-OHdG,但诱导产生的p53蛋白含量却相对较少。
研究人员对DBPs的致毒机理进行了许多探讨,其中氧化应激被视为一种重要的细胞损伤机理途径[56-57]。细胞内ROS的含量水平在一定程度上可以反映氧化应激的程度。Hung等[37]测定了2,6-DCBQ暴露下CCD841CoN细胞和Hep G2细胞内ROS水平,根据荧光素酶强度与细胞内ROS水平成正相关的关系[58],结果表明暴露于不同浓度的2,6-DCBQ溶液24 h后细胞内ROS含量比暴露1 h后相对降低了60%,说明细胞内存在抗氧化酶系统抵御2,6-DCBQ诱导的氧化应激反应,这一结论在其他研究中也被证实[59-61]。Lou等[62]研究了2,6-DCBQ和典型的茶多酚如表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate, EGCG)以不同比例混合后对Hep G2细胞毒性和氧化应激的影响,结果表明,当2,6-DCBQ浓度固定在50 μmol·L-1时,EGCG浓度从0 μmol·L-1增加到50 μmol·L-1后,Hep G2细胞的存活率从20.0%提高到了65.2%,通过测定不同比例的2,6-DCBQ和EGCG混合后的ROS产生量发现,随着EGCG浓度的增加,Hep G2细胞内ROS产生量越来越少,EGCG浓度从0 μmol·L-1增加到50 μmol·L-1后ROS产生量减少了86.6%,表明产生ROS是细胞内的一种致毒途径,而EGCG可以清除细胞内产生的ROS,降低物质引起的细胞毒性,提高细胞存活率。异构体和卤素取代类型对物质诱导产生ROS也具有一定影响,CHO-K1细胞暴露于8种卤代苯醌后细胞内产生ROS的水平为2,3-DIBQ>2,5-DBBQ>2,3,5,6-TCBQ≥2,5-DCBQ>2-CBQ>2,6-DBBQ>2,3,6-TCBQ>2,6-DCBQ,其中2,3-DIBQ诱导产生的ROS水平为2,6-DCBQ的2.9倍,异构体方面2,5-DBBQ和2,5-DCBQ诱导细胞产生的ROS与2,6-DBBQ和2,6-DCBQ的比值分别为1.4和2.1,此外卤素取代基类型也会显著影响ROS生成水平,2,3-DIBQ诱导细胞内产生的ROS水平分别是2,5-DBBQ、2,5-DCBQ、2,6-DBBQ和2,6-DCBQ的1.2倍、1.4倍、1.7倍和2.9倍。这一顺序基本与细胞毒性顺序类似(2,3-DIBQ≥2-CBQ>2,5-DBBQ>2,3,5,6-TCBQ≈2,5-DCBQ≥2,6-DBBQ>2,6-DCBQ≥2,3,6-TCBQ),说明氧化应激反应是导致细胞毒性的重要机制之一[40]。
外源性物质与抗氧化酶系统的相互作用也被证实为是致毒机理之一。研究表明卤代苯醌类DBPs处理T24细胞可以显著降低细胞内谷胱甘肽(GSH)水平,且GSH降低的水平与卤代苯醌浓度呈正相关,当细胞内GSH被GSH抑制剂丁硫氨酸亚砜亚胺抑制活性时,卤代苯醌的IC50相对降低了30%~80%[63]。此外在处理细胞之前向培养基中添加10 mmol·L-1GSH可以显著降低卤代苯醌类DBPs诱导的细胞毒性,超高效液相色谱-高分辨率质谱和电子顺磁共振波谱研究显示卤代苯醌类DBPs可以与GSH直接结合形成各种谷胱甘肽结合物,进一步降低细胞内GSH含量[64]。同时,与GSH相关的抗氧化酶活性也被卤代苯醌类DBPs改变,研究显示T24细胞暴露于卤代苯醌类DBPs后,细胞内谷胱甘肽S-转移酶(GST)活性显著提高,谷胱甘肽过氧化物酶(GPx)活性未改变或稍有降低[63],在MCF-7细胞中有类似的结论[65]。Zhang等[36]通过分子对接和定量构效关系(quantitative structure-activity relationship, QSAR)建模发现15种卤代芳香族DBPs与过氧化氢酶(CAT)的结合力大小被纳入到拟合预测方程当中,而CAT又是抗氧化酶系统中很重要的一类酶,能够发挥抵御ROS的作用。
外源性物质也会改变相关基因表达,Li等[66]证实了人尿路上皮细胞(SV-Huc-1)暴露于卤代苯醌类DBPs后会导致细胞中与氧化信号通路相关的44个基因发生改变,暴露2 h后,9~28个基因表达量改变;暴露8 h后,29~31个基因发生应激诱导的改变,对卤代苯醌类DBPs暴露作出反应的其他典型途径包括GSH氧化还原、超氧自由基降解和异源代谢信号等。卤代苯醌类DBPs和卤代苯酚类DBPs诱导细胞产生的氧化应激效应以及DNA损伤和与抗氧化酶系统之间的反应等与细胞毒性和遗传毒性息息相关,类似的致毒机理表明细胞毒性和遗传毒性之间具有一定的相关性[67]。
2.2 内分泌干扰效应
内分泌干扰物质(endocrine disrupting chemicals, EDCs)能够通过模拟或者抑制内源性激素的作用,干扰内源性激素的生成或者活性[68]。核受体家族一般分为6大类[69],其中研究较多的为雌激素、雄激素和甲状腺激素,它们是整个内分泌系统中最重要的几类激素,对人的健康发育有着重要影响。外源性物质一般通过受体介导途径和非受体介导途径来干扰生物体正常的运转[69-71]。
Ezechiáš等[72]用2种酵母报告基因实验测定了2,4,6-TBP的雌激素效应和雄激素效应,使用荧光素酶报告基因法获得的抗雌激素IC50值为14.1 μmol·L-1,抗雄激素IC50值为3.9 μmol·L-1;用β-半乳糖苷酶报告基因法获得的抗雌激素IC50值为9.2 μmol·L-1,表明2,4,6-TBP能与雌、雄激素受体的活性部位相结合,表现出相应的雌雄激素效应。类似的结论在人成骨细胞(U2OS)中也有体现。Hamers等[73]用AR-CALUX实验测得2,4,6-TBP抗雄激素IC50>15 μmol·L-1,抗雌IC50为8.3 μmol·L-1,所得同一物质的雌雄激素效应有所差别是由于不同报告基因实验本身之间的灵敏度和实验条件具有差异[74]。2,4,6-TBP在体内实验中也表现出较强的内分泌干扰效应,斑马鱼胚胎长期暴露于2,4,6-TBP溶液中会改变其类固醇合成基因的表达,导致性激素水平失衡以及雌性生殖力下降,增加后代畸形鱼的概率,降低存活率[75]。Olsen等[76]用人乳腺癌细胞(MCF-7)研究了4-BP、2,4-DBP和2,4,6-TBP的雌激素活性,三者都会与雌激素受体结合,但2,4,6-TBP仅在1 μmol·L-1浓度时取代43%的放射性标记的雌激素,且细胞增殖实验结果表明4-BP和2,4-DBP明显抑制雌二醇诱导的细胞生长,雌激素效应的结果并不遵循细胞毒性中多卤代取代毒性较大的规律,这揭示了内分泌干扰效应与细胞毒性之间完全不同的内在机理。Holmes等[77-78]用激素受体竞争结合实验评价了21种DBPs与雌激素受体和雄激素受体的结合能力,其中2,4,6-TCP和2-CP以及3,4,5,6-四氯-1,2-苯醌具有较弱的雄激素受体结合能力,2,4,6-TCP和3,4,5,6-四氯-1,2-苯醌以及2,6-DCBQ具有较弱的雌激素受体结合能力,二元混合物研究表明3,4,5,6-四氯-1,2-苯醌与4-正壬基酚具有一定的拮抗作用,而2,4,6-TCP和2-CP与4-正壬基酚具有一定的协同作用,这提醒我们应当注意实际水样中DBPs的混合毒性效应。
Yang等[79]采用竞争性荧光置换法测定了17种卤代芳香族DBPs与人转甲状腺素载体蛋白(hTTR)的结合能力和作用机理,结合力大小为2,4,6-三卤苯酚>2,6-二卤-4-硝基苯酚>3,5-二卤-4-羟基苯甲醛>3,5-二卤-4-羟基苯甲酸≈卤代水杨酸,结合力最大的2,4,6-TIP的logRP(阳性对照物质与测试物质的IC50比值的对数)为0.421,结合力最小的5-溴水杨酸(5-Br-2-HB)的logRP为-3左右。除了2,4,6-TIP外,2,4,6-TBP和2,6-DB-4-NP的logRP均>0,表明这3种物质与hTTR结合的能力比阳性对照物质更强,对人体甲状腺系统有很强的干扰能力。Kollitz等[80]测定了2,4,6-TCP、2,4,6-TBP和2,4,6-TIP对人和斑马鱼甲状腺受体的影响,结果显示三卤苯酚类DBPs对人甲状腺受体亲和力随着卤素分子量和原子半径的增加而增加,2,4,6-TCP、2,4,6-TBP和2,4,6-TIP的亲和力常数分别为56、30.6和1.6 μmol·L-1,但其对斑马鱼的甲状腺受体亲和力大小并不遵循此规律,2,4,6-TCP、2,4,6-TBP和2,4,6-TIP的亲和力常数分别为13.68、31.28和2.68 μmol·L-1,可能与物种间的差异以及配体结合区内氨基酸的差异有关。其他研究也证实了2,4,6-TBP和2,4,6-TIP具有较强的甲状腺激素效应,严重影响人甲状腺系统的正常运转[73,81-83]。另外Xi等[84]测定了10种卤代苯甲酸对hTTR的亲和力大小,发现卤代苯甲酸为中等或弱hTTR结合剂,表明与卤代苯酚类DBPs结构相似的卤代苯甲酸类物质也是一种潜在的hTTR结合剂。
除上述3种激素效应之外,研究人员们还对新型环状DBPs的其他内分泌干扰效应进行了一定的探索。研究表明,2,4,6-TBP具有一定的孕激素(PR)拮抗剂效应,其IC50>15 μmol·L-1[73],能够抑制雌二醇的生成和代谢,干扰内分泌细胞钙离子信号转导[85],从非受体途径上对雌激素产生干扰。Li等[86]用酵母法研究了双酚A及其部分衍生物对人维甲酸X受体的激动性和拮抗性,结果表明双酚A及其衍生物对人维甲酸X受体没有激动性,但具有较强的拮抗性,其中2,4,6-TCP和双酚A的IC20分别为0.22 mg·L-1和17.45 mg·L-1,2,4,6-TCP对人维甲酸X受体的拮抗活性是其母体化合物双酚A的79.32倍。基于人力、物力以及财力的有限性,研究人员不可能对所有物质的所有内分泌干扰效应都做出一定的实验研究,基于此种情况分子对接技术逐渐在研究DBPs的内分泌干扰效应领域上发展起来。
2.3 其他毒性效应
发育毒性是评估子代在发育成长过程中出现的各种异常现象的毒理学指标。研究表明非挥发性DBPs通常具有比挥发性DBPs更高的发育毒性。研究人员故意制备“浓缩”的模拟饮用水样品,含有足够浓度的挥发性和非挥发性DBPs,对其中一份样品进行氮吹处理以消除挥发性DBPs,另一份样品不进行处理,结果显示发育毒性指数并无显著差异,说明挥发性DBPs对发育毒性的贡献可忽略不计,合理的解释为非挥发性DBPs特别是芳香族类DBPs可能是发育毒性的主要贡献者[89]。Liu等[90]对自来水样品进行了煮沸实验,发现沸腾5 min后水样发育毒性较之前下降了50%以上,对自来水样品中DBPs成分进行分析发现在自来水沸腾过程中许多环状DBPs会发生脱羧和水解反应进而转化成常规链状DBPs,这一过程也被其他研究人员所证实[91],环状DBPs的含量与发育毒性呈正相关关系,侧面证实了其具有较高的发育毒性。目前,此类新型环状DBPs的发育毒性也已被直接证实。Yang和Zhang[92]利用海洋中的一种多毛类动物对多种卤代芳香族DBPs进行发育毒性的测试,结果显示卤代芳香族DBPs发育毒性大小为2,6-DI-4-NP>2,4,6-TIP>4-溴-2-氯苯酚(4-Br-2-CP)>4-BP>2,4-DBP>2,6-DB-4-NP>2-Br-4-CP>2,6-DC-4-NP>2,4-二氯苯酚(2,4-DCP)>2,4,6-TBP>3,5-DB-4-HBA>溴仿>2,4,6-TCP>2,6-二溴苯酚(2,6-DBP)>2,6-二氯苯酚(2,6-DCP)>碘乙酸>三溴乙酸>溴乙酸,表明卤代芳香族DBPs具有比链状DBPs更高的发育毒性,I-DBPs比Br-DBPs的发育毒性大,而Br-DBPs又比Cl-DBPs的发育毒性大,含氮DBPs比不含氮DBPs发育毒性大,这与细胞毒性的规律基本一致。类似的结论在研究环状I-DBPs的发育毒性中也得到体现,其中2,6-DI-4-NP和2,4,6-TIP的发育毒性比二碘乙酸、氯碘乙酸和碘乙酸高3个数量级[93]。斑马鱼胚胎作为研究发育毒性的一种常见受试生物,Wang等[94]的研究表明,暴露于0.5~10 μmol·L-1的卤代苯醌和0.5~5 mmol·L-1的卤乙酸120 h后,斑马鱼胚胎发生明显的发育畸形,包括气囊充气失败、心脏畸形和脊柱弯曲等,发育毒性大小为2,5-DCBQ>2,5-DBBQ>2,6-DCBQ>2,3,5,6-TBBQ>2,3,5,6-TCBQ>碘乙酸>二溴乙酸>二氯乙酸,苯醌类DBPs的发育毒性远远大于链状DBPs。
生长抑制作用一般指外源性物质对藻类植物的生长毒害作用。Liu和Zhang[95]通过测定叶绿素a的浓度确定了20种卤代芳香族DBPs和5种卤乙酸对自养型海洋藻Tetraselmismarina的生长抑制作用,其大小为2,4,6-TIP>3,5-DI-4-HBA>2,4,6-TBP>2,6-DI-4-NP>2,4-DBP>4-Br-2-CP>4-IP>3,5-DB-4-HBA)>2-Br-4-CP>2,4,6-TCP>4-BP>2,4-DCP>2,6-DB-4-NP>4-氯苯酚(4-CP)>2,6-DC-4-NP>2,6-DBP>3,5-DC-4-HBA>碘乙酸>2,6-DCP>5-氯水杨酸(5-Br-2-HB)>三溴乙酸>溴乙酸>5-Cl-2-HB>氯乙酸,其中2,4,6-TIP、碘乙酸、溴乙酸和氯乙酸的半数效应浓度(EC50)分别为2.87、2 190、7 560和40 900 μmol·L-1,表明卤代芳香族DBPs对藻类的生长抑制作用远远大于常规卤乙酸类DBPs。
Xie等[96]报道了2,4,6-TCP、2,4,6-TBP和2,4,6-TIP对巨噬细胞的免疫毒性和免疫调节作用,细胞毒性大小为2,4,6-TIP>2,4,6-TBP>2,4,6-TCP,但对巨噬细胞极化表现出不同的偏好,200 μmol·L-1的2,4,6-TIP显著诱导巨噬细胞M2显性极化,200 μmol·L-1的2,4,6-TCP显著诱导巨噬细胞M1显性极化,而2,4,6-TBP诱导巨噬细胞M1和M2极化的能力中等。由于M1和M2巨噬细胞分别促进炎症反应和抗炎症反应,从而表明3种DBPs可能导致不同的免疫毒性和疾病类型。Zuo等[48]测定了2,6-DCBQ和5种常规链状DBPs对秀丽线虫的致死率、呼吸速率和DNA损伤的影响。暴露24 h后对线虫的致死率大小为2,6-DCBQ>二溴乙酸>三氯乙酸>二氯乙酸,半数致死浓度(LC50)分别为328、1 220、1 430和1 720 μmol·L-1,N-亚硝基二甲胺对线虫致死率没有显著的影响,LC50>50 000 μmol·L-1。所有测试的化合物质都能导致线虫呼吸速率的降低,大小顺序与线虫致死率保持一致。对线虫DNA损伤进行分析发现只有当暴露于300~500 μmol·L-1的2,6-DCBQ时可对线虫DNA造成损伤,表明苯醌类DBPs具有较高的生物毒性和体内遗传效应,遗传毒性会增加潜在的患癌风险,研究也表明苯醌类物质是一种潜在的致癌物[30,97]。
新型环状DBPs因较高的生物毒性效应越来越受到人们的广泛关注,表3总结了近年来此类新型环状DBPs的上述各类生物毒性效应研究。
3 QSAR建模在新型环状消毒副产物毒性效应方面的应用(Application of QSAR in the toxic effects of new cyclic disinfection byproducts)
随着饮用水中鉴定的DBPs数量激增以及相关的经济和人力负担,研究人员最近开始运用QSAR模型来模拟及预测DBPs的形成、控制、去除和毒性效应[98]。QSAR通常通过数据收集、选取分子描述符、算法选择以及模型验证4个步骤来进行建模,而QSAR建模技术的使用基于2个原则:(1)结构相似的化合物在相似的环境条件下会表现出相似的特性;(2)化合物之间的行为差异与其结构和组成有关,这与饮用水中新型环状消毒副产物具有类似结构的特性相契合。使用QSAR建模将结构和活性联系起来的概念在100多年前已提出,随后在医学和生物学领域研究中得到了广泛的应用[98]。DBPs与QSAR的整合研究发生在1991年,Tuppurainen等[99]开发了第一个专门针对DBPs毒性的QSAR模型。
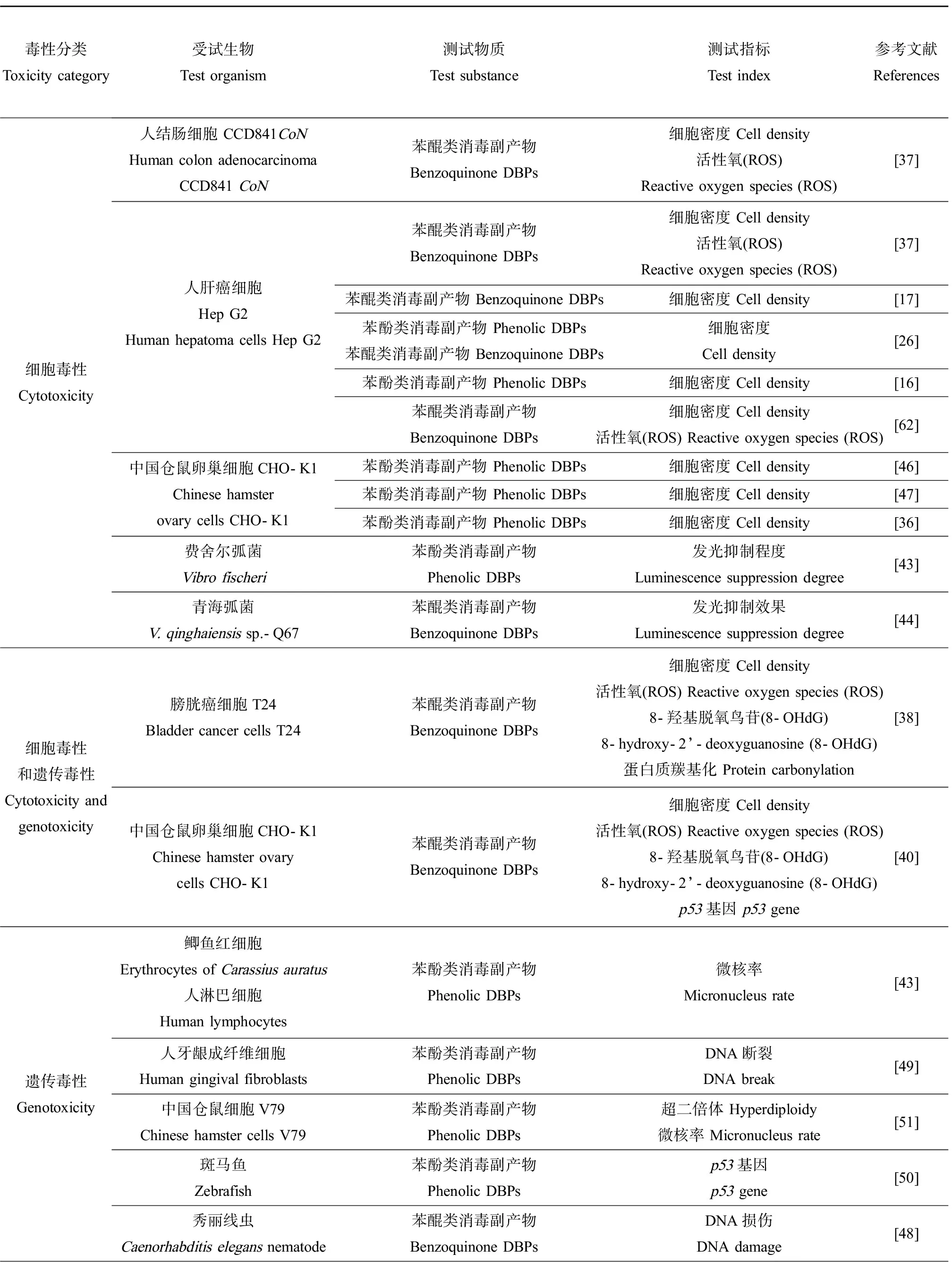
表3 新型环状消毒副产物的生物毒性Table 3 Biological toxicity of new cyclic DBPs
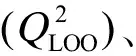
4 结论和展望(Conclusion and outlook)
饮用水中出现的新型环状DBPs,浓度水平多在ng·L-1,但通常具有比常规链状DBPs更高的生物毒性。目前对于新型环状DBPs的毒性研究还主要局限在体外实验,缺乏有效的体内实验数据和相应的人群资料以及多种新型环状DBPs混合存在时的毒性效应研究,同时QSAR建模多停留在理论层面,缺乏相应实验数据佐证。因此,未来针对新型环状DBPs的重要研究方向为建立多种体外毒性和体内毒性的综合毒性数据库,结合QSAR建模健全不同毒性效应的致毒机理,并探究新型环状DBPs在饮用水中的前体物转化和生成控制原理等。
