硫掺杂ZnFe2O4/蒙脱石复合材料的铀酰吸附研究*
2021-03-24宋绵新霍婷婷刘孟清李海龙林艳辉罗伟格
李 宇,边 亮,宋绵新,霍婷婷,刘孟清,李海龙,林艳辉,罗伟格
(1.西南科技大学 环境与资源学院,四川 绵阳 621010;2.西南科技大学 材料科学与工程学院,四川 绵阳 621010)
0 引言
铀是一种具有放射性和化学毒性的核素[1],通常在土壤、岩石和水中的浓度很低。然而,由于人类活动,如铀矿的开采和加工等会产生大量含铀废水,使环境水体中的铀浓度升高[2]。过量的铀对地下水和地表水均是一种风险,对人类健康构成巨大威胁。根据世界卫生组织设定的指导值,饮用水中允许的铀质量浓度为2~30 μg/L,超过可致肾损伤和肝脏损伤[3]。因此,含铀废水的治理对于环境安全意义重大。
铀在酸性氧化环境中通常以铀酰离子(UO22+)形式存在[4],因此针对含铀废水的处理实际上是对废水中UO22+的处理。各种技术如化学沉淀、电沉积、溶剂提取、混凝、电化学处理和吸附等,已被用于环境水体中UO22+的去除[5]。在这些技术中,吸附被认为是一种直接且对环境友好的技术,它具有成本低、用途广和操作简单的优点[6]。在众多吸附剂中,蒙脱石因其价格低廉、储量丰富而被广泛应用于各种工业废水处理中[7-8];然而,将吸附饱和后的蒙脱石从水溶液中分离通常比较繁杂和耗时。基于磁性纳米颗粒的复合吸附剂可从水溶液中通过外加磁场而简单分离,且这种分离不仅可以提高废水处理效率,还能降低成本[9]。磁铁矿(Fe3O4)与蒙脱石复合可实现磁分离,这已在众多研究中得到了证明[10-11]。XIAO等[12]研究了UO22+在Fe3O4/MMT复合材料表面的吸附,但其UO22+吸附量相对较小(28.80 mg/g);这是由于Fe3O4纳米颗粒容易团聚,其高比表面积的优势被限制,从而导致磁性蒙脱石的低UO22+吸附性能[13]。过渡金属掺杂Fe3O4可明显改善其团聚现象,进而改善其吸附性能。例如JIANG等[14]研究发现ZnFe2O4/MMT的UO22+吸附能力可达到39.66 mg/g,与未经过渡金属掺杂的Fe3O4/MMT复合材料相比,其UO22+吸附性能得到了一定程度的提高。过渡金属掺杂Fe3O4得到的铁氧体与蒙脱石复合后大大提高了其比表面积及其在水溶液中的分散性,但其铀酰吸附能力依然较低。因此,开发高吸附性能的磁性吸附剂极具挑战性。
最近,掺硫材料获得了广泛关注。掺硫材料在光催化、催化/氧还原、吸附和储能技术方面表现出了优良的性能,同时还可用作金属离子捕获介质。为进一步提高吸附剂的吸附能力,已有学者对吸附剂进行了硫改性研究。ZHAO等[15]研究了硫掺杂石墨烯海绵对Cu2+的吸附,其吸附能力可达228.0 mg/g。SONG等[16]通过扫描电镜分析发现,硫掺杂的Fe3O4具有高度均匀性和高度分散性,大大减弱了磁性纳米粒子的团聚效应,从而提高了其与溶液中金属离子的亲和能力。掺硫材料的高吸附性能主要归因于硫氧化物及其高分散性产生的高比表面积[15],这使得掺硫材料表面拥有更多的活性位点用于污染物的吸附。
因此,为提高蒙脱石的UO22+吸附性能,本文制备了一种新型的硫掺杂ZnFe2O4/MMT并用于含铀废水处理。采用XRD、FTIR和SEM对所制备的复合材料的结构特征进行了表征,研究了不同pH、接触时间和铀酰初始质量浓度对S-ZnFe2O4/MMT吸附UO22+的影响,并用动力学模型和等温吸附模型对吸附过程进行了拟合。
1 材料与方法
1.1 主要仪器与试剂
X射线衍射仪(DMAX1400,Rigaku),傅里叶变换红外光谱(Spectrum ONE,PerkinElme),场发射扫描电子显微镜(UItra55,Carl Zeiss),紫外分光光度计(UV1000,Thermo Fisher Scienti-fic),六水硝酸铀酰(≥99.5%)。
1.2 实验与方法
1.2.1 硫掺杂ZnFe2O4/MMT的制备
采用水热法制备S-ZnFe2O4。首先,称取4.09 g ZnCl2和16.22 g FeCl3·6H2O,溶解于200 mL去离子水中,待搅拌溶液10 min后,超声30 min使溶液各组分混合均匀;然后用2 mol/L的NaOH逐滴加入混合溶液中,直至pH=11;将混合溶液转移至水浴锅中,于70 ℃下水浴回流4 h,待溶液自然冷却沉淀后,用去离子水和酒精各清洗3次;然后在60 ℃下真空干燥24 h,研磨后得到ZnFe2O4;随后称取1.928 g ZnFe2O4和0.968 g L-半胱氨酸溶解于100 mL超纯水中,搅拌均匀并超声30 min;用0.1 mol/L HCl将溶液pH调至4.5~5.0,随后转移至反应釜中,于160 ℃下反应6 h;洗涤后,置于鼓风干燥箱中烘干24 h,研磨即得S-ZnFe2O4。
S-ZnFe2O4/MMT的制备:称取3 g 蒙脱石备用,将1.78 g ZnCl2和7.03 g FeCl3·6H2O溶解于200 mL去离子水中,磁力搅拌10 min,使溶液混合均匀;随后加入备好的蒙脱石,继续搅拌10 min,超声30 min;用2 mol/L NaOH调节混合溶液至pH>11,然后在80 ℃下水浴回流4 h;待自然冷却至室温后,水洗、醇洗各3次,干燥研磨即得ZnFe2O4/MMT;为获得S-ZnFe2O4/MMT复合材料,在ZnFe2O4/MMT前驱体溶液中加入0.484 g L-半胱氨酸,磁力搅拌10 min并超声30 min;然后将混合溶液转移至反应釜中,于160 ℃下反应6 h;待溶液自然冷却,水洗、醇洗各3次,干燥研磨后即得S-ZnFe2O4/MMT。
1.2.2 模拟含铀废水的配制方法
称取3.72 g UO2(NO3)2·6H2O溶解于100 mL去离子水中,然后将其转移至1 000 mL容量瓶中并加去离子水稀释至刻度线,摇匀,即得质量浓度为1.0 g/L的 UO22+溶液。
取质量浓度为1.0 g/L的 UO22+溶液并用去离子水稀释至实验所需质量浓度;用0.01 mol/L的 NaOH和HCl溶液制备不同pH的UO22+溶液,得到实验模拟含铀废水。
1.2.3 吸附实验
pH影响吸附实验中,用0.1 mol/L的 NaOH和HCl调节UO22+稀释溶液至pH为3.0~8.0,UO22+稀释溶液质量浓度均为100 mg/L。动力学吸附实验中同样配制100 mg/L的 UO22+溶液,在0~12 h的接触时间内取溶液上清液测其剩余UO22+质量浓度,并通过伪一阶和伪二阶动力学模型对实验数据进行拟合。等温吸附实验采取同样的方法配制pH=4、质量浓度为5~100 mg/L的UO22+溶液。取0.025 g所制备的复合材料,加入50 mL不同pH或质量浓度的UO22+溶液,超声30 min,于25 ℃下放入恒温振荡器,在200 r/min的搅拌速度下振荡,然后通过0.45 μm尼龙微孔滤膜,得到过滤吸附后的上清液,测试其UO22+质量浓度。
S-ZnFe2O4和S-ZnFe2O4/MMT复合材料在平衡态和时刻t对UO22+的吸附量为
式中:C0为初始金属离子质量浓度,mg/L;Ce为平衡时刻溶液中金属离子的质量浓度,mg/L;V为金属离子溶液的体积,L;m为样品干质量,g。

在等温吸附实验中,用Langmuir和Freundlich吸附等温线方程分析所制备复合材料对UO22+的吸附平衡数据,从而确定吸附剂与目标离子之间的吸附平衡。
Langmuir等温吸附模型是描述溶液吸附现象的常用模型,它对含有有限个相同位点的表面单层吸附是有效的,Langmuir模型线性形式为
式中:qmax是理论最大吸附量,mg/g;KL是与吸附热相关的常数,L/mg;RL代表吸附反应进行难易程度的相关参数。当RL>1时,吸附不易发生;当RL=1时,吸附为线性过程;当0 Freundlich等温吸附模型假设吸附剂表面的活性位点在吸附分子相互作用下呈非均匀的能量分布,吸附量与目标离子的浓度有关。Freund-lich模型线性形式为 式中,KF为吸附剂相对吸附能力的常数,1/n为与吸附强度相关的参数。 1.2.4 分析测试方法 采用X射线衍射仪(XRD)对所制备材料进行物相分析,通过傅里叶变换红外光谱仪(FTIR)和拉曼光谱仪(Raman)分析复合材料的键合作用,用场发射扫描电子显微镜(FESEM)对材料表面形貌进行观察。铀酰吸附实验采用紫外分光光度计测定溶液中的铀酰含量。 水热法制得的硫掺杂ZnFe2O4(S-ZnFe2O4)和硫掺杂ZnFe2O4/MMT(S-ZnFe2O4/MMT)复合材料的XRD谱图如图1所示。 图1 S-ZnFe2O4和S-ZnFe2O4/MMT的XRD图 由图1可知,ZnFe2O4有明显的衍射峰,位置可与ZnFe2O4标准JCPDS卡片(ZnFe2O4JCPDS:22-1012)较好地吻合,29.9°、35.2°、42.8°、53.1°和62.2°处的衍射峰分别对应(220)、(311)、(400)、(422)和(440)晶面[17]。同时,在S-ZnFe2O4/MMT的XRD谱线上,6.549°、19.984°、35.004°、62.002°处为蒙脱石的特征峰,且符合蒙脱石标准JCPDS卡片(JCPDS:29-1498)[18],其中19.984°、35.004°、62.002°处的特征峰分别对应(100)、(105)、(300)晶面。特征峰的偏移可能是硫的掺杂引起的。 S-ZnFe2O4和S-ZnFe2O4/MMT的红外光谱如图2所示。 图2 S-ZnFe2O4和S-ZnFe2O4/MMT的红外光谱图 由图2可知,464、568 cm-1吸收峰为铁酸盐ZnFe2O4的特征峰,并且由于硫的掺杂,该伸缩振动峰相对于文献[19]报道值(550 cm-1/420 cm-1)发生了偏移。对于S-ZnFe2O4/MMT,在1 042 cm-1处观察到Si-O伸缩振动的特征吸收峰,位于1 637 cm-1处的特征峰为Si-O-Si的伸缩振动,523 cm-1特征吸收峰则为Si-O-Al的伸缩振动峰[20]。在3 387 ~3 633 cm-1的吸收带是由存在于蒙脱石基质中的水分子的伸缩振动造成的。结合XRD测试结果,说明成功合成了硫掺杂的ZnFe2O4以及与蒙脱石复合后的复合材料。 为研究S-ZnFe2O4和S-ZnFe2O4/MMT复合材料的表面形貌特征,对样品进行了FESEM测试,结果如图3所示。 图3 S-ZnFe2O4和S-ZnFe2O4/MMT的SEM图 由图3a可见:S-ZnFe2O4呈不规则颗粒状,其平均颗粒尺寸为20 nm;同时,S-ZnFe2O4有良好的分散性,这可能是硫的掺杂所致,但因为其纳米尺寸较小,依然不可避免地产生小范围团聚现象。由图3b可以看出,纳米颗粒S-ZnFe2O4均匀附着于蒙脱石表面,这说明S-ZnFe2O4与蒙脱石复合后大大改善了团聚现象。由此可见,本研究成功合成了无定型纳米颗粒S-ZnFe2O4均匀分布于蒙脱石表面的S-ZnFe2O4/MMT复合材料。 2.2.1 pH对吸附的影响 pH为3.0~8.0时,吸附量与溶液pH有很强的相关性(见图4)。 图4 pH对S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的影响 由图4可知,随着pH的增大,复合材料S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的吸附量逐渐增加,且在pH为6.0时达到最大值(S-ZnFe2O4:128.71 mg/g,S-ZnFe2O4/MMT:156.57 mg/g),同时S-ZnFe2O4的UO22+吸附量明显小于S-ZnFe2O4/MMT。酸性溶液中,吸附剂表面会发生质子化作用,但随着溶液pH的增加,其质子化作用减弱,溶液中H+与UO22+在吸附剂表面的竞争吸附作用减弱,静电吸引作用增强,复合材料对UO22+的吸附量增加。S-ZnFe2O4与蒙脱石复合后,大大改善了其团聚效应,获得了高比表面积的S-ZnFe2O4/MMT复合材料,蒙脱石表面高分散度的S-ZnFe2O4为溶液中游离的UO22+提供了充足的吸附位点,这也是S-ZnFe2O4/MMT拥有高UO22+吸附能力的原因。 2.2.2 吸附动力学 为了研究吸附动力学,将S-ZnFe2O4和S-ZnFe2O4/MMT复合材料的UO22+吸附量作为接触时间的函数进行评估,结果如图5所示。 图5 接触时间对S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的影响 由图5可知,吸附初始阶段,S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的吸附量迅速增加,在120 min后达到吸附饱和,且S-ZnFe2O4/MMT的吸附量大于S-ZnFe2O4。低UO22+初始质量浓度阶段,吸附剂表面的活性吸附位点充足,且高质量浓度UO22+驱使溶液中UO22+快速扩散至吸附剂表面,这些都导致了吸附量的迅速增加。随着接触时间的增加,溶液中UO22+质量浓度逐渐降低,S-ZnFe2O4和S-ZnFe2O4/MMT表面的吸附位点被大量占据,吸附达到饱和状态。 根据接触时间(t)对S-ZnFe2O4和S-ZnFe2O4/MMT影响UO22+吸附的数据,使用伪一阶和伪二阶动力学模型对动态吸附过程进行了分析,结果分别见图6a和图6b。 图6 S-ZnFe2O4和S-ZnFe2O4/MMT的伪一阶和伪二阶动力学模型拟合 S-ZnFe2O4、S-ZnFe2O4/MMT吸附UO22+的伪一阶和伪二阶动力学吸附参数见表1。由图6和表1可知,伪二阶动力学模型(R2=0.998)较伪一阶动力学模型(R2=0.985~0.986)能更好地拟合吸附实验数据,这表明S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的吸附过程为化学吸附,该吸附方式可决定吸附速率。 表1 S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的伪一阶和伪二阶动力学吸附参数 2.2.3 等温吸附曲线 图7为S-ZnFe2O4和S-ZnFe2O4/MMT复合材料对UO22+的等温吸附曲线。 图7 初始质量浓度对S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的影响 由图7可知,溶液中UO22+初始质量浓度低于40 mg/L时,随着UO22+初始质量浓度的升高,复合材料对UO22+的吸附量快速增加,之后其吸附量逐渐饱和。在低UO22+初始质量浓度范围内,复合材料表面吸附位点充足,因此其UO22+吸附量增加迅速。UO22+初始质量浓度继续升高,S-ZnFe2O4和S-ZnFe2O4/MMT表面吸附位点逐渐被UO22+占据,其吸附量达到上限,并趋于动态平衡。吸附平衡状态下,S-ZnFe2O4/MMT对UO22+的吸附量明显大于S-ZnFe2O4,Zn2+和硫对Fe3O4的掺杂减弱了其团聚性,从而提高了S-ZnFe2O4/MMT的UO22+吸附能力。 等温吸附曲线是描述平衡状态下分子在液相和固相之间分布的数学模型,其物理化学参数和基本的热力学假设为吸附机理、吸附效率、表面性质以及吸附剂的亲和程度提供了一个较为全面的解释。本文采用Langmuir和Freundlich模型描述吸附剂和UO22+之间的吸附平衡状态。S-ZnFe2O4和S-ZnFe2O4/MMT复合材料对UO22+的等温吸附曲线分别被Langmuir和Freundlich模型拟合(见图8a、图8b)。等温吸附参数计算结果见表2。由表2可知,Langmuir模型(R2=0.986~0.998)较Freundlich模型(R2=0.878~0.916)能更好地拟合复合材料对UO22+的吸附数据,同时也说明S-ZnFe2O4和S-ZnFe2O4/MMT复合材料对UO22+的吸附过程以表面单层吸附为主。S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的Langmuir最大吸附量分别为51.44 mg/g和68.45 mg/g,由此可见,与蒙脱石复合的硫掺杂ZnFe2O4复合材料进一步提高了其UO22+吸附能力。 图8 S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的Langmuir模型和Freundlich模型拟合 表2 S-ZnFe2O4和S-ZnFe2O4/MMT吸附UO22+的等温吸附参数 本研究成功合成了S-ZnFe2O4和S-ZnFe2O4/MMT复合材料,并通过批量试验研究了其对水溶液中UO22+的吸附性能,得到以下主要结论: a.吸附过程强烈依赖于溶液pH,且吸附的最佳pH为6.0。 b.动力学研究结果表明,S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的吸附曲线在初始阶段呈陡峭上升趋势,随后在120 min时达到吸附饱和状态,伪二阶动力学模型与实验数据的高拟合度说明其吸附行为主要为化学吸附。 c.等温吸附实验结果表明:S-ZnFe2O4和S-ZnFe2O4/MMT对UO22+的吸附过程遵循Langmuir模型,其最大吸附量分别为52.44 mg/g和68.45 mg/g。与蒙脱石复合后的S-ZnFe2O4更大程度地增强了其对UO22+的吸附性能,S-ZnFe2O4在蒙脱石表面的高分散性造就了S-ZnFe2O4/MMT对UO22+的高吸附能力。 d.S-ZnFe2O4/MMT为一种高效且具有高UO22+吸附性能的新型吸附剂。2 结果与讨论
2.1 硫掺杂ZnFe2O4/MMT的结构表征
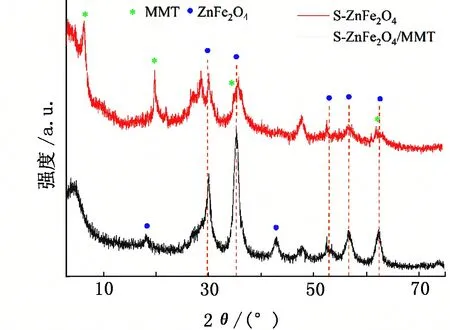


2.2 硫掺杂ZnFe2O4/MMT的UO22+吸附研究


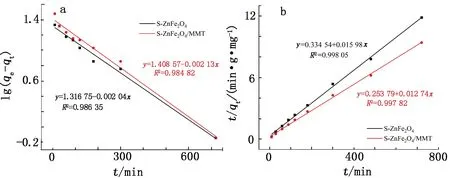
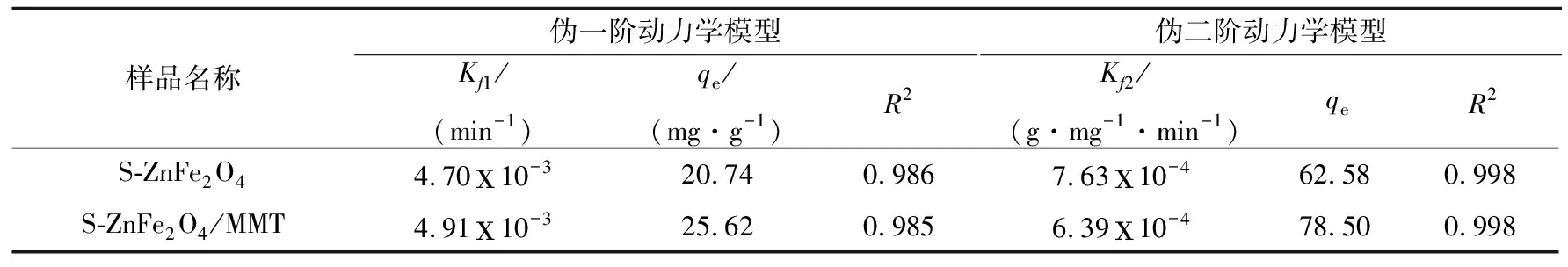



3 结论
