利用联合生物加工生产纤维素乙醇的研究进展
2021-03-22黄俊梁士劼
黄俊 梁士劼

摘要:联合生物加工(consolidated bioprocessing)是将纤维素酶的产生、纤维素酶解、糖发酵全部同时在一个反应器中完成,整个反应过程由一种微生物或微生物集合体来完成。联合生物加工具有工艺简便、成本低、效率高等优点,被广泛认为是最优的纤维素乙醇生产策略,又被称为第三代生物燃料。本文介绍构建符合联合生物加工要求菌株的2条途径,第1类联合生物加工菌株改造纤维素酶生产菌,使其能够高产乙醇;第2类联合生物加工菌株改造乙醇高产菌株,使其能够分泌纤维素酶。本文还对联合生物加工候选菌株及其优缺点做了概括,为今后研究提供了理论基础和指导方法。
关键词:纤维素;微生物;乙醇;联合生物加工;纤维素酶
中图分类号: S188文献标志码: A文章编号:1002-1302(2021)02-0018-06
收稿日期:2020-05-11
基金项目:广西自然科学基金(编号:2018GXNSFAA294035、2018GXNSFAA294118、2018GXNSFAA138111、2020GXNSFAA259021)。
作者简介:黄俊(1982—),男,广西靖西人,博士,助理研究员,主要从事纤维素乙醇研究。E-mail:jimh25@foxmail.com。纤维素是具有分布广、蕴藏量丰富、廉价等优点的可再生资源[1]。纤维素由木质素、半纤维素和纤维素3个部分组成高度结晶的聚合体,纤维素居于聚合体中心位置,外围结构则由半纤维素与木质素组成。因此,利用纤维素生产乙醇就需经过预处理环节,以瓦解纤维素结构。在此基础上,经纤维素酶酶解纤维素和半纤维素,再由微生物对葡萄糖等糖类进行发酵得到终产物乙醇[2]。
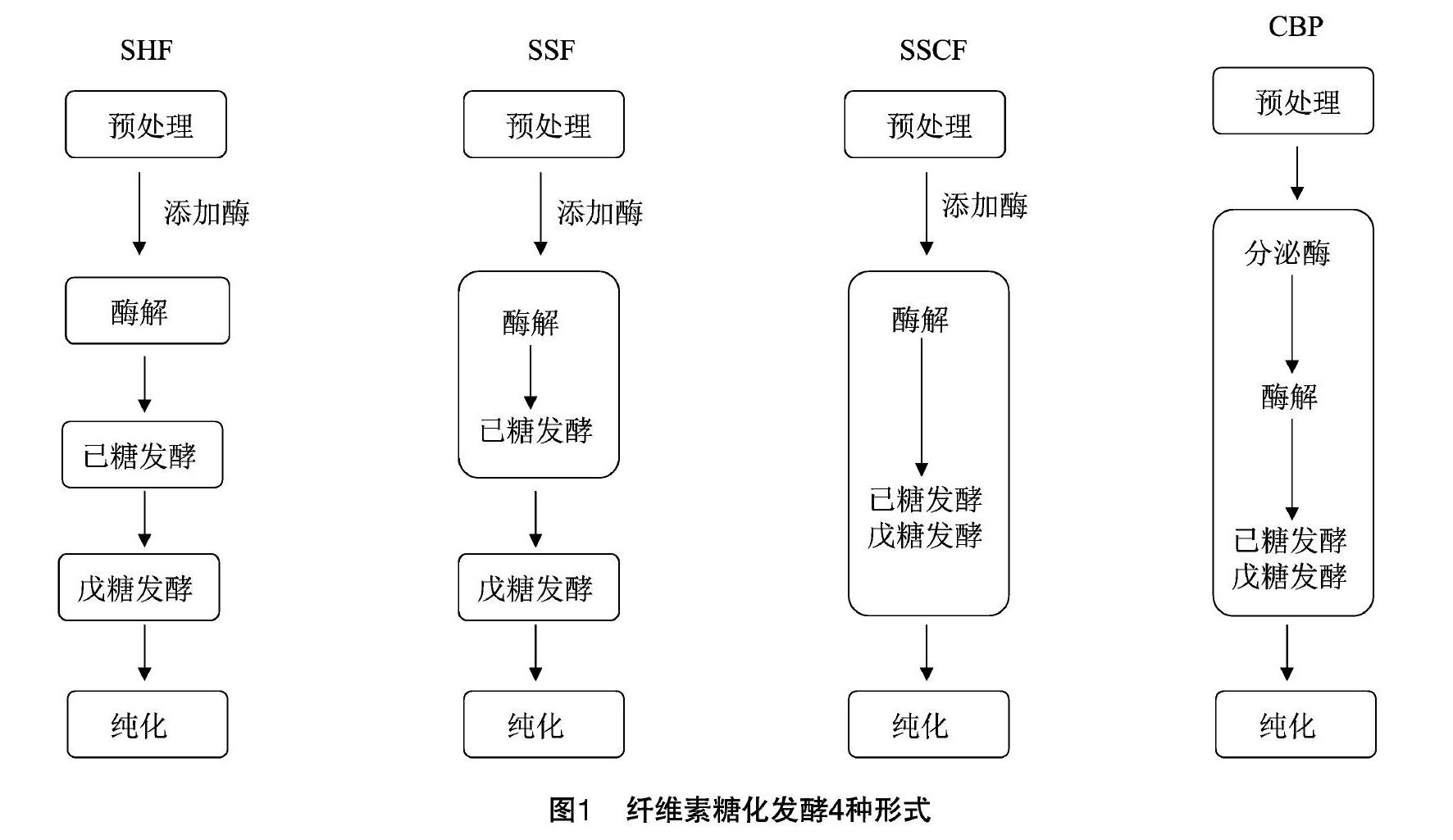
木质纤维素生产燃料乙醇的过程可分为4个部分:预处理、酶解、发酵和纯化等。在这4个主要环节中,糖化发酵环节直接关系着乙醇产量,是纤维素生产乙醇的关键步骤。已有多种技术手段先后被提出,主要分为分步糖化和发酵(separate enzymatic hydrolysis and fermentation,简称SHF)、同步糖化发酵 (simultaneous saccharification and fermentation,简称SSF)、同步糖化共发酵(simultaneous saccharification and co-fermentation,简称SSCF)、联合生物加工(consolidated bioprocessing,简称CBP)四大类[2-3](图1)。相比于前面3种技术工艺,联合生物加工(CBP)具有生产流程简单、投入少、效率高等优点,被广泛认为是最优的纤维素乙醇生产策略。本研究就联合生物加工在纤维素燃料乙醇方面的研究进行综述。
1联合生物加工与其他糖化发酵工艺的比较
前处理后的纤维素原料由纤维素酶水解生成糖,随后在另一发酵罐中进行发酵生成乙醇,这种生产工艺被称为分步糖化和发酵(SHF)[3]。这种生产工艺的优点是可以在各自最优的反应条件下进行,反应条件互不干扰。该工艺缺点在于葡萄糖等纤维素酶解产物的累积会反过来抑制纤维素酶的活性,从而导致后续酶解效率降低,终产物乙醇的产率也随之明显降低。
为消除葡萄糖等酶解产物对纤维素酶活性的反抑制作用,有科学家提出了同时糖化和发酵(SSF)过程,在一个发酵罐内同时进行酶解和发酵反应[4]。同时糖化和发酵工艺的优点是酵母等微生物直接利用酶解产物葡萄糖发酵生产乙醇,从而消除了葡萄糖和纤维二糖等酶解产物对纤维素酶的反馈抑制作用,减少反应时间,产率也得到提高,终产物乙醇的得率会更高。但是同时糖化和发酵工艺也有明显的缺点,即最佳的酶解反应条件和微生物发酵产乙醇条件不一致,特别是温度不同造成的影响最大。同步糖化共发酵(SSCF)和同时糖化和发酵(SSF)的区别在于,戊糖发酵是否在同一发酵罐中完成。
上述3种工艺的共同之处是都需要添加纤维素酶。而目前使用的纤维素酶存在活力低、价格昂贵等问题,这无疑加大了生产成本。为了压缩纤维素酶的成本,联合生物加工工艺应运而生。联合生物加工是将纤维素酶的产生、纤维素酶解、糖发酵全部同时在一个反应器中完成,整个反应过程由一种微生物或微生物集合体来完成。联合生物加工可以有效降低纤维素乙醇生产成本,是生物质转化技术进化的逻辑终点,为了和前面几种糖化发酵工艺相区别,又被称为第3代生物燃料[5]。联合生物加工面临的主要问题是开发出合适的微生物菌群。当前,适合联合生物加工的候选菌株主要有两大类:第1类联合生物加工菌株通过改造纤维素酶生产菌,使其降解纤维素后能够直接利用糖分发酵产乙醇;第2类联合生物加工菌株则是改造现有的乙醇高产菌株,使其能够分泌纤维素酶降解纤维素。
2乙醇高产菌在联合生物加工中应用
目前联合生物加工研究热点集中在乙醇高产菌,因为此类微生物具有很强的产乙醇能力以及较高的乙醇耐受性,在工业生产上已有广泛应用。发酵单胞菌(Zymomonas mobilis)、酿酒酵母(Saccharomyces cerevisiae)、管囊酵母(Pachysolen tannophilus)、树干毕赤酵母(Pichia stipitis)和休哈塔假丝酵母(Candida albicans)等微生物是第2类联合生物加工的候选菌株[6-8]。酿酒酵母基因组序列已经测通,基因改造技术成熟,且生长速率快、乙醇产量高,被认为是最具应用前景的候选菌株。改造乙醇高产菌基本策略是使菌株能够高效分泌纤维素酶。经过不懈努力,一个或多个纤维素酶基因已经在酿酒酵母中得到表达,分泌出有活性的纤维素,能在以纤维素为碳源的培养基中生长和/或产乙醇,使获得适用于联合生物加工的酿酒酵母工程菌株不再遥不可及[9]。纤维二糖水解酶(CBH)是纤维素酶系的重要组成,是水解纤维素必需的酶系之一。然而酿酒酵母异源表达纤维二糖水解酶普遍存在着分泌量低的问题。最近,Xiao等成功获得纤维二糖水解酶I(CBHI)高产的酿酒酵母重组菌株。重组后的2株酿酒酵母菌分别分泌出 716.43 U/mL 和205.13 U/mL CBHI,同时还能够利用玉米秸产酒精[10]。要提高纤维素降解效率,需要有多个纤维素酶协同表达。van Rensburg 等首次報道在酿酒酵母中表达由内孢霉酵母(Endomyces fibuliger)β-葡糖苷酶1(BGL1)、溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)END1、黄孢原毛平革菌(Phanerochaete chrysosporium)CBH1和生黄瘤胃球菌(Ruminococcus flavefaciens)内切葡聚糖酶1(CEL1)组成的纤维素酶系,重组酵母菌能降解羧甲基纤维素等多种底物[11]。现在已有越来越多的研究结果表明多纤维素酶基因可以在在酿酒酵母中异源表达,并适合应用于联合生物加工[12-13]。
随着细胞表面展示技术的发展,已有科研人员利用这一技术将纤维素酶展示在酵母细胞表面以达到降解纤维素的目的[14-16]。Tsai等选取来自热纤梭菌(Clostridium thermocellum)的内切葡聚糖酶和解纤维梭菌(Clostridium cellulolyticum)的内切葡聚糖酶和外切葡聚糖酶组成一个全新的纤维小体,并重组到酵母细胞上[17]。为进一步提高纤维小体水解纤维素能力,他们又用β-葡糖苷酶取代原先来自解纤维梭菌的内切葡聚糖酶。该重组酵母可利用无定形纤维素产生出3.5 g/L的乙醇,是理论值的95%。
虽然酿酒酵母的改造取得不少成果,可要达到纤维素乙醇工业化生产这一目标,还须解决诸多难点:纤维素酶蛋白不能正确折叠或修饰;多个异源基因的共表达对酵母细胞生理活动产生不利影响;异源基因如何协同表达等[6]。另外,酿酒酵母等微生物不能利用戊糖产乙醇也是亟需解决的难题。已有报道发现经基因改造过的酿酒酵母重组菌株可以利用戊糖,但乙醇产量仍然相对较低[18]。
3产纤维素酶菌在联合生物加工中的应用
3.1产纤维素酶真菌在联合生物加工中的应用
自然界中的一些真菌,如曲霉属(Aspergilli)、木霉菌(Trichoderma)等,不但具有水解纤维素的能力,对酸、醛等耐受能力强,同时能将木质纤维素转化为乙醇[19]。这些真菌微生物普遍被认为包含有2个生物代谢系统,一个代谢系统产生纤维素酶,在有氧条件下将纤维素降解成已糖和戊糖;另一个代谢系统在厌氧条件下利用已糖和戊糖生产乙醇和其他副产物,如乙酸[20]。
木霉属(Trichoderma)以里氏木霉为代表,其拥有一系列完备的纤维素酶,是当前商业化最为成功的纤维素酶生产菌株[21]。其生产的纤维素酶具有稳定性好、酶活性高、产量高等优点。凭借这些优势,里氏木霉成为颇具潜力的联合生物加工候选菌株。Stevenson等从牛粪中分离得到一株木霉菌株,他们发现该菌株能利用葡萄糖和木糖等多种糖发酵生产乙醇,也可以利用纤维素生产乙醇。通过优化发酵条件,该菌株利用葡萄糖的乙醇产率增加了12.5倍(从0.4 g/L升到5 g/L)[22]。Xu等将里氏木霉应用于联合生物过程做了深入研究[6]。该研究小组发现里氏木霉比其他丝状真菌可以产生更高的纤维素乙醇。然而,在可溶性糖(葡萄糖和木糖)方面,里氏木霉是比其他真菌的低。里氏木霉能够产生出更多纤维素乙醇可能正是因为其拥有优异的纤维素酶系。本课题组先对里氏木霉进行诱变处理,筛选到一株乙醇产量得到提高的突变菌株,再将该突变菌株与酿酒酵母进行基因组重排,得到一株乙醇产量和乙醇耐受性都有提高的重组菌株,使里氏木霉应用于联合生物加工更有前景[23]。
镰孢属(Fusarium)和其他产纤维素酶真菌的最大区别是其耐受能力强。尤其是轮状镰刀霉菌(Fusarium verticillioides)对葡萄糖、乙醇和乙酸的耐受性都很强[24]。当乙醇浓度达到4.5%~5.0%时,轮状镰刀霉菌仍然可以发酵葡萄糖产乙醇。乙酸是微生物在乙醇发酵过程中产生的主要抑制剂,但轮状镰刀霉菌可以将乙酸还原为乙醇,从而抵消抑制。因此,轮状镰刀霉菌也是联合生物加工备受瞩目的候选菌株。轮状镰刀霉菌利用葡萄糖、木糖以及葡萄糖和木糖的混合糖发酵产乙醇,乙醇产率分別为0.47、0.46、0.50 g/g[25]。目前,以未经预处理过的纤维素为碳源获得乙醇量最高的真菌就是轮状镰刀霉菌,产量达到80 mg/g[24]。经碱预处理过的麦秆为碳源时,轮状镰刀霉菌的乙醇产量更是达到326 mg/g,为理论值的80.2%[26]。利用经碱液蒸煮过的甘蔗渣为碳源,轮状镰刀霉菌能发酵出46 g/L 乙醇 [25]。轮状镰刀霉菌的缺点在于生长速度慢。虽然已有报道在过表达磷酸葡萄糖醛酸酶(phosphoglucomutase)和醛糖转移酶(transaldolase)时可以提高轮状镰刀霉菌生长速度,但离联合生物加工的要求还有一定距离[27]。
白腐类真菌可以产生多种纤维素酶,同时产乙醇能力也很强。以毛柄金钱菌(Flammulina velutipes)为代表,其利用葡萄糖发酵产乙醇可以到达理论值的88%,尤其是其利用蔗糖发酵产乙醇的能力也跟葡萄糖一样高[28]。毛柄金钱菌基因组测序结果显示其基因组内含有58个乙醇脱氢酶基因,这是其乙醇发酵能力强的一个重要原因[29]。毛柄金钱菌对乙醇的耐受度也很强,最高可以耐受 120 g/L 乙醇。其他白腐类真菌如香栓菌(Trametes suaveolens)、变色栓菌(Trametes versicolor)等也可以利用糖和纤维素产酒精[30]。
曲霉属(Aspergilli)有完善的纤维素酶系,可以将纤维素有效水解成糖,并能将这些糖转化为乙醇,其最大特点是利用木糖能力较强。米曲霉(Aspergilli oryzae)利用葡萄糖产乙醇能力最强,米曲霉NRRL 694利用葡萄糖(50 g/L)发酵产乙醇的最高值可以达到24.4 g/L,已经非常接近理论值。该菌利用木糖(50 g/L)产乙醇的量可达4.7 g/L,为理论值的22%[31]。酱油曲霉(Aspergilli tamari)利用葡萄糖产乙醇的能力仅次于米曲霉,酱油曲霉NRRL 429的乙醇产量最高可达18.6 g/L,但是利用木糖的能力弱于米曲霉[31]。曲霉属中利用木糖能力最强的是大豆曲霉NRRL5597(Aspergilli sojae),乙醇产量最高为5.4 g/L[31]。曲霉菌作为联合生物加工菌株的主要局限性在于副产物有机酸对发酵有抑制作用[32]。
除了上述这些真菌,粗糙脉孢菌(Neurospora crassa)、多变拟青霉(Paecilomyces variotii)、米根霉(Rhizopus oryzae)等真菌也被用于联合生物加工研究[33-36]。米根霉具有发酵戊糖、易生长、对抑制剂有高耐受性等优点,成为CBP 潜在候选菌株。但米根霉在发酵过程中也会产出过多的副产物乳酸等问题[37]。各种真菌利用纤维素生产乙醇能力见表1。
3.2梭菌在联合生物加工中的应用
梭菌是一种革兰氏阳性,可生成瓶状内生孢子的厌氧细菌。研究发现有数种梭菌具有将生物质转化为乙醇和有机酸的优良特性。这其中最具研究前景的当属热纤维梭菌(Clostridium thermocellum)[38]。这种梭菌以纤维小体这种特殊的形式分泌纤维素酶,纤维小体是一种多功能、多酶类由支架组装而成的复合物,能够跟纤维素酶一样有效降解纤维素。水解纤维素后生成的丙酮酸在热纤维梭菌中有2个主要的分解代谢通路,一条代谢通路的总产物是乙醇,另一条则是氢气和有机酸。而正因为有机酸的存在抑制了乙醇的生成,即使是在最优发酵条件下,热纤维梭菌的乙醇产量仅勉强达到理论值的一半。因此对热纤维梭菌的研究热点就在于阻断有机酸和氢气的代谢通路,从而提高乙醇的产量。Rydzak等敲除丙酮酸甲酸裂解酶(pyruvate formate lyase,pflB)和丙酮酸甲酸裂解酶激活因子(PFL-activating enzyme,简称pflA)极大地减少了有机酸的生成[39]。Biswas等通过敲除乳酸脱氢酶(lactate dehydrogenase,简称ldh),使热纤维梭菌的乙醇产量提高了30%,并且提高了乙醇耐受性[40]。Papanek等则敲除了所有的其他代谢支路的基因,构建出基因工程菌AG553[41]。该工程菌可以利用微晶纤维素(60 g/L)生成乙醇(22.4 g/L),乙醇产率(0.39 getha/ggluc)达到了理论值的75%。如果将氨基酸的生成代谢通路切断还有望进一步提高乙醇产率。
3.3杆菌在联合生物加工中的应用
杆菌属(Thermoanaerobacterium)含有一类嗜热、可水解半纤维素的专性厌氧菌。这类菌以厌氧嗜热杆菌(T. saccharolyticum)为代表,可以分泌出水解半纤维素所必需的木聚糖酶,并可以利用半纤维素水解产物:如木聚糖、木糖和阿拉伯糖。Herring等通过敲除胞外多糖合成基因和调控因子perR,再导入磷酸转乙酰酶和乙酸激酶改造出厌氧嗜热杆菌M2886[42]。厌氧嗜热杆菌M2886可以同时利用纤维二糖和麦芽糊精混合发酵液发酵产乙醇,乙醇产量最高可到70 g/L。在含有微晶纤维素、葡萄糖、木糖和乙酸的混合培养基中,M2886可以产出61 g/L的乙醇,达到理论值的92%。在添加热纤维梭菌纤维小体的条件下,M2886还可以分别利用纤维素和半纤维素发酵生产出31 g/L和26 g/L的乙醇。
3.4芽孢杆菌在联合生物加工中的应用
热葡糖苷酶地芽孢杆菌(Geobacillus thermoglucosidasiu)是一种嗜热、革兰氏阳性、兼性厌氧菌,已发现其能在65 ℃的高温下产生乙醇(体积分数可达10%),并且可以直接利用稻草水解糖(主要成分是葡萄糖和木糖)发酵产乙醇[42]。虽然杆菌(Geobacillus spp.)不能降解结晶纤维素,却可以通过将半纤维素降解成寡糖,并通过特有的寡糖转运系统转运至胞内消化,从而有效地降解半纤维素。因此杆菌属可以利用葡聚糖、木聚糖和阿拉伯聚糖等寡糖分子作为碳源。通过敲除乳酸脱氢酶和丙酮酸甲酸酯裂解酶途径,并上调丙酮酸脱氢酶的表达,使其乙醇发酵能力得到进一步提升[43-44]。
3.5产纤维素酶菌在联合生物加工中的优势和劣势
产纤维素酶菌在联合生物過程中的优势:(1)生长时不需要厌氧条件,易于扩大培养;(2)其纤维素酶分泌和降解纤维素机制已有深入了解;(3)存在着能够利用已糖和戊糖转化成乙醇的代谢途径。然而产纤维素酶菌在联合生物过程中也存在着不足:(1)乙醇产量和转化率都较低;(2)乙醇耐受性低;(3)对于专性好氧的真菌,在厌氧发酵条件下会抑制细胞生长,乙醇产量会逐步降低[45]。
4展望
为应对气候变化等问题,各国都在大力发展清洁能源。使用纤维素为原料生产燃料乙醇或其他化工产品具有很好的发展前景。燃料乙醇的发展仍有许多难题需要解决,降低生产成本是亟待解决的难题之一。联合生物过程由于其生产流程的高度整合,可以有效降低成本,迎合了可再生能源发展的趋势。这项工艺的难点在于研发出满足联合生物过程需求的微生物。为解决这一难题,科研人员借助合成生物学、蛋白质组学的发展,开发出新的催化效率更高的新纤维素酶并应用于联合生物过程菌株的构建;同时深入了解微生物代谢机理,切断副产物代谢途径,从而提高乙醇产量、减少副产物的产生。随着对微生物发酵机理的了解,人们必将攻克联合生物加工技术存在的难题。
参考文献:
[1]孙曼钰,彭太兵,何士成,等. 联合生物加工木质纤维素生产生物乙醇的研究进展[J]. 江苏农业科学,2018,46(8):5-10.
[2]李心利,朱玉红,汪保卫,等. 一体化生物加工过程生产乙醇的研究进展[J]. 化工进展,2016,35(11):3600-3610.
[3]Hahn-Hgerdal B,Galbe M,Gorwa-Grauslund M F,et al. Bio-ethanol—The fuel of tomorrow from the residues of today[J]. Trends in Biotechnology,2006,24(12):549-556.
[4]Olofsson K,Bertilsson M,Lidén G. A short review on SSF—An interesting process option for ethanol production from lignocellulosic feedstocks[J]. Biotechnology for Biofuels,2008,1(1):7.
[5]Carere C R,Sparling R,Cicek N,et al. Third generation biofuels via direct cellulose fermentation[J]. International Journal of Molecular Sciences,2008,9(7):1342-1360.
[6]Xu Q,Singh A,Himmel M E. Perspectives and new directions for the production of bioethanol using consolidated bioprocessing of lignocellulose[J]. Current Opinion in Biotechnology,2009,20(3):364-371.
[7]吴仁智,陈东,芦志龙,等. 发酵木糖高产乙醇树干毕赤酵母菌株的Co60诱变选育[J]. 广西科学,2014,21(1):47-53.
[8]陆琦,张穗生,吴仁智,等. 三株甘蔗糖蜜酒精发酵高产酵母菌株的筛选[J]. 广西科学,2010,17(4):368-372,376.
[9]Oh E J,Jin Y S. Engineering of Saccharomyces cerevisiae for efficient fermentation of cellulose[J]. FEMS Yeast Research,2020,20(1):foz089.
[10]Xiao W,Li H,Xia W,et al. Co-expression of cellulase and xylanase genes in Sacchromyces cerevisiae toward enhanced bioethanol production from corn stover[J]. Bioengineered,2019,10(1):513-521.
[11]van Rensburg P,van Zyl W H,Pretorius I S . Engineering yeast for efficient cellulose degradation[J]. Yeast,2010,14(1):67-76.
[12]Amoah J,Ishizue N,Ishizaki M,et al. Development and evaluation of consolidated bioprocessing yeast for ethanol production from ionic liquid-pretreated bagasse[J]. Bioresource Technology,2017,245:1413-1420.
[13]Davison S,Keller N T,van Zyl W H,et al. Improved cellulase expression in diploid yeast strains enhanced consolidated bioprocessing of pretreated corn residues[J]. Enzyme and Microbial Technology,2019,131:109382.
[14]Valenzuela-Ortega M,French C E. Engineering of industrially important microorganisms for assimilation of cellulosic biomass:towards consolidated bioprocessing[J]. Biochemical Society Transactions,2019,47(6):1781-1794.
[15]Hu B B,Zhu M J. Reconstitution of cellulosome:research progress and its application in biorefinery[J]. Biotechnology and Applied Biochemistry,2019,66(5):720-730.
[16]黃俊,陈东,黄日波. 纤维小体在燃料乙醇中的应用[J]. 中国生物工程杂志,2011,31(1):103-108.
[17]Tsai S L,Oh J,Singh S,et al. Functional assembly of minicellulosomes on the Saccharomyces cerevisiae cell surface for cellulose hydrolysis and ethanol production[J]. Applied and Environmental Microbiology,2009,75(19):6087-6093.
[18]Cunha J T,Soares P,Romaní A,et al. Xylose fermentation efficiency of industrial Saccharomyces cerevisiae yeast with separate or combined xylose reductase/xylitol dehydrogenase and xylose isomerase pathways[J]. Biotechnology for Biofuels,2019,12(1):20.
[19]Salehi J G,Taherzadeh M J. Advances in consolidated bioprocessing systems for bioethanol and butanol production from biomass:a comprehensive review[J]. Biofuel Research Journal,2015,2(1):152-195.
[20]Amore A,Faraco V. Potential of fungi as category Ⅰ Consolidated BioProcessing organisms for cellulosic ethanol production[J]. Renewable and Sustainable Energy Reviews,2012,16(5):3286-3301.
[21]吳仁智,黄俊,芦志龙,等. 里氏木霉和黑曲霉产酸性木聚糖酶及酶学特性比较[J]. 广西科学,2017,24(1):112-119.
[22]Stevenson D M,Weimer P J. Isolation and characterization of a Trichoderma strain capable of fermenting cellulose to ethanol[J]. Applied Microbiology and Biotechnology,2002,59(6):721-726.
[23]Huang J,Wu R,Chen D,et al. Transcriptional profiling of the Trichoderma reesei recombinant strain HJ48 by RNA-Seq[J]. Journal of Microbiology and Biotechnology,2016,26(7):1242-1251.
[24]Ali S S,Nugent B,Mullins E,et al. Fungal-mediated consolidated bioprocessing:the potential of Fusarium oxysporum for the lignocellulosic ethanol industry[J]. AMB Express,2016,6(1):13.
[25]De Almeida M N,Guimares V M,Falkoski D L,et al. Direct ethanol production from glucose,xylose and sugarcane bagasse by the corn endophytic fungi Fusarium verticillioides and Acremonium zeae[J]. Journal of Biotechnology,2013,168(1):71-77.
[26]Ali S S,Khan M,Mullins E,et al. Exploiting the inter-strain divergence of Fusarium oxysporum for microbial bioprocessing of lignocellulose to bioethanol[J]. AMB Express,2012,2(1):16.
[27]Anasontzis G E,Christakopoulos P. Challenges in ethanol production with Fusarium oxysporum through consolidated bioprocessing[J]. Bioengineered,2014,5(6):393-395.
[28]Maehara T,Ichinose H,Furukawa T,et al. Ethanol production from high cellulose concentration by the basidiomycete fungus Flammulina velutipes[J]. Fungal Biology,2013,117(3):220-226.
[29]Park Y J,Baek J H,Lee S,et al. Whole genome and global gene expression analyses of the model mushroom Flammulina velutipes reveal a high capacity for lignocellulose degradation[J]. PLoS One,2014,9(4):e93560.
[30]Okamoto K,Uchii A,Kanawaku R,et al. Bioconversion of xylose,hexoses and biomass to ethanol by a new isolate of the white rot basidiomycete Trametes versicolor[J]. Springer Plus,2014,3(3):121.
[31]Skory C D,Freer S N,Bothast R J. Screening for ethanol-producing filamentous fungi[J]. Biotechnology Letters,1997,19(3):203-206.
[32]Polizeli M,Vici A C,Scarcella A S A,et al. Enzyme system from aspergillus in current industrial uses and future applications in the production of second-generation ethanol[M]//New and Future Developments in Microbial Biotechnology and Bioengineering. Elsevier,2016.
[33]Dogaris I,Mamma D,Kekos D. Biotechnological production of ethanol from renewable resources by Neurospora crassa:an alternative to conventional yeast fermentations?[J]. Applied Microbiology and Biotechnology,2013,97(4):1457-1473.
[34]Zerva A,Savvides A L,Katsifas E A,et al. Evaluation of Paecilomyces variotii potential in bioethanol production from lignocellulose through consolidated bioprocessing[J]. Bioresource Technology,2014,162:294-299.
[35]Karimi K,Emtiazi G,Taherzadeh M J. Ethanol production from dilute-acid pretreated rice straw by simultaneous saccharification and fermentation with Mucor indicus,Rhizopus oryzae,and Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology,2006,40(1):138-144.
[36]Liu H,Sun J,Chang J S,et al. Engineering microbes for direct fermentation of cellulose to bioethanol[J]. Critical Reviews in Biotechnology,2018,38(7):1089-1105.
[37]孫小龙,付永前. 米根霉复合诱变筛选高产L-乳酸的形态突变菌株及碳代谢流分析[J]. 江苏农业科学,2019,47(1):294-299.
[38]Dash S,Olson D G,Joshua C S,et al. Thermodynamic analysis of the pathway for ethanol production from cellobiose in Clostridium thermocellum[J]. Metabolic Engineering,2019,55:161-169.
[39]Rydzak T,Lynd L R,Guss A M. Elimination of formate production in Clostridium thermocellum[J]. Journal of Industrial Microbiology & Biotechnology,2015,42(9):1263-1272.
[40]Biswas R,Prabhu S,Lynd L R,et al. Increase in ethanol yield via elimination of lactate production in an ethanol-tolerant mutant of Clostridium thermocellum[J]. PLoS One,2014,9(2):e86389.
[41]Papanek B,Biswas R,Rydzak T,et al. Elimination of metabolic pathways to all traditional fermentation products increases ethanol yields in Clostridium thermocellum[J]. Metabolic Engineering,2015,32:49-54.
[42]Herring C D,Kenealy W R,Joe S A,et al. Strain and bioprocess improvement of a thermophilic anaerobe for the production of ethanol from wood[J]. Biotechnology for Biofuels,2016,9(1):125.
[43]Bashir Z,Sheng L,Anil A,et al. Engineering Geobacillus thermoglucosidasius for direct utilisation of holocellulose from wheat straw[J]. Biotechnology for Biofuels,2019,12(1):199.
[44]Zhou J,Wu K,Rao C V. Evolutionary engineering of Geobacillus thermoglucosidasius for improved ethanol production[J]. Biotechnology and Bioengineering,2016,113(10):2156-2167.
[45]Bonaccorsi E D,Ferreira A J,Chambergo F S,et al. Transcriptional response of the obligatory aerobe Trichoderma reesei to hypoxia and transient anoxia:implications for energy production and survival in the absence of oxygen[J]. Biochemistry,2006,45(12):3912-3924.张伟,余方伟,李建斌,等. 甘蓝蔗糖合成酶基因家族鉴定及响应低温胁迫表达模式分析[J]. 江苏农业科学,2021,49(2):24-32.
