新西兰兔RBM4基因的克隆、序列分析及组织表达
2021-03-22魏后军胡波陈萌萌范志宇宋艳华仇汝龙朱伟峰王芳
魏后军 胡波 陈萌萌 范志宇 宋艳华 仇汝龙 朱伟峰 王芳

摘要:为分析RBM4基因在新西兰兔不同组织的表达差异情况,本研究根据GenBank中公布的穴兔RBM4基因序列设计了特异性引物,从兔肾脏中扩增出RBM4基因并进行了生物信息学分析,同时采用实时荧光定量PCR技术研究了RBM4基因在新西兰兔各组织中的表达差异。结果表明,扩增出的新西兰兔RBM4基因长度为1 080 bp,编码359个氨基酸。序列比对结果显示,新西兰兔与穴兔、牛、鼠、人、鲑鱼等动物RBM4基因的核苷酸一致性为44.1%~99.8%。进化树分析结果表明,新西兰兔RBM4基因与其他哺乳动物RBM4基因亲缘关系较近。实时荧光定量PCR结果显示,RBM4基因在新西兰兔的心脏、肝脏、脾脏、肺脏、肾脏和脑中均有表达,其中在肾脏中表达量最高,在脑中表达量最低。本研究成功克隆了新西兰兔RBM4基因,并研究了其mRNA在兔各组织中的表达情况,为研究兔RBM4基因的表达及其生物学功能奠定了基础。
关键词:RBM4基因;克隆;序列分析;表达;新西兰兔
中图分类号: S852.2文献标志码: A文章编号:1002-1302(2021)02-0033-04
收稿日期:2020-11-09
基金项目:现代农业产业技术体系建设专项(编号:CARS-43-C-1)。
作者简介:魏后军(1986—),男,江苏南京人,硕士,助理研究员,主要从事家兔疾病防治与兽医生物技术研究。E-mail:whj280941235@126.com。
通信作者:王芳,博士,研究员,主要从事家兔重要疫病致病机制及防控技术研究。E-mail:rwangfang@126.com。
RNA结合基序蛋白4(RNA binding motif protein4,RBM4)是一种多功能RNA结合蛋白,参与多种转录后调控过程,包括前体mRNA(pre-mRNA)的选择性剪接、翻译控制等[1]。人RBM4含有364个氨基酸,分子大小约40 ku,N端含有2个RNA识别基序(RNA recognition motifs,RRMs)和1个CCHC型锌指结构,RRMs是结合RNA的主要位点;C端有3个富含丙氨酸的延伸,具有RBM4的细胞定位及与其他蛋白质互作的作用[2]。研究发现,RBM4可以在果蝇中调控昼夜规律[3];能促进人的肌细胞[4]、胰腺细胞[5]、神经元细胞[6]、棕色脂肪细胞[7]分化;目前,RBM4的研究主要集中在細胞凋亡、增殖,以及炎症反应等方面[8-10]。兔作为一种重要的试验动物,其RBM4基因的相关研究尚未开展。本试验以新西兰兔为研究对象,克隆RBM4基因并进行分析,以期为研究兔RBM4基因的表达及其生物学功能和在相关疾病中的作用奠定基础。
1材料与方法
1.1试验时间与地点
试验于2020年10月12—23日在江苏省农业科学院兽医研究所完成。
1.2主要试剂
RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、TB GreenTM Premix Ex TaqTMⅡ、核酸凝胶回收试剂盒,均购自TaKaRa公司;DEPC水,购自索莱宝公司;DNA Marker DL2000、2×Phanta Max Master Mix (Dye Plus)、Universal Ligation Mix试剂盒、Escherichia coli DH5α感受态细胞,均购自南京诺唯赞生物科技股份有限公司;其他试剂均为国产分析纯。
1.3试验动物及样品采集
2月龄新西兰兔2只,购自江苏省明天农牧科技有限公司,耳静脉空气针处死后,分别采集心脏、肝脏、脾脏、肺脏、肾脏、脑等组织,置于-80 ℃保存。
1.4引物设计
根据GenBank上公布的穴兔RBM4基因序列(NO. AF233063),利用Primer 5.0软件设计用于扩增新西兰兔RBM4基因的特异性引物(表1),由南京擎科生物科技有限公司合成。
1.5RNA的提取及cDNA的合成
使用RNAiso Plus提取新西兰兔心脏、 肝脏、脾表1引物信息
基因引物序列(5′→3′)片段大小
(bp)RBM4F:ATGGTGAAGCTGTTCATCGGAAAC;R:CCGCAATTATCCTACCTCCAGTT1 104RBM4(qPCR)F:AGATCCGCTCGCTGTTCGA;R:AAGCCTTGCTCTTGTTCTTGCTG180GAPDHF:GAATCCACTGGCGTCTTCAC;R:CGTTGCTGACAATCTTGAGAGA160
脏、肺脏、肾脏和脑组织悬液的总RNA,以PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒进行基因组DNA的去除和cDNA的合成。反转录反应条件:37 ℃反应15 min,85 ℃反应5 s,4 ℃保存备用。
1.6聚合酶链式反应(PCR)
以新西兰兔肝脏提取的cDNA为模板进行PCR。反应体系:cDNA 4 μL,2×Phanta Max Master Mix (Dye Plus) 25 μL,10 μmol/L上、下游引物各 2 μL,加ddH2O 至总体积50 μL。反应条件:95 ℃ 3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。反应结束后于1.0%琼脂糖凝胶电泳中检测,120 V,40 min,紫外灯下观察结果。
1.7目的片段克隆及测序
采用核酸凝胶回收试剂盒回收并纯化PCR产物,利用Universal Ligation Mix试剂盒将目的片段克隆入载体,转化E. coli DH5α感受态细胞,在含氨苄的LB固体培养基中培养过夜,挑选单菌落,经PCR鉴定后,挑选3个阳性克隆送至南京擎科生物科技有限公司测序。
1.8生物信息学分析
对测序结果以DNAStar程序进行同源性分析,并采用MEGA 7软件构建系统发育树。
1.9荧光定量PCR(qPCR)检测
以2只新西兰兔不同组织提取的cDNA为模板,兔GAPDH基因為内参基因,按ABI Q1 PCR仪的反应体系和条件进行实时荧光定量PCR检测。反应体系:TB GreenTM Premix Ex Taq 10 μL,10 μmol/L 上、下游引物各0.8 μL,cDNA模板 2 μL,加ddH2O至总体积20 μL。扩增程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40个循环,反应结束后确认扩增曲线和熔解曲线。每个样品进行3次重复,使用相对定量的方法,采用2-ΔΔCT算法,计算RBM4在兔不同组织中的相对表达量。
1.10统计与分析
使用GraphPad Prism 5软件进行数据统计和分析,采用单因素方差分析(One-way ANOVA)进行显著性分析。
2结果与分析
2.1RBM4基因的扩增
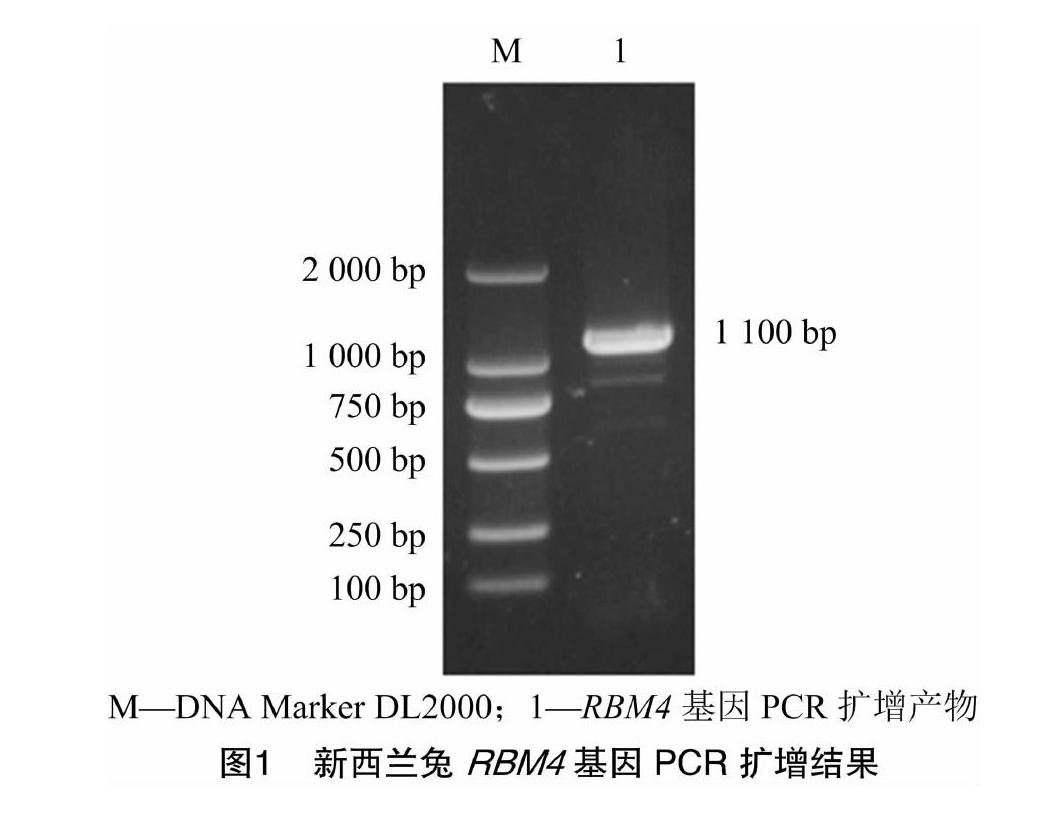
以新西兰兔肾脏总RNA反转录得到的cDNA为模板,进行RBM4基因的PCR扩增。结果显示,获得大小约1 100 bp的预期条带(图1)。经回收纯化并与载体连接后,挑取阳性菌落进行测序,测序结果上传GenBank数据库(NO. MW196263)。
2.2RBM4基因序列
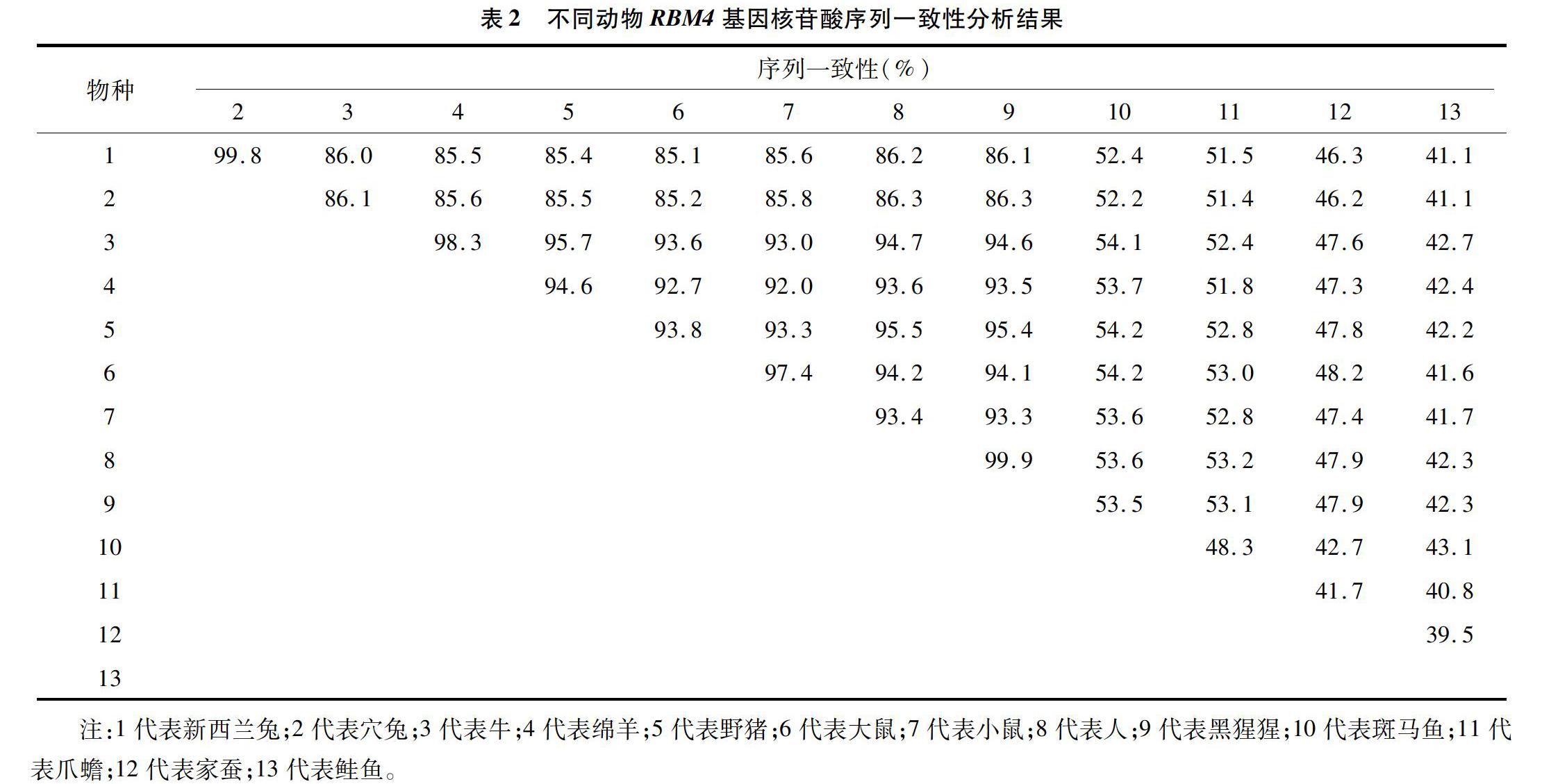
以DNAStar程序对克隆的RBM4基因序列进行分析,结果显示,新西兰兔RBM4基因全长 1 080 bp,编码359个氨基酸。与GenBank上报道的穴兔、牛、鼠、人、鲑鱼等各种属动物RBM4基因的核苷酸一致性在41.1%~99.8%之间(表2),氨基酸一致性在29.8%~100%之间。
2.3RBM4基因遗传进化
使用MEGA 7软件对新西兰兔、穴兔、人、牛、鼠、斑马鱼等的RBM4基因核苷酸序列进行遗传进化分析,结果显示,新西兰兔与穴兔、人、黑猩猩、牛、绵羊、野猪、鼠等哺乳动物的亲缘关系较近,并位于同一个大的分支,与爪蟾、斑马鱼、家蚕、鲑鱼等的亲缘关系较远(图2)。
2.4RBM4基因在新西兰兔各组织中的表达
以检测兔RBM4基因的特异性引物对新西兰兔各组织的cDNA进行实时荧光定量PCR检测,结果显示,RBM4和GAPDH的熔解曲线为单峰,特异性良好(图3)。RBM4 mRNA在兔心脏、肝脏、脾脏、肺脏、肾脏、脑中均可检测到,其中在肾脏中表达量最高,在脑中表达量最低。经GraphPad Prism 5软件进行单因素方差分析表明,RBM4基因在脑中的表达水平与在心脏和肺脏中的表达水平存在显著性差异(P<0.05);在脾脏、肾脏中的表达水平与脑中的表达水平之间存在极显著性差异(P<0.01)(图4)。
3讨论
pre-RNA的选择性剪接是形成蛋白多样性的重要原因[11]。通过不同的mRNA的剪接异构体,编码具有不同生物学功能的蛋白质;选择性剪接因子分别在细胞、个体发育的不同阶段、不同组织及不同生理、病理条件下,参与多种信号传导、转录因子的表达、细胞凋亡等关键生理过程[12-13]。对选择性剪接因子的研究有助于我们更深入地了解基因表达的方式、蛋白质的功能及疾病的发生发展。
本研究首次通过PCR方法获得了新西兰兔RBM4基因,大小为1 080 bp。通过对新西兰兔RBM4基因的序列分析,发现其与穴兔、牛、鼠、人等哺乳动物RBM4基因的一致性均高于80%,而与爪蟾、斑马鱼、家蚕、鲑鱼等的一致性均低于60%。研究结果表明,在哺乳动物中,RBM4在进化过程中高度保守。随后应用实时荧光定量PCR技术检测了RBM4基因在新西兰兔不同组织中mRNA的表达情况,结果发现RBM4基因在新西兰兔不同组织中的表达存在一定差异,其在脾脏和肾脏中表达量较高,在脑和肝脏中表达量较低,这与RBM4基因在人的组织中表达情况类似[14]。
本研究克隆了新西兰兔RBM4基因,对其进行了生物信息学分析,并研究了其在新西兰兔各组织中的表达差异,为以新西兰兔作为研究对象或模型动物的RBM4相关研究奠定了基础。
参考文献:
[1]Markus M,Morris B J. RBM4:a multifunctional RNA-binding protein[J]. The International Journal of Biochemistry and Cell Biology,2009,41(4):740-743.
[2]Markus M,Morris B J. Lark is the splicing factor RBM4 and exhibits unique subnuclear localization properties[J]. DNA and Cell Biology,2006,25(8):457-464.
[3]Huang Y,Genova G,Roberts M,et al. The LARK RNA-binding protein selectively regulates the circadian eclosion rhythm by controlling E74 protein expression[J]. PLoS One,2007,2(10):e1107.
[4]Lin J C,Tarn W Y. RBM4 down-regulates PTB and antagonizes its activity in muscle cell-specific alternative splicing[J]. The Journal of Cell Biology,2011,193(3):509-520.
[5]Lin J C,Yan Y T,Hsieh W K,et al. RBM4 promotes pancreas cell differentiation and insulin expression[J]. Molecular and Cellular Biology,2013,33(2):319-327.
[6]Tarn W Y,Kuo H C,Yu H I,et al. RBM4 promotes neuronal differentiation and neurite outgrowth by modulating Numb isoform expression[J]. Molecular Biology of the Cell,2016,27(10):1676-1683.
[7]Lin J C,Tarn W Y,Hsieh W K. Emerging role for RNA binding motif protein 4 in the development of brown adipocytes[J]. Biochimica et Biophysica Acta,2014,1843(4):769-779.
[8]Wang W Y,Quan W,Yang F,et al. RBM4 modulates the proliferation and expression of inflammatory factors via the alternative splicing of regulatory factors in HeLa cells[J]. Molecular Genetics and Genomics,2020,295(1):95-106.
[9]Yong H M,Zhao W,Zhou X Y,et al. RNA-Binding motif 4 (RBM4) suppresses tumor growth and metastasis in human gastric cancer[J]. Medical Science Monitor:International Medical Journal of Experimental and Clinical Research,2019,25:4025-4034.
[10]Wang Y,Chen D,Qian H L,et al. The splicing factor RBM4 controls apoptosis,proliferation,and migration to suppress tumor progression[J]. Cancer Cell,2014,26(3):374-389.
[11]Bechara E G,Sebestyén E,Bernardis I,et al. RBM5,6,and 10 differentially regulate NUMB alternative splicing to control cancer cell proliferation[J]. Molecular Cell,2013,52(5):720-733.
[12]Lee Y,Rio D C. Mechanisms and regulation of alternative pre-mRNA splicing[J]. Annual Review of Biochemistry,2015,84:291-323.
[13]Luco R F,Allo M,Schor I E,et al. Epigenetics in alternative pre-mRNA splicing[J]. Cell,2011,144(1):16-26.
[14]Lin J C,Tarn W Y. Exon selection in α-tropomyosin mRNA is regulated by the antagonistic action of RBM4 and PTB[J]. Molecular and Cellular Biology,2005,25(22):10111-10121.陳海元,朱晓妹,张所兵,等. 2个水稻叶片卷曲变窄突变体的遗传分析和基因定位[J]. 江苏农业科学,2021,49(2):37-43.
